IL-1基因多态性与腰椎间盘突出症伴坐骨神经痛发生风险的关系
2020-10-23李炯任东良杨金丰
李炯,任东良,杨金丰
(1.定兴县医院骨科,河北保定 071000;2.保定市第一中心医院骨科,河北保定 071000;3.定州市人民医院骨科,河北定州 073000)
腰椎间盘突出症是由于椎间盘变性、纤维环破裂,髓核突出后刺激或压迫神经根所表现出的临床综合征,以腰腿疼痛,间歇性跛行为主要症状[[1-2]。临床上因椎间盘退变而引起腰腿痛患病率高达60-80%,而由于腰椎间盘突出引起坐骨神经痛的患者占总人口数的5%。该病因病程长、易反复发作,严重影响患者的劳动能力及生活质量[3-5]。腰椎间盘突出症病理机制复杂,传统观点认为机械性压迫是引起神经根性疼痛的原因,但是近年来研究发现,遗传因素在椎间盘病变发生、发展中可能扮演着重要角色。有研究显示,白细胞介素-1(interleukin-1,IL-1)的释放与腰椎间盘突出后的坐骨神经根性疼痛相关[6-7]。本研究探讨IL-1基因3个位点IL-1A(rs1800587 C/T)、 IL-1B (rs1143627 T/C)以及IL-1RN (rs2234677 G/A)单核苷酸多态性与腰椎间盘突出症伴坐骨神经痛发生的相关性,为腰椎间盘突出症的病因研究、预防干预及康复工作提供理论依据。
1 资料与方法
1.1 研究对象
收集2016年5月-2018年1月期间于本院接受治疗且无血缘关系的腰椎间盘突出症患者。纳入标准:(1)年龄18~70岁;(2)影像学(CT或MRI)检查符合腰椎间盘突出症诊断标准[7];(3)临床症状表现为沿坐骨神经走向部位存在自发性或放射性疼痛或在臀部、腘窝、外踝等处存在压痛点,在喷嚏、咳嗽、负重或大便时疼痛加剧;(4)坐骨神经牵拉性疼痛,直腿抬高试验阳性(干性坐骨神经痛),弯腰(拾物)试验阳性(根性坐骨神经痛);(6)患者均签署知情同意书。排除标准:(1)伴有先天或后天腰椎椎体畸形;(2)合并脊柱结核、脊椎功能障碍或软组织、骨关节、椎管内肿瘤者;(3)合并严重心、肺、肝、肾、造血及内分泌系统疾病或其他慢性病者。
1.2 分组及随访
患者入院时均接受全面临床检查,评估疼痛程度以及感觉、运动功能障碍。入组患者采用保守疗法[牵引治疗、物理治疗(电疗、红外线疗法和热疗等)、推拿针灸治疗、封闭疗法、中药治疗]和手术疗法。对患者进行为期1年的随访,分别于6个月和12个月重复临床检查。随访过程中2例患者因搬去外地而退出研究,共获得96例患者的完整资料,其中,男51例,女45例,平均(45.3±6.2)岁,其它基本情况如表1所示。所有患者的临床数据的均在基因分型之前完成。本研究同时经医院伦理道德委员会审核通过。
根据等位基因将患者分组如下:(1)IL-1A与IL-1RN基因分组:①IL-1A C/C和IL-1RN G/G组(n=20);②IL-1A */T或IL-1RN */A组(n=53);③IL-1A */T和IL-1RN */A组(n=23)。 (1)IL-1B与IL-1RN基因分组:①IL-1B C/C和IL-1RN G/G组(n=9);②IL-1B */T或IL-1RN */A组(n=50);③IL-1B */T和IL-1RN */A组(n=37)。

表1 患者分组情况
1.3 资料采集
1.3.1 疼痛程度 采用视觉模拟评分法(visual analogue scale, VAS)进行评价。
1.3.2 生活质量 采用腰痛Oswestry功能障碍指数(Oswestry disability index, ODI)进行评价。
1.3.3 基因组DNA提取 使用全血DNA分提取剂盒(北京天根生化科技有限公司)从全血细胞中提取基因组DNA。受试者抽取3 mL外周静脉血,注入含有柠檬酸钠的抗凝真空管中,置于-70℃冰箱保存,实验时取出根据说明书操作。加细胞裂解液800 μL于37℃水浴过夜,次日加入Tris-饱和酚500 μL,10000 r/min离心20 min,吸取上清液加等体积酚-氯仿(1:1),同法再用氯仿提取,后加人异丙醇1 mL沉淀,12000 r/min离心10 min,弃上清,加入75%冰乙醇洗涤,7500 r/min进行干燥1 min, 40 μL无DNA酶去离子水溶解,紫外分光光度计测量DNA浓度及纯度,-30℃保存待用。
1.3.4 目的基因PCR扩增 应用Primer Premier 5软件设计引物,由上海英俊基因有限公司合成。扩增反应体系:模板DNA 4 μL,2×PCR缓冲液5 μL,上下游引物各1.5 μL,4×dNTP 4 μL,Taq聚合酶0.25 μL(大连TaKaRa公司),无菌去离子水补足总体积至50 μL,以去离子水作为阴性对照。95℃预变性10 min,94℃变性30 s,58℃退火30 s,72℃延伸1 min,反应进行35个循环后,置于72℃延伸10 min。使用ABI 7900HT序列检测系统(Applied Biosystems)检测扩增结果,使用SDS 2.2软件(Applied Biosystems)确定基因型。
1.4 统计方法
应用SPSS 19.0软件进行统计学分析,计量资料采用均数±标准差表示,进行单独分析以检查协变量年龄、性别、治疗方法和吸烟状态的潜在混杂效应。P<0.1的协变量保留在最终模型中。通过重复测量方差分析(rmANOVA)比较基因型的VAS评分和ODI评分随时间的变化。通过单因素方差分析检查椎间盘突出后12个月的VAS评分和ODI评分与不同IL-1A或IL-1B和IL-1RN基因型的组合作用的关系。P<0.05为差异有统计学意义。
2 结果
2.1 混杂效应
如表2所示,对于不同基因组和分组的患者,年龄与性别对VAS评分无影响,吸烟情况与治疗方式是影响VAS评分的混杂因素。性别对患者的ODI评分无影响,而年龄、吸烟情况与治疗方式是影响ODI评分的混杂因素。
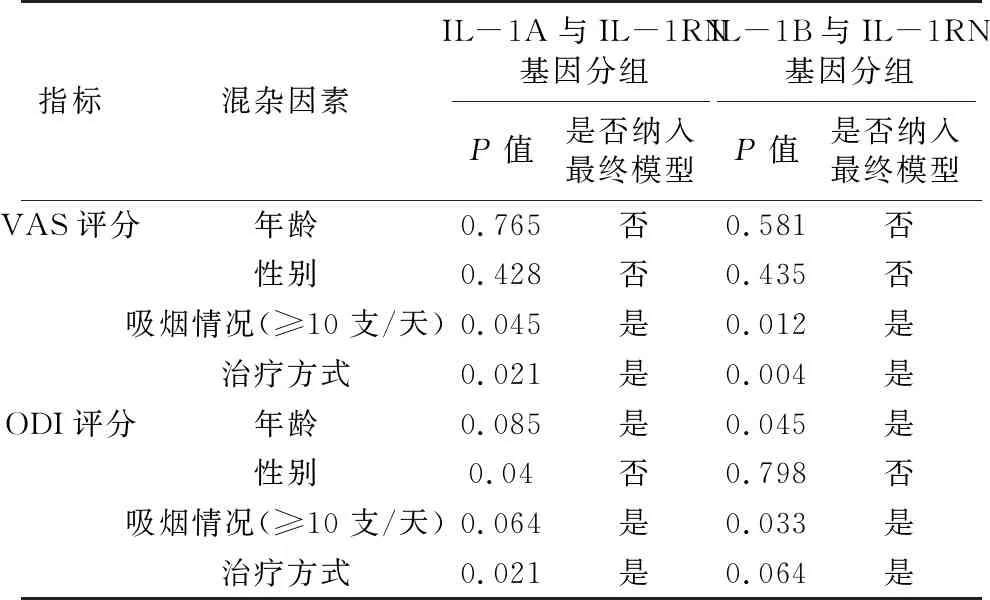
表2 潜在混杂因素对患者VAS评分、ODI评分的影响
2.2 不同等位基因患者VAS与ODI评分
经过治疗后,患者的VAS评分ODI评分均有所下降。如图1A所示,对于IL-1A与IL-1RN基因型组合,携带不同等位基因的患者VAS评分ODI评分差别无统计学意义(P=0.175;P=0.055)。图1B所示对于IL-1B与IL-1RN基因型组合,相对于同时携带IL-1B C/C和IL-1RN G/G基因的患者以及IL-1B */T或IL-1RN */A分组的患者,同时携带IL-1B罕见等位基因T与IL-1RN罕见等位基因A的患者VAS评分更高,疼痛程度更为严重(P=0.039),同时ODI评分也高于其他2组患者(P=0.027)。

图1A IL-1A与IL-1RN基因分组患者VAS、ODI评分变化
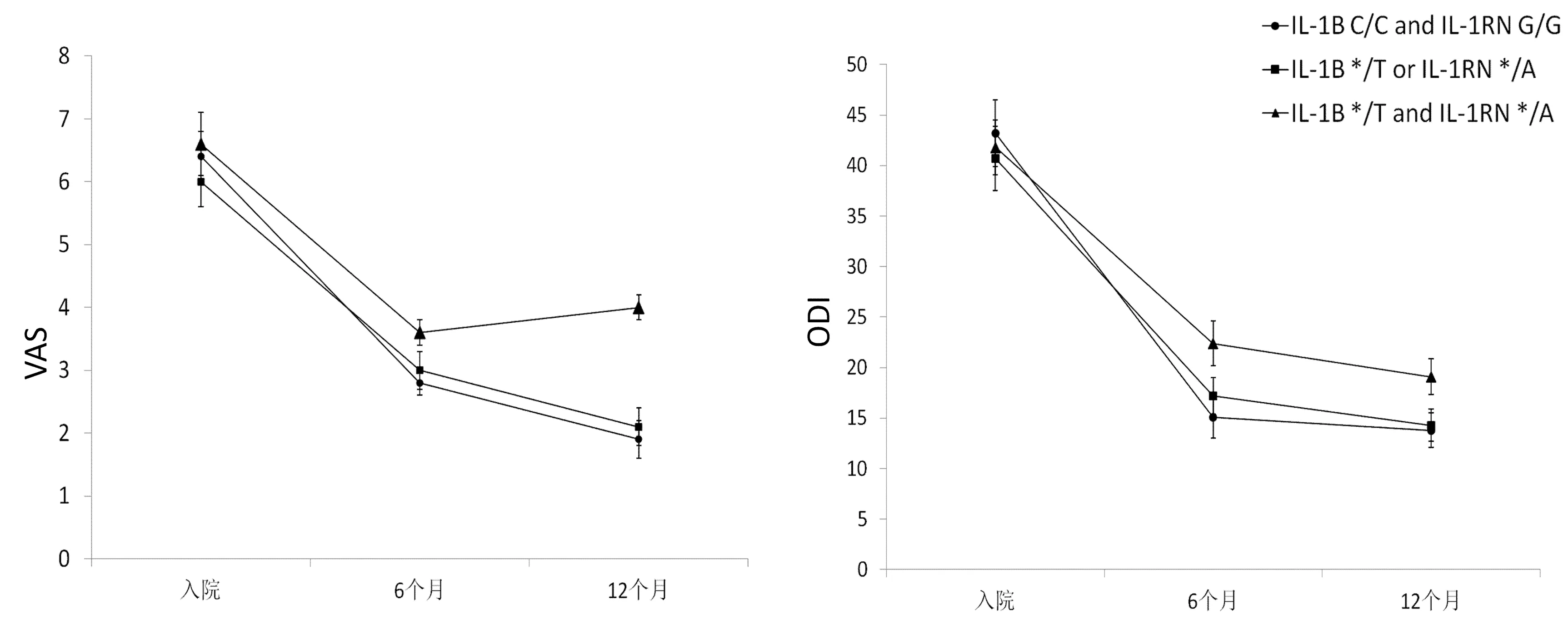
图1B IL-1B与IL-1RN基因分组患者VAS、ODI评分变化
2.3 12个月患者VAS、ODI评分
对12个月时采样的数据进一步分析,如表3所示,同时携带有IL-1B*/T和IL-1RN */A基因型的患者,1年后的疼痛严重,功能障碍恢复程度更差(VAS评分P=0.003,ODI评分P=0.050,单向ANOVA)。而对于IL-1A/IL-1RN基因型分组,各组患者均未观察显著性差异(VAS评分P=0.105,ODI评分P= 0.214)。

表3 12个月时患者的VAS与ODI评分
3 讨论
腰椎间盘病变由生理性退变、椎间盘损伤、脊柱过度负荷、吸烟等多种因素引起。先前研究表明,患者疼痛是由腰椎间盘突出压迫神经根所致,椎间盘突出后引起炎症反应和免疫反应,致神经根脱髓鞘改变,造成神经根充血性水肿且高度敏感,在此基础上受到轻微压迫或牵拉及发生剧痛[3,8]。随着现代分子生物学和分子免疫学的迅速发展以及细胞因子研究的深入,大量研究表明,退行性病变过程中,椎间盘髓核组织中的细胞因子如IL-1、IL-6和 TNF-α等起着重要作用[9-11]。IL-1被公认为是与椎间盘退变相关的最重要的炎性细胞因子之一,可刺激炎症细胞的聚集、激活和炎症递质的释放,可能在椎间盘退行性变的病理生理过程中发挥重要作用[6-7]。
对于某些可引起自身基质破坏而激发炎症反应的物质,椎间盘细胞有潜在合成的能力,在一定的诱因下可被激活。研究表明,IL-1和促炎细胞因子共同通过产生大量的水解酶而降解软骨细胞外基质蛋白,造成关节破坏[6]。有研究表明,腰椎间盘突出症患者组织中IL-1、前列腺素表达升高可能参与了疼痛反应过程,IL-1可增加椎间盘中前列腺素的含量,使神经末梢感受器敏感性增强,同时增强和延长组胺、5-羟色胺、缓激肽等致痛因子对神经末梢的致痛作用,并且IL-1的表达水平与神经性疼痛程度呈正相关[12]。一些遗传变异可能会影响这些过程并影响疼痛敏感性。有研究表明,IL-1的遗传变异可能会降低椎间盘突出后的疼痛阈值,IL-1基因多态性与腰神经根性疼痛患者疼痛强度增加和压力性疼痛阈值降低有关[13]。IL-1家族主要包括IL-1α、IL-1β和内源性IL-1受体拮抗剂(IL-1Ra)。IL-1α、IL-1β是强烈的炎症诱导剂,由单核细胞、内皮细胞和椎间盘细胞等多种细胞分泌,并通过内源性IL-1Ra的表达来维系平衡;IL-1Ra主要由单核细胞产生,不与IL-1直接结合,而是与α和β的两型受体相结合,阻断α和β发挥其生物学效应破坏作用[14]。
本研究分析了编码IL-1α、IL-1β和IL-1Ra的3个基因位点IL-1A C/T、IL-1B T/C和IL-1RN G/A的单核苷酸多态性对椎间盘突出症患者临床症状的影响。由于持续性疼痛与生活方式可能存在相互作用,因此在最终的统计分析中,通过对患者的治疗情况和吸烟情况进行了调整。所有患者在首次就医时均感受到剧烈的疼痛,同时生活质量严重受损。相对于IL-1B C/C和IL-1RN G/G基因的患者以及IL-1B */T或IL-1RN */A分组的患者,同时携带IL-1B罕见等位基因T与IL-1RN罕见等位基因A的患者疼痛程度更为严重,生活质量受损程度更高,而对于IL-1A与IL-1RN基因型组合,携带不同等位基因的患者则未出现显著差异。
对12个月时采样数据的进一步分析显示,同时携带有IL-1B*/T和IL-1RN */A基因型的患者1年后的疼痛严重、功能障碍恢复程度更差(VAS评分P=0.003,ODI评分P=0.050,单向ANOVA)。而对于IL-1RN基因型分组,各组患者均未观察显著差异(VAS评分P=0.105,ODI评分P= 0.214)。与C等位基因相比,IL-1B、T等位基因在mRNA和蛋白质水平上与增强的启动子活性相关,导致基因表达增加。此外,早期数据表明,IL-1RN的A等位基因在IL-1RN基因第二内含子上具有可变数目串联重复(VNTR)多态性,与体外单核细胞IL-1Ra合成减少和IL-1β产生增加有关[15]。因此,同时携带IL-1BT等位基因和IL-1RNA等位基因的患者IL-1水平相提高,导致IL-1受体激活增加,炎症反应更加明显。
对患者椎间盘样本的分析表明,IL-1与IL-1Ra的高比例可能与椎间盘退化有关。IL-1可诱导基质降解酶表达上调,并抑制蛋白多糖的再合成,从而促进椎间盘的退化。因此,IL-1可能间接促进伤害性传递,这可能解释了IL-1B*/T和IL-1RN*/A基因型患者疼痛经历的增加。
本研究表明,下腰部神经根疼痛与风险增加长期临床疼痛可能依赖于IL-1B*/T和IL-1RN */A基因型。然而,笔者未发现患者疼痛以及生活质量与IL-1A*/T和IL-1RN*/A基因型之间有联系。除了遗传因素外,其他风险因素如体力劳动因素、心理社会因素也可能导致持续性腰痛和残疾,因此IL-1基因型和椎间盘突出症患者持续性疼痛之间的联系可能与更复杂的机制有关,尚需进一步研究探讨。
