全氟和多氟烷基化合物的危害及在食品中的污染研究进展
2020-10-23丁林玉雷素珍曾红亮
丁林玉,雷素珍,曾红亮
(福建农林大学食品科学学院,福建福州 350002)
PFASs是一类所有或部分氢原子被氟原子所取代的新型持久性有机污染物。PFASs主要包括全氟羧酸(Perfluoroalkyl carboxylic acids,PFCAs)和全氟磺酸(Perfluoroalkane sulfonic acids,PFSAs)。PFASs具有高能量的C-F共价键,难以水解、光解、被微生物降解和被动物体代谢,因此其在环境中具有持久存在,并可通过食物链蓄积的特点。这种物质常被用作某些商品的防护涂层,如不粘锅、食品防油涂料和食品包装材料,是常见的家庭用品。研究显示,空气、水源和土壤中都含有PFASs,这种化合物甚至在植物、动物和人类中都被检测到[1-2]。早在二十世纪就发现环境中存在PFASs,随着研究的逐渐深入,出现了许多关于PFASs的动物模型、毒理学等方面的研究,说明PFASs已经对生物体产生毒害作用[3]。
近年来,研究者们不断在人体中发现PFASs的存在,PFASs的累积问题日趋严重。Kannan等[4]分别测量了全氟辛烷磺酸盐、全氟己基磺酸盐、全氟辛酸和全氟辛烷磺酰胺的浓度,所选样本为来自美国、比利时和韩国等国家的九个城市的473份人体血液/血清/血浆样本。在这四种含氟化合物中,全氟辛烷磺酸盐(Perfluorooctane sulphonate,PFOS)是血液中含量最高的物质,全氟辛酸(Pentadecafluorooctanoic acid,PFOA)次之。PFOS浓度最高(>30 ng/mL)的国家为波兰和美国;浓度最低(<3 ng/mL)的国家为印度;其他国家的浓度范围为3~29 ng/mL。这些结果表明,四种含氟化合物浓度之间的关联程度随样品来源的不同而存在差异,不同国家对这些化学品的暴露模式存在差异,发达国家血清样本中的含氟化合物含量较发展中国家高。以我国9个城市85个血清样本进行分析的研究显示:9个城市样品中不同全氟化合物(Perfluorinated compounds,PFCs)的含量之间存在差异,其中最主要的为PFOS,金坛样本中的PFOS平均浓度最低(3.72 ng/mL),沈阳样本中的平均浓度最高(79.2 ng/mL)[5]。2019年一项对武汉市一般人群血清的检测数据表示,年龄会导致人体内PFOS和PFOA出现差异,其中儿童组的PFOS和PFOA检出率分别为75.4%和80.5%,成人组分别为83.3%和82.9%[6]。
本文概述PFASs的累积情况,重点分析PFASs对人体的危害和PFASs的最新研究。了解PFASs在食物和环境中的累积情况对科学研究具有重要意义,综述PFASs的污染来源和危害等,可以加深对PFASs的了解,从而为减少人体内PFASs的残留、开创新的检测方法、提高检测标准和检测方法的准确性提供参考,为我国食品产业的开展和疾病预防提供依据。
1 PFASs的特性及毒性通道的探索
PFASs又被称为碳氟化合物,是一种脂肪烃化合物,具备较高的热力学稳定性和化学稳定性,C-F键赋予PFASs耐水解、光解、微生物降解的特性[7-10]。PFASs根据其碳链长度可分为短链(C2~C5)、中链(C6-C10)、长链(>C10)。目前PFASs在全球范围内的人类血液、母乳及某些偏远地区如北极等均被检测到,相比于有机氯农药和二噁英等持久性有机污染物,PFASs在动植物体内的积累程度是前者的数百到数千倍,联合国环境规划署已将其列入《斯德哥尔摩公约》禁止的持久性有机污染物(Persistent organic pollutants,POPs)名单[11-13]。PFASs的不可降解性、危害性、生物积累性,使得人们对它的担忧日益增长。目前世界上已知的PFASs有3000多种,全氟辛酸和全氟辛烷磺酸盐是其中影响最大、最重要的两种[14-16]。研究表明,PFASs已经进入环境,并通过食物链进入人体组织器官,可能造成不可预估的危害[17-18]。北美和欧洲的居住者也许会经历无处不在和长期摄入PFOS和PFOA的风险,剂量范围分别为每天每千克体重3~220和1~130 ng/kg bw/d[19]。同时由于其不可分解的特性,可能会在人体长久存在并积累。
对于全氟烷基化合物毒性通道的探索现有研究如图1所示,一方面,全氟烷酸化合物(Perfuoroalkyl compounds,PFAAs)能够与凝血酶受体(Thrombin receptor,TR)结合,促进TR激活效应,从而干扰甲状腺功能;另一方面,PFAAs与Src同源酪氨酸磷酸酶(Src homology phosphotyrosyl phosphatase-2,SHP-2)联合,抑制P-Paxillin去磷酸化,提高paxillin磷酸化水平[20]。
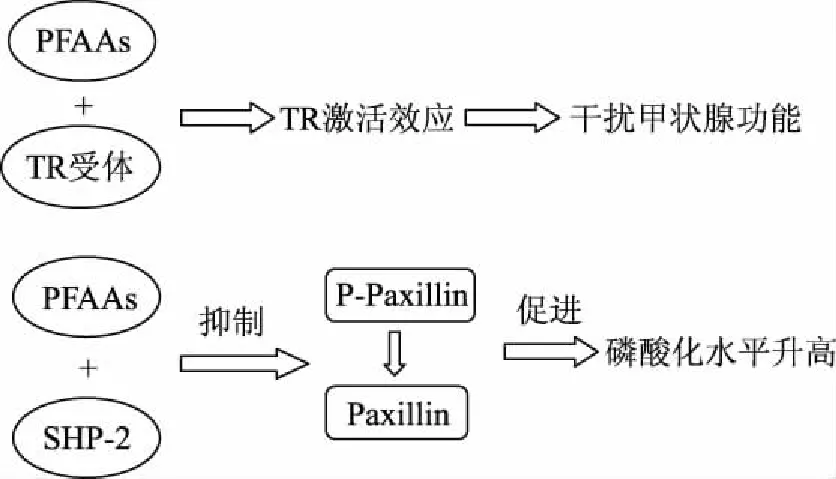
图1 全氟烷基化合物毒性通道机制
2 PFASs在食物中的存在情况
PFASs的半衰期时间长,人类血清中PFOS的半衰期可达约5.4年,PFOA的半衰期约为3.8年,其生物累积性和毒性使得这类含氟化合物的健康风险评估不可小觑[21]。经食物链的富集作用,各类食物中的PFASs暴露状况存在差异。食品中PFOS和PFOA的平均浓度分别可达0.05~1.99 ng/g鲜重和0.06~12.5 ng/g鲜重[22]。PFASs相继在饮用水、母乳及乳制品、肉类、蛋类、水产品等食品中被检出[23-32]。其存在情况如表1所示。
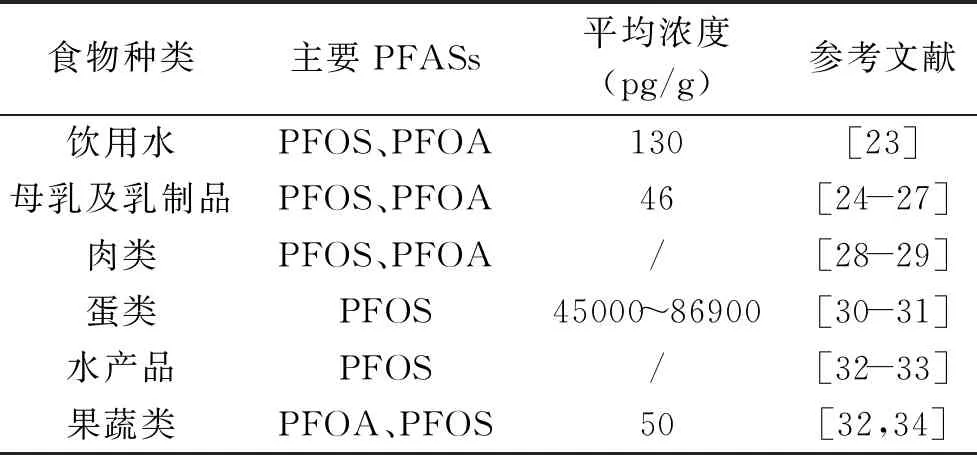
表1 PFASs在我国各类食品中的存在情况
2.1 饮用水
除了最常见的PFOS和PFOA,许多短链PFCs在各个国家的饮用水中也普遍存在。根据2006年~2008年间从中国、日本、印度、美国和加拿大收集的自来水样品进行定量分析,分析结果显示:我国上海地区水样中的全氟化合物含量最高(130 ng/L),日本富山水样中的全氟化合物含量最低(0.62 ng/L),不同地区的污染水平和污染源存在差异,特别是工业发达的地域污染更为严重,这可能与当地工业化生产排放的大量有害气体和废水有关,通过大气沉降和水循环进入表层水,进而渗入饮用水系统[23]。在饮用水中能检出多种多样的PFASs,但目前还没有关于多种PFASs协同作用的研究及发现。对于饮用水中的污染问题,通过加强净水处理系统,提高检测标准,可以有效降低污染程度。
2.2 乳及乳制品
乳及乳制品的危害对象主要是婴幼儿和老年人等特殊人群,特别是婴幼儿这一群体。通过对PFASs从饲料中转移到奶牛组织和乳中的情况的研究发现,PFASs能够在体内聚集且转移至乳汁[24]。Fujii等[25]收集了90个来自日本、韩国和中国的母乳样本,并对中国和日本零售商店的婴儿配方奶粉(n=9)进行了分析,发现在这三个国家60%以上的母乳和奶粉样品中检测到PFOA,其中PFOA的中位浓度在中国为51 pg/mL(61%)。在中国12个省份的1237个母乳样本中发现,PFOS和PFOA是所有样本中含量最多的PFCs[26]。PFOS浓度的几何平均值(检测数据x1,x2,…,xn之积的n次方根)为46 pg/mL;PFOA浓度的几何平均值为46 pg/mL,黑龙江、辽宁、河北和上海等12个省份均受到不同程度的PFOA和PFOS污染。且这十二个省份中,来自上海的母乳中被发现有较高浓度的PFOA(农村样本为814 pg/mL,城市样本为616 pg/mL),上海PFOA的估计膳食参考摄入量(Estimated daily intakes,EDI)为88.4 ng/kg/d,而其推荐可耐受日摄入量约为100 ng/kg/d。在最近的研究检测中发现,婴幼儿乳制品中总PFCs(PFOS、PFOA和PFHxA)浓度为35.3~282.8 ng/kg[27]。PFASs在母乳和乳制品中的污染程度较高,将对婴幼儿的生长发育产生危害。因此,应全面评估母乳喂养对婴儿出生后接触的潜在健康影响。
2.3 肉类
肉类产品是优质蛋白质的来源,但肉类产品中大都含有PFASs,含量最多的是PFOA和PFOS,猪里脊肉中二者含量分别为0.04和0.08 ng/g,猪肝中为0.33和1.18 ng/g,鸡肉中未检出PFOA,鸡肝中的PFOA(0.12 ng/g)高于鸡胸(0.03 ng/g)[28-29]。可见,猪肉样品中的PFASs含量高于鸡肉样品,肝脏组织中PFASs的含量高于肌肉组织。肉类食品是食品中PFOA的重要来源,肝脏是毒素积累的主要场所。身体的许多毒素会在肝脏积累,PFASs也不例外,随着血液流动不断迁移,PFASs最终停留在肝脏,从而导致肝脏组织中的PFASs含量高于肌肉组织。
2.4 蛋类
蛋类亦是优质蛋白质的来源之一,且使用广泛,除三餐摄入之外,也是许多甜品、蛋糕的主要成分。对中国南京、金坛、山东等8个地区的鸡蛋进行取样分析发现,PFOS在鸡蛋蛋黄中广泛存在,而蛋白中检测到的含量极少(<0.08 ng/g),PFOS在鸡蛋中的含量水平为45.0~86.9 ng/g[30]。齐彦杰等[31]对鸡蛋和鸭蛋进行了样品采集,采集的样本来自北京市14个主要蛋类批发市场中的59个摊位。该研究在鸡蛋中测出9种PFASs,鸭蛋中测出10种PFASs,鸭蛋中PFCs的含量为鸡蛋含量的3.4倍左右。许多研究表明,PFASs在我国蛋类产品中的聚集程度要比其他国家高,特别是一些污染情况严重的工业化地区。尽管蛋类食物不是饮食结构中的主要部分,但鸡蛋常被用于制作其他食品,如蛋糕、面包、冰激凌等,对于喜爱蛋制品的人来说,摄入PFASs的风险加大。
2.5 水产品
在水中生活的生物始终生长在含有PFASs的水体中,这使得其体内的PFASs不断聚集。以天津大黄堡湿地地区的鱼为研究对象发现,鱼体中有多种PFASs,其中PFOA含量低于PFOS含量,鲤鱼对人体每日可贡献2.6 ng PFOA和104 ng PFOS,而鲶鱼的贡献量分别为1.7 ng和39 ng[32]。这是由于PFOA的水溶性比PFOS好,生物富集能力低,不利于吸收利用,易于从体内排出。王旭峰等[33]曾在广州市水产品体内检出23类PFASs,结果显示,PFASs在所有样品中的检出率为93.5%~100%。
2.6 其他
蔬果是每日饮食的主要组成成分,富含多种维生素和矿物质。但在马铃薯、大白菜和萝卜等蔬菜中可检测到PFASs,蔬菜中的PFOA含量约在0.05~0.84 μg/kg(湿重)之间,PFOS含量在0.051~0.42 μg/kg(湿重)之间,地下部位高于地上部位,污染物的含量较鱼肉类低[32,34]。尽管在瓜果蔬菜类食品检测出的PFASs含量较低,但按照中国居民膳食指南的倡导和建议,每日应摄取300~500 g蔬菜,200~350 g水果。即虽然蔬果类食品含PFASs较少,但摄入量大,最终通过蔬果类食品进入人体的PFASs总量不低。
3 食品中PFASs的污染来源
随着PFASs陆续在各类食品中被发现,研究者们开始关注食品中PFASs的来源。许多研究表示,PFASs主要通过环境进入动植物组织器官,并逐渐积累,而这些动植物经过人类的加工利用,成为餐桌上的食品,存在潜在危险。许多可供食用的动植物体内污染物的来源如表2所示:

表2 动植物体内PFASs的污染来源
3.1 大气
大气中的污染物不仅可以通过呼吸进入动植物体内,也可以随雨水沉降在土壤中积累,渗入地下表层水,随饮用水进入动植物体内。以北京大气为例,北京地区大气中的PFASs含量约为10.1~62.9 pg/m3,PFASs的富集程度与地区、气候、以及化合物种类有关[35]。北京地区的PFASs由北至南污染程度逐渐增加;雾霾天气大气颗粒物中的PFASs浓度明显高于晴天,约是晴天的三倍;不同种类的PFASs的聚集度根据颗粒物的大小不同;不同粒径的大气颗粒物对PFASs不同化合物的聚集能力不同,中链PFASs如全氟辛酸、全氟辛烷磺酸盐、全氟壬酸和全氟癸酸等更易聚集[35]。同时许多人为排放的持久性有机污染物更偏向于集中在大气颗粒物中,这可能与有机污染物多以烟雾形式排出有关,大气相较于土壤和地表水可能含有更多的PFASs。
3.2 土壤
土壤中PFASs对食物的污染主要表现在植物性食物上,植物大多以土壤为媒介,吸收机体所需矿物质和水。在东部农村地区的所有样本中均有PFASs的发现,其中以PFOA为含量最多的污染物,污染程度存在地区差异性,总体呈现由南到北递减的趋势,浓度范围为0.34~14.5 ng/g,平均值为2.51 ng/g[36]。土壤污染可通过三个途径发生,分别为施肥灌溉、废弃物堆积、经其他介质向土壤中迁移转化。由南至北土壤湿润度和水量不断下降,污染物经灌溉和水进入土壤的机会大大减少,成为PFASs污染物由南到北递减的原因之一。
3.3 地表水
植物根系的吸收作用可以将污水中的有害物质一同吸收,并向上转移至茎、叶和果实,不断积累产生危害,动物饮用水后亦可使水中的污染物质在体内循环并积累。通过对中国东部农村地区和日本各地142个地表水样品的测定发现,所有地表水样本均检出相关污染物,PFASs和其他化合物主要为PFOA和PFOS[36-37]。日本河流样本中PFOS的均值为2.37 ng/L,滨海水样的均值为1.52 ng/L,不同地区水样中的污染物含量存在差异[37]。在中国东部农村地区,PFOA均值为2.9 ng/L,其含量在不同地区也存在差异,呈现南高北低的形势,其中大气沉降的贡献较大,且不考虑耗散动力,受污染土壤中的大部分PFOA和PFOS被输送到地下水和地表水水体[38]。
4 PFASs的危害
4.1 PFASs可致心肌发育毒性
张莹莹[39]以胚胎干细胞测试(Embryonic stem cell test,EST)体系为基础,测得在PFOS、PFOA、全氟丁基磺酸(Perfluorobutane sulfonate,PFBS)三者中,心肌发育毒性最大的是PFOS,最小的是PFBS;随着碳链长度的不断增长,心肌发育的毒性大小也不断增大,若碳链末端发生磺酰化,则其毒性将大于碳链末端非磺酰化的物质。该研究所测得的三种PFASs均会导致心肌发育毒性,且研究结果显示毒性大小与碳链长度呈正相关关系,三者之间有明显的构效关系。
发育毒性会导致个体生长发育迟缓,对组织器官有致畸作用,通过对核酸翻译和表达的干扰,一些化学物质甚至对胎儿有致死作用,造成自然流产或死产、死产率增加。
4.2 PFASs可使细胞膜病变
Wen等[40]发现PFOS影响细胞寿命的作用机制为:通过对细胞膜和线粒体功能的破坏,阻断细胞间的连接。2016年,有研究进一步分析探索了PFOS对心肌细胞生长发育中线粒体的损伤作用和机制,该研究基于PFOS致小鼠胚胎干细胞(Embryonicstem cell,ES cell)定向心肌细胞分化毒性作用差异蛋白表达谱结果发现,PFOS的损伤作用机制为:一方面,通过降低线粒体膜电位使腺嘌呤核苷三磷酸(Adenosine triphosphate,ATP)产量减少,乳酸产量增加,脂肪酸堆积;另一方面,PFOS激活Rictor信号分子,促进胆固醇调节元件结合蛋白(Sterol-regulatory element binding proteins,SREBPs)裂解,脂肪酸堆积,线粒体内质网Ca2+浓度减少[41]。
细胞膜作为半透膜,能进行膜内膜外的物质交换、吸收和利用营养物质,排出代谢产物,通过胞吞胞吐运输大分子物质。它不仅能使细胞维持细胞内环境的稳态,还能调节和选择细胞内外的物质。一旦细胞膜功能被破坏,将导致细胞内环境失衡,细胞代谢失衡,甚至导致细胞死亡。
4.3 PFASs可使人体胆固醇水平变化
一组研究人员依据美国健康和营养考察的资料,探究了血液中胆固醇含量与四种普通PFASs(全氟辛酸、全氟壬酸、全氟辛磺酸和全氟己磺酸)之间的相关性[42]。研究发现,PFASs含量高的调查者体内的“坏胆固醇”(低密度脂蛋白胆固醇)含量明显高于PFASs含量低的调查者。
该研究表明,PFASs使人体内的低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)含量增加,而“坏胆固醇”含量若高于正常水平常会引发冠心病等心脑血管疾病,若LDL-C含量超过推荐的安全阈值,多余的LDL-C会吸附在动脉壁上,逐步形成硬化斑块,堵塞血管,减慢血流速度。对于肝功能不全的特殊人群,“坏胆固醇”含量长期偏高,将诱发脂肪肝等疾病。
5 食品中PFASs的研究进展及应对措施
5.1 改变饮食习惯
过去,研究者们发现大多数食物中含有PFASs,污染物主要是通过环境的大气、土壤和水源进入食物链,由此在人体积累并产生潜在危害。近年来,研究者们意识到,食品包装材料和一次性餐具等消费品中隐藏着大量PFASs化合物,这类产品与食物直接接触,在高温条件下迁移到食物表面,随饮食进入人体[43]。经常在家就餐的人血液中所含的PFASs水平较低,而经常在外就餐的人,血清中的PFASs含量更高[44-45]。这些研究表示,餐厅的食物很有可能受到了PFASs的污染,而污染的来源可能是食品接触材料,PFASs存在于食品接触材料中,在使用过程中会残留或转移出一部分副反应产物或短链氟化物,经过与食品的接触进入消化道,吸收利用后残留在血液和组织器官中,危害人体健康。因此,要降低PFASs对机体的危害,首先应改变不健康的饮食习惯和不规律的生活方式。血液中合成化学物质的来源可能包括外卖食品包装,包装中的PFASs通过迁移进入食物,增加在家就餐的频率,减少在外就餐的次数,可以降低PFASs的危害。
5.2 开发有益的生物活性成分及菌株
许多生物活性成分及菌株被证明对PFASs引起的相关疾病有减缓作用。多功能干酪乳杆菌对PFOA具有较好的吸附性,在发酵食品中使用可以缓解PFOA对人体造成的各种损伤,对于PFOA相关的各种潜在疾病也有减缓作用[46]。在生物活性成分枸杞多糖(Lycuim barbarum polysaccharides,LBP)的动物学实验中发现,LBP对缓解由于PFASs引起的生殖毒性起作用,且效果最佳量为80 mg/kg[47]。新物质的开发可为预防PFASs引起的潜在疾病提供参考,减缓PFASs对人体的危害。
5.3 选择适合的检测方法,严格执行标准
尽管有近3000种PFASs,但美国环保局只对两种物质进行了健康评级:PFOA和PFOS。对于其他类型的PFASs,世界各国还没有统一标准和合适的检测方法。当前已被用于检测PFASs的方法有:固相萃取-超高效液相色谱-电喷雾串联质谱法、液相萃取-高效液相色谱-串联质谱联用法、分散固相萃取结合高效液相色谱-串联质谱法等,这些方法大多被用于检测环境、动植物体内的PFASs含量[48-50]。在检测奶类、蛋类食品中PFASs含量的研究中,通过优化色谱质谱条件,运用固相萃取结合高效液相色谱串联质谱技术,目标物可以获得较好的回收[51]。对于食品包装材料中的PFASs,固相萃取-液相色谱-串联质谱方便、快速,是较好的检测方法,使用该检测法检测的16种PFASs具有良好的线性关系,相关性强[52]。
我国现行的国家标准使用液相色谱-串联质谱法对食品接触材料及制品中的PFOS和PFOA进行检测,规定PFOS和PFOA的检出限均为1.0 ng/g,定量限均为2.0 ng/g[53]。美国环保署发布的健康公告表示,水中PFOA和PFOS含量之和不应超过70 ng/L[54]。我国暂未制定水质方面的相关标准,但我国已对动物源性食品中的PFOA和PFOS出台标准(检出限分别为0.002和0.02 μg/kg,定量限分别为0.01和0.1 μg/kg)[55]。目前世界各国尚未制订具体食品中的限量要求,加强各种产品,特别是食品包装材料中PFASs的风险管理,严格标准,可减少PFASs的滥用。
5.4 寻找更合适的替代物
PFASs的危害主要表现在难降解和易积累,特别是长链PFASs,因此许多国家和地区开始限制长链PFASs的使用,并寻找新的替代品。目前已知的替代品主要分为三类:短链PFASs、碳氢杂型替代品、氧杂型替代品。这三类替代品由于官能团、碳链长短等结构不同,对人体蛋白质的结合能力、组织器官的毒性作用存在差异。化合物碳链越强,与蛋白质的结合能力越强,对生物体的危害越大。相比于典型的PFOA和PFOS,碳氢杂型替代品与蛋白质的的结合能力较弱,危害较小[56]。许多传统的PFASs已经逐渐退出市场,新的替代品开始被广泛使用,但尚未有足够的研究表明这些替代品的危害更小、蓄积能力更弱。
6 展望
近年来国际上不断加强对PFASs的管理,尤其是随着外卖行业的快速发展,食品接触材料的使用越来越频繁,来自食品接触材料和包装中的污染进一步扩大了氟暴露程度。这些材料在生产和使用过程中,除了常见的PFOA和PFOS化合物发生迁移,许多的前体物质也会被释放到环境中,其持久性、积累性、潜在性,使得暴露风险不断加大。虽然许多研究显示,目前环境和动植物体内的PFASs含量尚达不到致死剂量,每日PFASs摄入量低于欧盟设定的健康标准(PFOS:150 ng/kg/d,PFOA:1500 ng/kg/d)[57]。但是动植物体内的PFASs并非单一存在,而大多数研究都集中在单一化合物上,多种化合物同时存在的协同效应方面的研究亟待补充和进一步探讨,PFASs的生物积累性,不可消解性,难以预估其潜在危害。另外当前研究多以动物为研究对象,外推至人的毒理学研究和风险仍需进一步探讨,应切实展开相关健康风险评估。
