黑菊芋水提液对便秘小鼠润肠通便作用的研究
2020-10-23姬妍茹张正海杨庆丽滕春波魏连会
姬妍茹,张正海,杨庆丽,滕春波,石 杰,董 艳,魏连会,高 媛,潘 静
(1.黑龙江省科学院大庆分院,黑龙江大庆 163319;2.东北林业大学生命科学学院,黑龙江哈尔滨 150040)
菊芋(HelianthustuberosusL)又名洋姜(Jerusalem artichoke),是菊科向日葵属唯一能够形成地下块茎的草本植物,原产自北美洲[1],十七世纪传入欧洲,后传入中国,主要食用部位为块茎,块茎中水分占比为80%左右,其次为17.0%左右的碳水化合物,碳水化合物中最主要的成分是菊糖,约占55%~83%[2]。菊糖具有双向调控血糖、改善肠道和防治便秘等功能[3]。菊芋菊糖主要成分为果聚糖,是已知的唯一一种被科学论证过的符合益生元定义的可食用性不被消化多糖[4-5],李琬聪[6]研究发现菊糖的生物活性与聚合度之间遵循“低聚合度活性高”的规律,以三聚和四聚菊糖活性最佳,聚合度大于五的菊糖益生活性减弱,但五聚到八聚菊糖之间的活性差异不显著。低聚果糖通常指蔗果三糖、蔗果四糖和蔗果五糖的混合物,食用后,不被胃和小肠消化吸收,可被大肠内的益生菌利用,增加大肠内粪便的含水量及膨化能力,产生乙酸、丙酸和丁酸等短链脂肪酸(SCFA)[7],起到抑制沙门氏菌等致病菌生长,刺激肠蠕动,净化肠道环境,增强胃肠功能,预防和缓解便秘的作用[8-9]。鲜菊芋以腌制酱菜为主,口感脆硬无特别味道,经变温工艺加工后,颜色变为黑褐色(因此称之为黑菊芋),水分含量显著减少,酸度升高,糖类、氨基酸和挥发性成分的种类和含量均产生变化,其中尤以糖类变化最大。果聚糖逐渐分解为单糖、双糖和低聚果糖等小分子糖类物质,还原糖含量显著上升,占40%以上,是鲜菊芋的几十倍,赋予黑菊芋酸甜软弹的口感[10]。
便秘是一种常见的肠道疾病,发病率较高,在全世界的平均发病率为16%,我国发病率为20%~30%[11],且有逐年上升的趋势。该病的特点是结肠传输功能低下,内容物在肠腔传输缓慢,临床表现为排便困难、次数减少、粪便干硬、便意减弱甚至消失,同时伴有腹痛、腹胀[12-13]。个体的便秘症状差异较大,目前临床上主要以缓解排便困难,恢复肠道动力为治疗目标,应用的药物以西药泻剂为主,短期内效果明显,但长期服用易产生药物依赖,出现腹胀、维生素吸收障碍等副反应[14]。便秘的发生一般伴随着肠道动力及菌群失调,具有益生元功能的食物可以有效缓解或者改善症状。很多源于植物或大型真菌的天然碳水化合物被证实具有潜在的益生元功能[15-16],鲜菊芋富含菊糖和膳食纤维,具有调节肠道菌群、预防便秘的功效,加工成黑菊芋后,口感上易于为消费者接受,但其多糖组成发生改变,是否会影响原有功效,值得去深入探讨。
本研究以水为溶剂获得黑菊芋提取液,对其进行多糖组成分析。同时以KM小鼠为研究对象,建立复方地芬诺酯便秘小鼠模型,探讨黑菊芋水提液对便秘小鼠肠推进运动和排便功能的影响,为揭示黑菊芋的保健功效提供数据佐证。
1 材料与方法
1.1 材料与仪器
菊芋 “庆芋2号”品种,收获于黑龙江省大庆市星火牧场;黑菊芋 以“庆芋2号”品种菊芋块茎为原料,利用黑龙江省科学院大庆分院自制设备生产;复方地芬诺酯 长春长红制药有限公司;酚酞片 山西亨瑞达制药有限公司;小鼠饲料 北京科澳协力饲料有限公司;墨汁 北京一得阁墨业有限责任公司;乙酸、丙酸、丁酸、戊酸 色谱纯,德国Dr. Ehrenstorfer公司;果糖、葡萄糖、蔗糖 色谱纯,北京中科仪友化工研究院;SPF级健康雌性KM小鼠 体重20~22 g,购于长春市亿斯实验动物技术有限公司(许可证号:SCXK(吉)-2018-0007)。
Master-D UF型超纯水机 上海和泰仪器有限公司;LDZX-40SCI型立式自动电热压力蒸汽灭菌器 上海申安医疗仪器厂;GT10-1型高速离心机 北京时代北利离心机有限公司;VFD-4500型冷冻干燥机 北京博医康实验仪器有限公司;GCMS ISQ LT气相色谱质谱仪 美国Thermo Fisher Scientific公司;Epoch酶标仪 美国BioTek公司。
1.2 实验方法
1.2.1 鲜菊芋和黑菊芋水提液的制备 黑菊芋的制备:以鲜菊芋块茎为原料加工而成,方法见参考文献[17]。水提液的制备[6]:将鲜菊芋和黑菊芋切成厚度约1.5 cm左右的片后,分别称取200 g,加入5倍的蒸馏水浸泡过夜,匀浆后80 ℃,150 W功率超声30 min,六层纱布过滤,滤液冻干,加入蒸馏水复溶并定容至200 mL,冰箱冷冻保存,准备用于肠推进实验和排便实验。
1.2.2 提取液多糖检测 菊糖含量检测采用总糖减去还原糖的方法[18]。总糖测定采用苯酚-硫酸法[19],还原糖含量测定采用DNS法[6],以果糖计;果糖、葡萄糖和蔗糖含量的测定参照国标的方法[20],分别以果糖、葡萄糖和蔗糖标准品浓度为横坐标,以峰面积为纵坐标绘制标准曲线。色谱柱:Agilent ZORBAX NH2柱(5.0 μm×4.6 mm×150 mm);流动相为乙腈-水(70∶30),等度洗脱,流速为1.0 mL/min;进样量1.0 μL;柱温30 ℃。检测器为蒸发光散射检测器(ELSD),漂移管温度80~90 ℃,氮气压力350 kPa;撞击器:关。果糖标准曲线方程为:Y=2221.4X+310.7,R2=0.9993;葡萄糖标准曲线方程为:Y=1944.9X+472.4,R2=0.9997;蔗糖标准曲线方程为:Y=2597.7X+222.0,R2=0.9993。
1.2.3 肠推进实验设计 参照保健食品检验与评价技术规范(2003版)中关于通便功能检验的方法进行。环境条件为(25±2) ℃温度、50%±5%湿度、自由取食进水。健康KM雌性小鼠54只,适应性饲养5 d后,称量小鼠体重,随机分为9组,每组6只。除空白对照组(CK)灌胃无菌生理盐水,其余8组给予10 mg/kg bw复方地芬诺酯建立小鼠便秘模型。灌胃30 min后,CK组和模型对照组(MC)只灌胃生理盐水;阳性对照组(AC)给予含20.0 mg/kg bw的酚酞悬浊液;鲜菊芋和黑菊芋干预组,给予相当于正常人(60 kg)日食用30 g鲜菊芋和黑菊芋的量,设低、中、高剂量组,鲜菊芋低、中、高剂量组分别用RL、RM、RH表示,黑菊芋低、中、高剂量组分别用BL、BM和BH表示,对应给药量为2.5、5.0、10.0 g/kg bw,给药剂量为0.2 mL/10 g bw。连续灌胃7 d后,各组禁食不禁水16 h,称量小鼠体重,然后CK组灌胃无菌生理盐水,其余8组给予10 mg/kg bw复方地芬诺酯,30 min后,各组分别灌胃含相应受试物的墨汁,25 min后脱颈椎处死小鼠,取出自幽门至回盲部的整段小肠,测量小肠全长和墨汁前沿在小肠内推进的距离,计算墨汁推进率。

1.2.4 小鼠排便实验 参照《保健食品检验与评价技术规范(2003版)》中关于通便功能检验的方法进行。实验设计同肠推进实验,小鼠单笼饲养,正常饮食和进水。从灌胃墨汁开始计时,记录每只小鼠首次排出黑便的时间、6 h内排出黑便的粒数及质量,观察并收集粪便,迅速于-80 ℃冰箱冷冻,用于短链脂肪酸(SCFAs)含量的检测。
1.2.5 小鼠粪便短链脂肪酸含量的测定 采用气相色谱质谱联用方法(Gas Chromatograph Mass Spectrometer,GC-MS)进行检测。
样品前处理:取0.3 g粪便样品加入2.0 mL磷酸水溶液(1∶3),涡旋匀浆2 min,加入1.0 mL乙醚萃取10 min,0 ℃条件下,4000 r/min离心20 min,取上清;再加入1.0 mL乙醚萃取10 min,以同样条件再次离心20 min;将两次萃取液合并挥发至1.0 mL以内,进样分析。
分别以乙酸、丙酸、异丁酸、正丁酸、异戊酸和正戊酸标准品浓度为横坐标,以峰面积为纵坐标绘制标准曲线。
色谱条件(GC):色谱柱为TG WAX(30 m×0.25 mm×0.25 μm),进样器温度:240 ℃;程序升温:初始温度100 ℃,保持5 min,随后以5 ℃/min的速率升温到150 ℃,再以30 ℃/min的速率升温到240 ℃,保持30 min;载气(Ne),流量为1.0 mL/min;分流比为75∶1;进样量为10 μL。
质谱条件(MS):EI源轰击电压:70 eV,单离子扫描模式:定量离子60、73,离子源温度:200 ℃,连接线温度:250 ℃。
乙酸的标准曲线方程为:y=213687.5832x-492.9102,R2=0.9999;丙酸的标准曲线方程为:y=117413.8232x-1808.1544,R2=1.0000;异丁酸的标准曲线方程为:y=226423.6296x-4004.5454,R2=1.0000;正丁酸的标准曲线方程为:y=779726.6220x-3154.8745,R2=1.0000;异戊酸的标准曲线方程为:y=680468.4445x-8606.3205,R2=1.0000;正戊酸的标准曲线方程为:y=958627.3557x-1624.8999,R2=1.0000。
1.3 数据处理
本文中每个处理为6次重复,表格数据表示为平均值±标准误(Means±Sem),组间显著性差异由单因素方差分析(One-way ANOVA),并进行Turkey事后检验,显著性差异分析由DPS V7.05软件进行,P<0.05时认为具有显著性差异。
2 结果与分析
2.1 水提液多糖含量对比
由图1可知,两种提取液相比,黑菊芋的总糖含量极显著高于鲜菊芋(P<0.01)。鲜菊芋和黑菊芋提取液中菊糖含量分别为17.5926和19.4156 g/100 g。鲜菊芋提取液中果糖、葡萄糖和蔗糖含量分别为1.4166、0.3439和1.7668 g/100 g,黑菊芋提取液中果糖、葡萄糖和蔗糖含量分别为10.7332、1.2179和6.2206 g/100 g,两者相比,黑菊芋提取液中菊糖、果糖、葡萄糖和蔗糖的含量均显著高于鲜菊芋(P<0.01),原因是菊芋加工过程中部分菊糖经热降解生成单糖、二糖,最后干燥过程又失去大量水分[10]。果糖、葡萄糖和蔗糖的增加赋予黑菊芋香甜的口感,适口性更好。菊糖是已知的益生元,以此两种提取液饲喂便秘小鼠,对改善其便秘症状可能会有所助益。
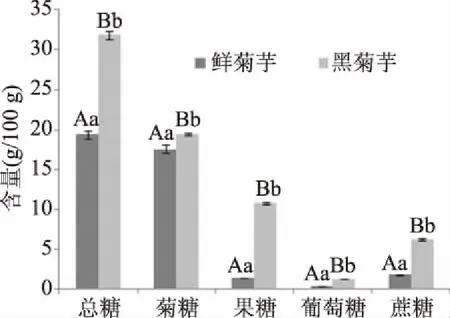
图1 水提液主要糖分含量
2.2 黑菊芋水提液对小鼠体重变化的影响
由图2 可知,与CK相比,MC、AC和RL处理组小鼠的体重变化值略有上升,BL、BM和BH组略有下降,但是鲜菊芋和黑菊芋各处理组与CK、MC和AC组之间均无显著性差异(P>0.05),表明摄入鲜菊芋和黑菊芋提取液对小鼠体重变化无不良影响。黑菊芋提取液中果糖、葡萄糖和蔗糖含量虽然较鲜菊芋显著增加,适口性增强,但每天给予2.5~10.0 g/kg bw的黑菊芋,不会引起小鼠体重的显著增长。
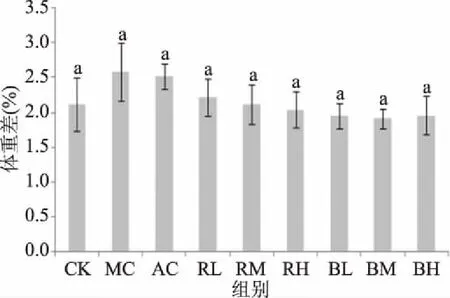
图2 不同处理组小鼠实验前后体重变化
2.3 黑菊芋水提液对小鼠肠推进功能的影响
由图3可知,MC组小鼠的墨汁推进率显著低于空白对照组小鼠(P<0.05),即小鼠肠蠕动抑制模型成立。鲜菊芋和黑菊芋各组小鼠的墨汁推进率均显著高于MC组(P<0.05),RL、RM和RH组分别高出57.96%、69.73%、82.25%,BL、BM和BH组分别高出60.57%、70.59%、101.02%,而且RM、RH、BM和BH组小鼠小肠墨汁推进率与AC组差异不显著(P>0.05)。
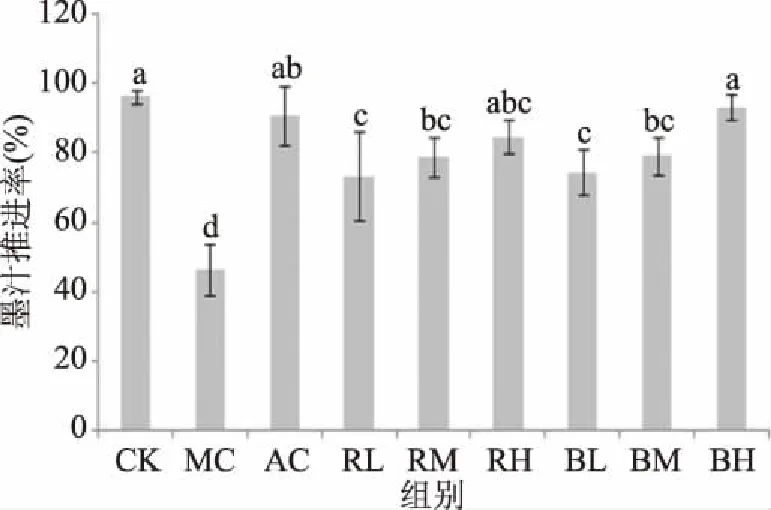
图3 黑菊芋水提液对小肠墨汁推进率的影响
2.4 黑菊芋水提液对小鼠排便功能的影响
由图4可见,与CK组小鼠相比,MC组小鼠首粒黑便时间显著推迟(P<0.05),排便粒数及排便质量显著降低(P<0.05),表明便秘模型建立成功。与AC组相比,RM、RH、BM和BH剂量组小鼠的首粒黑便时间、排便粒数和排便质量结果差异不显著(P>0.05);与MC组相比,除BM的首粒黑便时间无显著差异外(P>0.05),其他结果均具有显著差异(P<0.05)。BM组小鼠的首粒黑便时间提前了24.57%,排便粒数和质量分别增加了67.64%和87.31%;BH组小鼠的首粒黑便时间提前了35.56%,排便粒数和质量分别增加了85.29%和67.26%。与RM组相比,BM组小鼠的首粒黑便时间延迟、排便粒数和粪便质量略有增加,但差异不显著(P>0.05);与RH组相比,BH组亦呈现首粒黑便时间延迟、排便粒数和粪便质量增加的趋势,但差异不显著(P>0.05)。
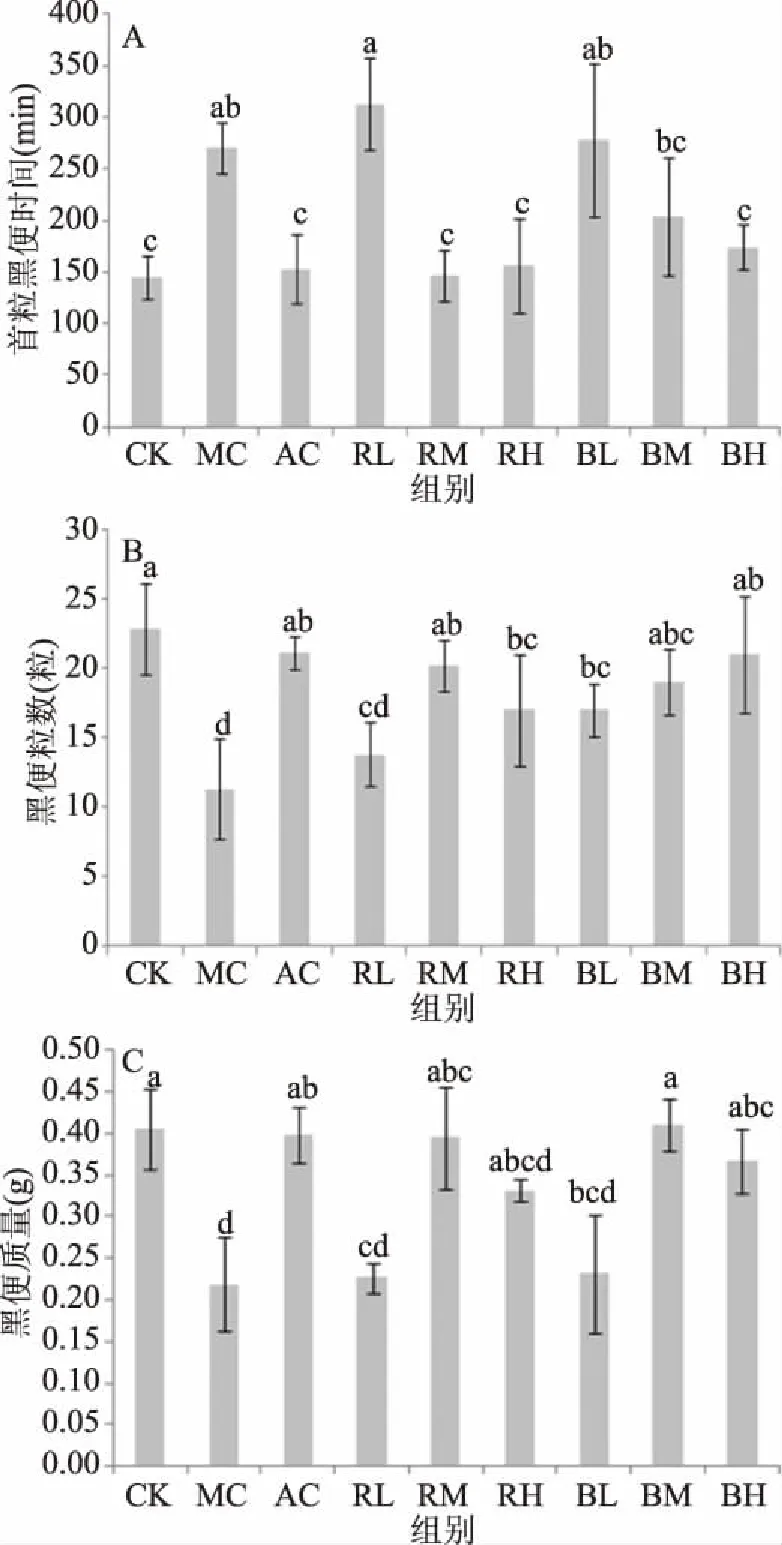
图4 不同处理组小鼠排便功能比较
2.5 黑菊芋水提液对小鼠粪便中短链脂肪酸含量的影响
短链脂肪酸(SCFAs)是人和其它哺乳动物重要的体内代谢能源,不能进行内源性合成。主要包括乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸等,乙酸、丙酸和丁酸约占SCFAs总量的90%~95%,源于肠道菌群对非消化性碳水化合物的发酵作用,异丁酸与异戊酸通常源于致腐微生物对蛋白质的发酵作用。乙酸主要参与大脑、心脏、肾脏和体内肌肉的代谢;丙酸可以抑制肝胆固醇的合成,降低血清中胆固醇水平[21-24];丁酸具有保护肠黏膜、抗炎、增强胃肠机能,抑制肿瘤细胞增殖、诱导分化和凋亡的作用[25-27]。
由表1可见,MC组与CK组相比,SCFAs总量显著降低(P<0.01),但与AC组无显著差异(P>0.05)。Mazzawi等[28]发现便秘型肠易激综合症(IBS)患者的粪便中SCFAs降低,史益凡研究表明,顽固性便秘患者粪便中SCFAs的含量显著减少,便秘程度越重,SCFAs的含量就越低,同时以各种泻药干预便秘小鼠,对其粪便中的SCFAs含量无显著影响[29]。本研究中,MC小鼠粪便的SCFAs总量显著降低,给予酚酞片的AC组的SCFAs总量与MC相比,没有得到改善,在这一点上与文献结果是一致的。
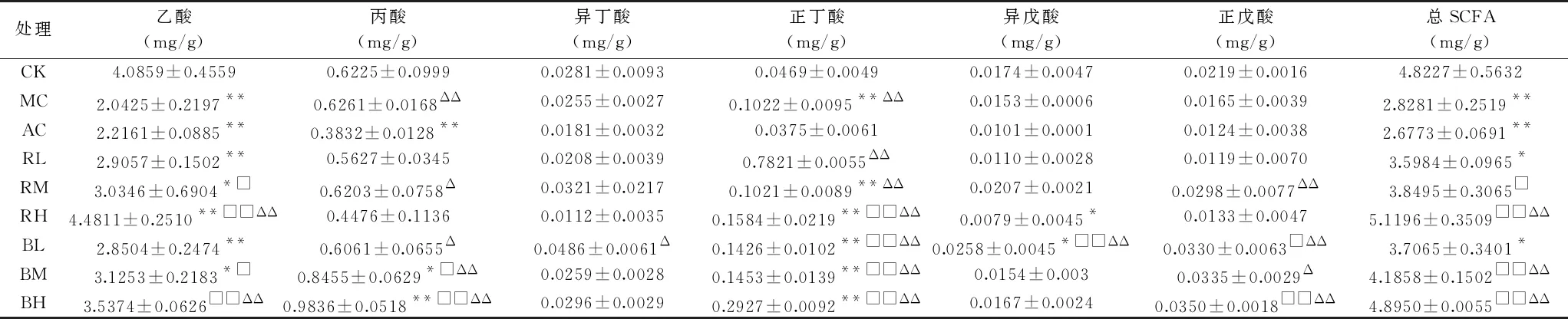
表1 小鼠粪便短链脂肪酸含量
黑菊芋中、高剂量组的SCFAs总量显著高于MC组和AC组(P<0.01),但中剂量组低于CK组,含量顺序为RH>BH>CK>BM>RM>BL>RL>MC>AC,各组中SCFAs的平均含量分别为5.1196、4.895、4.8227、4.1858、3.8495、3.7065、3.5984、2.8281、2.6773 mg/g。不同菊芋处理组的SCFAs构成存在一定差异,与MC组相比,乙酸含量方面,鲜菊芋和黑菊芋的低剂量组差异均不显著(P>0.05),中、高剂量组显著升高(P<0.05或P<0.01),以RH组最高,BH和BM组次之;丙酸含量方面,只有黑菊芋中、高剂量组与MC组有显著差异(P<0.05或P<0.01);与MC组相比,正丁酸含量方面,黑菊芋各组与鲜菊芋高剂量组显著升高(P<0.01);正戊酸含量方面,BL、BH组显著高于MC组(P<0.05或P<0.01);异戊酸含量方面,只有BL组显著高于MC组(P<0.01);各组的异丁酸含量与MC组无显著差异(P>0.05)。总体看来,给便秘小鼠灌胃适量鲜菊芋和黑菊芋水提液,可以有效促进小鼠肠道代谢产生乙酸、丙酸和正丁酸,效果明显好于灌胃酚酞片悬浊液,原因是酚酞片治疗便秘的机理是在碱性肠液作用下分解形成可溶性钠盐,通过刺激肠壁神经,增强肠蠕动来缓解便秘,并不能调整菌群生长[30],因而不会增加肠道内SCFAs含量[29]。灌胃黑菊芋提取液的效果略好于鲜菊芋。这可能与黑菊芋提取液中菊糖含量略高于鲜菊芋,可以有效促进益生菌在盲肠中的增殖有关。
3 结论
黑菊芋提取液中多糖组成以菊糖、果糖、葡萄糖和蔗糖为主,含量分别为19.4156、10.7332、1.2179和6.2206 g/100 g。灌胃5.0和10.0 g/kg bw黑菊芋水提液,可以有效促进便秘小鼠的肠道蠕动,增强排便功能,促进便秘小鼠肠道代谢产生乙酸、丙酸和丁酸,提高肠道中短链脂肪酸的总量,改善肠道环境,缓解便秘,其效果与20.0 mg/kg bw酚酞片的效果相当,与相对应剂量的鲜菊芋之间无显著差异。根据保健食品检验与评价技术规范中排便功能评价方法中的判定标准,可认为黑菊芋水提液具有润肠通便的功能。本研究为黑菊芋的保健功效提供了依据,但动物实验结果与人体实验还存在着一定的差别,黑菊芋在人体内能否发挥同样的功效,对肠道菌群是否具有良好的调节作用,还需要进一步的实验验证。
