婴儿源双歧杆菌对人胎结肠上皮细胞的增殖作用及机制研究
2020-10-23李欣芮范小飘高文文尚佳萃孟祥晨
赵 桉,李欣芮,范小飘,高文文,尚佳萃,万 峰,孟祥晨
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
双歧杆菌是生命早期最为重要的肠道优势菌群之一[1],具有促进肠道发育[2]、调节免疫系统[3]、维持组织稳态[4]、促进新陈代谢等生理学功能[5]。由于婴儿肠道发育完善程度影响了婴儿食物消化、营养吸收、免疫系统增强等生理学功能[2],因此双歧杆菌促进新生儿肠道发育成为近年来的研究热点。
Che等[6]用人体内的双歧杆菌处理无菌猪,建立了HFA(Human flora-associated)猪模型,在菌株定植肠道后,空肠上皮绒毛长度增长、隐窝加深,影响肠道发育,但对其中起作用的菌体成分及作用机制很大程度上未知。目前已发现双歧杆菌的短链脂肪酸(SCFAs)[7]、乳酸[8]以及短双歧杆菌的菌毛[9]可促进新生儿肠道发育。其他菌体成分如脂磷壁酸(LTA)[10]、胞外多糖(EPS)[11]、蛋白质[12]等物质在完善婴儿其他的肠道功能中起到了积极作用。其中的蛋白质主要包括分布于菌体上的表面蛋白和菌体外的分泌蛋白,是双歧杆菌与宿主相互作用和分子间交流的潜在介质,直接参与感知环境因素、促进细菌定植、介导与肠粘膜相关免疫细胞的产生[13]。但是表面蛋白和分泌蛋白是否参与了肠上皮细胞的增殖,尚无研究报道。因此,本实验室筛选出一株对肠上皮细胞增殖促进作用较好的菌株,探究其中的蛋白成分对细胞增殖的影响。
研究发现Wnt/β-catenin信号通路的关键基因与哺乳动物肠上皮细胞增殖密切相关[14-15]。β-catenin、Cyclin D1、c-Myc 是细胞增殖正调控基因;Axin2、GSK-3β是细胞增殖的负调控基因[16]。因此选取Wnt/β-catenin 信号通路正负调控基因,检测其表达变化情况,可在mRNA水平上检测双歧杆菌分泌蛋白和表面蛋白对肠上皮细胞增殖的影响[17]。
与以往研究新生儿肠道发育问题时,常选用动物肠细胞系或人肠癌细胞系不同,本试验直接选用妊娠23周人胎结肠上皮CCD841 CoN细胞作为受试细胞,从12株双歧杆菌(3~6月龄健康婴儿粪便分离鉴定[18])中筛选出1株对CCD841 CoN细胞增殖促进作用最好的菌株,分析该菌株的表面蛋白和分泌蛋白的作用,初步探讨双歧杆菌对肠上皮细胞增殖影响的理论机制,为新生儿肠道发育以及肠道健康研究奠定基础。
1 材料与方法
1.1 材料与仪器
12株双歧杆菌(2株动物双歧杆菌乳酸亚种:H6-7、H15-7;2株短双歧杆菌:H9-3、H4-2;2株双歧杆菌:H3-R2、H4-3;2株长双歧杆菌婴儿亚种:H10-1、H11-7;4株长双歧杆菌长亚种:H4-1、H11-2、H16-3、H21-7) 分离于东北地区一月龄健康婴儿(男婴11人、女婴10人)粪便,保藏于实验室;人胎结肠上皮CCD841 CoN细胞 北纳生物;改良MRS(mMRS)培养基 MRS培养基中添加0.05% L-半胱氨酸盐酸盐;高糖培养基DMEM 美国HyClone;胰蛋白酶 美国Sigma公司;胎牛血清 加拿大Wisent公司;0.25% Trypsin-EDTA 美国Gibco公司;与细胞培养相关的产品 美国Corning公司;CCK-8细胞增殖-毒性检测试剂盒 美国AbMole公司;细胞周期染色试剂盒 联科生物技术股份有限公司;细菌总 RNA 提取试剂盒、逆转录试剂盒、RT-PCR反应试剂盒(SYBR Green) 天根公司;引物 吉林省库美生物科技有限公司;其他试剂 国产生化分析纯产品。
厌氧培养箱 美国赛默飞公司;HF90型二氧化碳培养箱 力康发展有限公司;BA300型倒置显微镜 麦克奥迪实业集团有限公司;Model 680型酶标仪 美国Bio-Rad公司;Cytomics FC 500流式细胞仪 美国Beckman Coulter公司;Step One Plus实时荧光定量PCR仪 美国Applied Biosystem公司;核酸蛋白测定仪 美国Molecular Devices公司。
1.2 实验方法
1.2.1 细胞培养 CCD841 CoN细胞培养于添加10%胎牛血清的DMEM混合培养基中,置于37 ℃、5%CO2条件下培养,胰酶消化传代。
1.2.2 双歧杆菌活化及培养 12株供试菌株在试验前需进行复苏活化,3%接种于mMRS 液体培养基中,37 ℃厌氧培养16 h,连续传2~3代以恢复菌种活力。平板菌落计数出活菌数量后,调整菌体浓度为3×107CFU/mL以备用。
1.2.3 双歧杆菌的筛选
1.2.3.1 双歧杆菌发酵上清液和破碎物的制备 发酵上清液的制备:取厌氧培养16 h后的菌液10 mL,8000 r/min 4 ℃离心5 min,收集上清液,调节pH7.2,过0.22 μm滤器除菌,-20 ℃保存[19]。
破碎物的制备:取厌氧培养16 h后的菌液10 mL,8000 r/min 4 ℃离心5 min收集菌体。用细胞培养洗涤2遍并将菌体悬于10 mL细胞培养基中。用超声波细胞粉碎仪在500 W条件下,每处理10 s、间隔10 s,超声15 min。在显微镜下观察没有完整菌体后,过0.22 μm滤器除菌,-20 ℃保存[20]。
1.2.3.2 细胞增殖实验分组 发酵上清组:加入含10%(V/V)发酵上清的细胞培养基;阴性对照组:加入含10%(V/V) mMRS液体培养基的细胞培养基;阳性对照组:加入含100 μg/mL小牛血清蛋白(BSA)[21]的细胞培养基;空白组:空孔加入细胞培养基。
破碎物组:加入含10%(V/V)破碎物的细胞培养基;阴性对照组:加入细胞培养基;阳性对照组:加入含100 μg/mL BSA的细胞培养基;空白组:空孔加入细胞培养基。
1.2.3.3 细胞增殖活性分析 细胞增殖活性检测采用CCK-8法[22]。调整CCD841 CoN细胞密度为3×104cell/mL,接种于96孔板,每孔100 μL,培养24 h贴壁待用。弃上清,分别加入12株双歧杆菌的发酵上清组和破碎物组,及其阴性对照组、阳性对照和空白组,每孔体积100 μL,设4个复孔,与细胞共作24 h。作用结束后,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h后振荡混匀,在酶标仪上检测各孔光密度(OD)值,检测波长设置为450 nm。按下列公式计算细胞增殖活性。
细胞增殖活性(%)=(实验组OD值-空白组OD值)/(阴性组OD值-空白组OD值)×100
1.2.4 菌株H3-R2表面蛋白和分泌蛋白对CCD841 CoN细胞的增殖影响
1.2.4.1 双歧杆菌H3-R2表面蛋白和分泌蛋白的制备 表面蛋白的制备:参照文献[23]的方法并略做修改。取1 L于37 ℃厌氧培养16 h的双歧杆菌H3-R2培养物,9000 r/min 4 ℃离心15 min收集沉淀,用PBS(pH7.2)洗涤2次。
在菌体中加入50 mL 5 mol/L LiCl溶液,在37 ℃于摇床(200 r/min)中处理30 min。9000 r/min 4 ℃离心15 min收集上清,过0.22 μm滤膜,收集滤液装入8000 Da截留分子量的透析袋,在去离子水中透析48 h(4 ℃)后真空冷冻干燥,-20 ℃保存。
分泌蛋白的制备:参照文献[24]的方法并略做修改。取1 L于37 ℃厌氧培养16 h的双歧杆菌H3-R2培养物,9000 r/min 4 ℃ 离心15 min收集上清液,过0.22 μm滤膜除去菌体。向上清中加入三氯乙酸溶液,调整终浓度为10%,4 ℃静止2 h,9000 r/min离心20 min,收集沉淀,用冷丙酮洗涤2次,真空冷冻干燥,-20 ℃保存。
1.2.4.2 表面蛋白和分泌蛋白的SDS-PAGE电泳 SDS-PAGE:分别取1 mg表面蛋白和分泌蛋白粉末溶解于100 μL 1% SDS溶液中,加入等量的2×SDS-PAGE缓冲液,沸水浴10 min,取10 μL上样,进行SDS-PAGE电泳。SDS-PAGE凝胶:12%分离胶、5%浓缩胶。电泳电压:分离胶120 V,浓缩胶80 V。用考马斯亮蓝R250对凝胶染色4 h后出现明显条带,甲醇/醋酸脱色液脱色6 h后背景变浅、条带清晰。凝胶成像系统拍照分析电泳结果。
1.2.4.3 细胞增殖实验分组 表面蛋白组和分泌蛋白组:加入含表面/分泌蛋白浓度为100、50、25、10、5、1 μg/mL的细胞培养基;阳性对照组:加入含100 μg/mL BSA的细胞培养基;阴性对照组:加入细胞培养基;空白组:空孔加入细胞培养基。
1.2.4.4 细胞增殖活性分析 调整CCD841 CoN细胞密度为3×104cell/mL,接种于96孔板,每孔100 μL,培养24 h贴壁待用。弃上清,加入表面蛋白组和分泌蛋白组,及其阴性对照组、阳性对照和空白组,每孔体积100 μL,设4个复孔,与细胞共作12、24、48 h。作用结束后,测量细胞增殖活性同1.2.3.3。
1.2.4.5 细胞周期、荧光定量PCR实验分组 表面蛋白组:加入含表面蛋白浓度为50 μg/mL的细胞培养基;分泌蛋白组:加入含分泌蛋白浓度为10 μg/mL的细胞培养基;对照组:加入细胞培养基。
1.2.4.6 细胞周期检测 调整CCD841 CoN细胞密度为2×105cell/mL,接种于6 cm培养皿,每孔4 mL,培养24 h后贴壁待用。弃上清,分别加入表面蛋白组、分泌蛋白组以及对照组与细胞共作24 h。用胰蛋白酶消化细胞,1000 r/min离心5 min 收集细胞,弃去上清。用PBS洗涤1次,1000 r/min离心5 min,弃去上清。加入1 mL碘化丙啶染色工作液和10 μL破膜剂,振荡混匀后室温避光孵育30 min,避免振动,上流式细胞仪检测[25]。
1.2.4.7 荧光定量PCR检测基因表达水平 收集1.2.4.6中表面蛋白组、分泌蛋白组以及对照组与CCD841 CoN细胞共作24 h后的细胞,用试剂盒提取细胞总RNA,核酸蛋白测定仪测定RNA浓度及纯度,符合A260/A280=1.8~2.1后用于逆转录反应。
用逆转录试剂盒合成cDNA,反应体系20 μL,反应条件:37 ℃ 15 min,85 ℃ 5 s。
用RT-PCR试剂盒进行荧光定量PCR,反应体系25 μL,反应条件:95 ℃预变性30 min,95 ℃变性5 s,60 ℃退火30 s,95 ℃延伸15 s,共40个循环,60~95 ℃记录熔解曲线,引物序列设计见表1。在荧光定量PCR仪器上进行反应,并记录样本循环阈值(Ct值)。以2-ΔΔCt相对定量法计算基因表达量的变化。

表1 荧光定量PCR引物序列
1.3 数据处理
采用Excel 2010软件处理试验数据,结果以Means±SD表示。采用Origin 8.0软件绘图及拟合处理。运用SPSS 23.0软件,单因素方差分析以及Duncan多重比较分析,P<0.05有统计学意义。
2 结果与分析
2.1 双歧杆菌对CCD841 CoN细胞的增殖促进作用
2.1.1 双歧杆菌发酵上清的作用 细胞增殖活性百分比可以表示细胞增殖作用的强弱,其值大于100% 时表示有增殖促进作用。12株菌中有7株菌(H4-1、H21-7、H6-7、H3-R2、H4-3、H10-1、H11-7)的发酵上清对CCD841 CoN细胞有增殖促进作用(图1)。与阴性对照组相比,添加菌株H4-1、H21-7、H6-7、H3-R2、H4-3、H10-1、H11-7的发酵上清液与细胞共作24 h的细胞增殖活性分别为:134%、102%、123%、137%、111%、114%、102%。并且添加菌株H4-1、H3-R2的发酵上清液与细胞共作24 h的增殖促进效果均显著高于阳性对照组(P<0.05)。
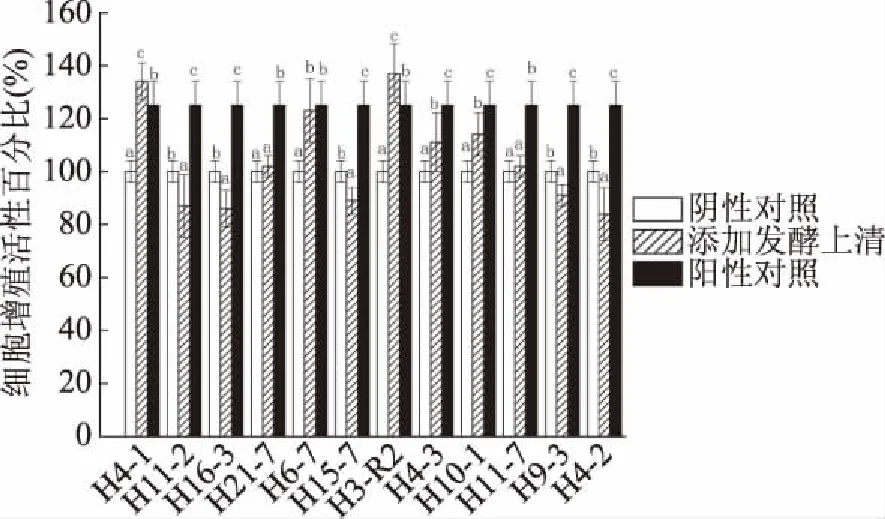
图1 12株双歧杆菌的发酵上清液对CCD841 CoN细胞的增殖促进作用
2.1.2 双歧杆菌破碎物的增殖作用 12株菌中有7株菌(H21-7、H6-7、H15-7、H3-R2、H4-3、H9-3、H4-2)的细胞破碎物对CCD841 CoN细胞有增殖促进作用(图2)。与阴性对照组相比,添加菌株H21-7、H6-7、H15-7、H3-R2、H9-3、H4-2的破碎物与细胞共作24 h的细胞增殖活性分别为:124%、120%、140%、153%、110%、122%、157%。并且添加菌株H15-7、H3-R2、H4-2的破碎物与细胞共作24 h的增殖促进效果均显著高于阳性对照组(P<0.05)。
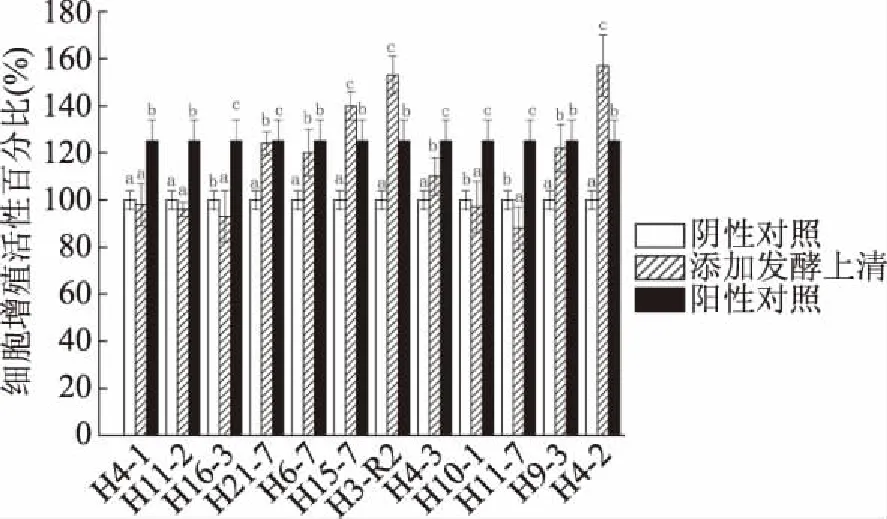
图2 12株双歧杆菌的破碎物对CCD841 CoN细胞的增殖促进作用
在12株双歧杆菌中,只有菌株H3-R2的发酵上清液(图1)和细胞破碎物(图2)均对CCD841 CoN细胞有增殖促进作用且显著高于阳性对照组(P<0.05),具有潜在研究价值。
菌株H3-R2的发酵上清中存在着蛋白质[26]、多糖[27]等物质,破碎物中存在着蛋白质[28]、多糖[29]、脂磷壁酸[10]等物质。由于这些物质的存在,可能介导了CCD841 CoN细胞的增殖。已有研究发现鼠李糖乳杆菌GG蛋白产物能够促进新生小鼠肠道的功能性成熟,包括肠道上皮细胞增殖、分化及紧密连接蛋白形成等[30]。为了了解双歧杆菌H3-R2的表面蛋白和分泌蛋白是否对肠上皮细胞增殖有促进作用,本文提取了这两种蛋白进行后续研究。
2.2 双歧杆菌H3-R2表面蛋白和分泌蛋白的鉴定
表面蛋白经SDS-PAGE分析后(图3),分子量在大约43 kDa的蛋白质得到极大的富集,是提取物中的主要蛋白质种类。已知表面蛋白分子量范围25~71 kDa[31],并且与嗜酸乳杆菌表面蛋白相对分子质量多在41~49 kDa之间相接近[32]。说明本试验采取的LiCl提取法可提取到双歧杆菌H3-R2的表面蛋白。
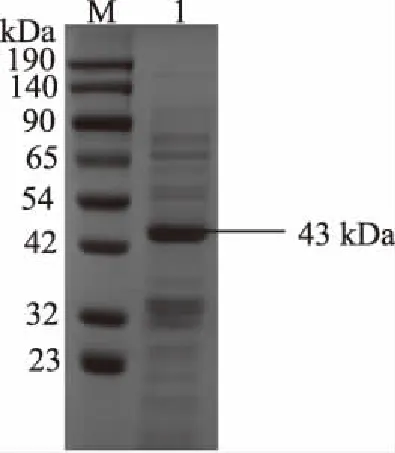
图3 表层蛋白电泳图
分泌蛋白经SDS-PAGE分析后(图4),分子量在大约34 kDa和45 kDa。这与Bifidobacterium longum FNCC2705分泌蛋白相对分子质量在20~60 kDa分布均匀相接近[33]。说明本试验采取的三氯乙酸沉淀法可提取到双歧杆菌H3-R2的分泌蛋白。
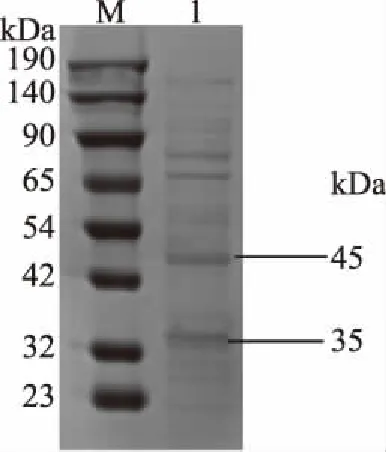
图4 分泌蛋白电泳图
2.3 双歧杆菌H3-R2对CCD841 CoN细胞的增殖促进作用
2.3.1 表面蛋白的作用 菌株H3-R2表面蛋白对CCD841 CoN细胞的增殖促进作用受蛋白添加浓度和培养时间影响(图5)。添加表面蛋白与CCD841 CoN细胞共作12 h时,与阴性对照组比细胞活性最大增加至114%;蛋白浓度为50 μg/mL组对细胞有最大增殖促进作用,且显著高于阳性对照组(12 h)(P<0.05)。添加表面蛋白与CCD841 CoN细胞共作24 h时,与阴性对照组比细胞活性增加113%~145%;蛋白浓度为50 μg/mL组对细胞有最大增殖促进作用,且显著高于阳性对照组(24 h)(P<0.05)。添加表面蛋白与CCD841 CoN细胞共作48 h时,与阴性对照组比细胞活性增加110%~136%;蛋白浓度为25 μg/mL组对细胞有最大增殖促进作用,且显著高于阳性对照组(48 h)(P<0.05)。
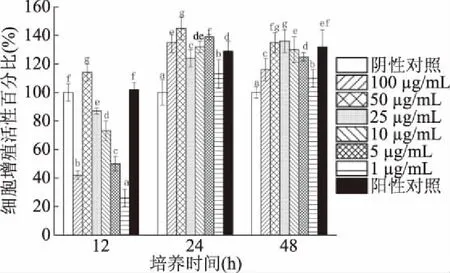
图5 菌株H3-R2的表面蛋白对CCD841 CoN细胞的增殖促进作用
添加表面蛋白浓度50 μg/mL与细胞共作24 h的细胞增殖促进作用,高于蛋白浓度50 μg/mL与细胞共作12 h和蛋白浓度25 μg/mL与细胞共作48 h(P<0.05),是表面蛋白对细胞增殖促进作用的最佳条件。
2.3.2 分泌蛋白的作用 菌株H3-R2分泌蛋白对CCD841 CoN细胞的增殖促进作用受蛋白添加浓度和培养时间影响(图6)。添加分泌蛋白与CCD841 CoN细胞共作12 h时,与阴性对照组比细胞活性增加102%~110%;蛋白浓度为10 μg/mL组对细胞有最大增殖促进作用,且显著高于阳性对照组(12 h)(P<0.05)。添加分泌蛋白与CCD841 CoN细胞共作24 h时,与阴性对照组比细胞活性增加111%~128%;蛋白浓度为10 μg/mL组对细胞有最大增殖促进作用,且与阳性对照组(24 h)无显著性差异(P<0.05)。添加表面蛋白与CCD841 CoN细胞共作48 h时,与阴性对照组比细胞活性增加104%~121%;蛋白浓度为5 μg/mL组对细胞有最大增殖促进作用,且与阳性对照组(48 h)无显著性差异(P>0.05)。
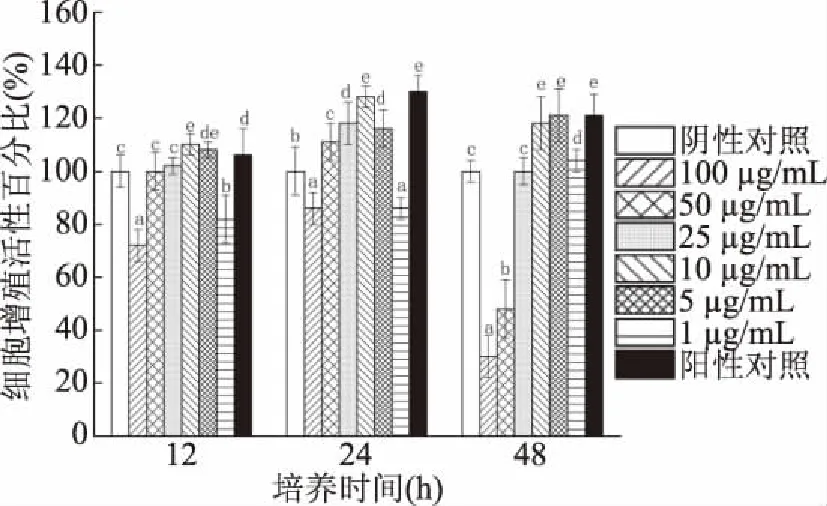
图6 菌株H3-R2的分泌蛋白对CCD841 CoN细胞的增殖促进作用
添加分泌蛋白浓度10 μg/mL与细胞共作24 h的细胞增殖促进作用,高于蛋白浓度10 μg/mL与细胞共作12 h和蛋白浓度5 μg/mL与细胞共作48 h,是分泌蛋白对细胞增殖促进作用的最佳条件。
综上所述,选取添加菌株H3-R2表面蛋白50 μg/mL为表面蛋白组,分泌蛋白浓度10 μg/mL为分泌蛋白组,与CCD841 CoN细胞共作24 h后,进行细胞周期检测以及增殖相关基因表达检测。
2.4 双歧杆菌H3-R2表面蛋白和分泌蛋白对CCD841 CoN细胞周期的影响
细胞的周期循环速度决定了细胞的增殖速度[34]。因此可以猜测,细胞添加表面蛋白或分泌蛋白后,细胞周期循环加速进而实现细胞增殖。为证实这一观点,本文采用流式细胞术检测表面蛋白和分泌蛋白对CCD841 CoN细胞周期循环的影响。
流式细胞术分析所示,第一个红色峰为G0/G1期,第二个红色峰代表G2/M期,两峰之间的斜线填充部分为S期(图7)。对照组、表面蛋白组和分泌蛋白组与CCD841 CoN细胞共作24 h后,各个细胞周期发生变化(图8)。对照组的周期分布是G0/G1期为56.29%,S期为23.37%,G2/M期为20.34%;表面蛋白组的周期分布是G0/G1期为48.24%,S期为30.38%,G2/M期为21.38%;分泌蛋白组的周期分布是G0/G1期为53.10%,S期为25.56%,G2/M期为21.34%。与对照组相比,表面蛋白组的G0/G1期细胞比例下降了14.30%,S期细胞比例上升了30.00%;与对照组相比,分泌蛋白组的G0/G1期细胞比例下降了5.67%,S期细胞比例上升了9.37%。上述结果表明,菌株H3-R2的表面蛋白和分泌蛋白
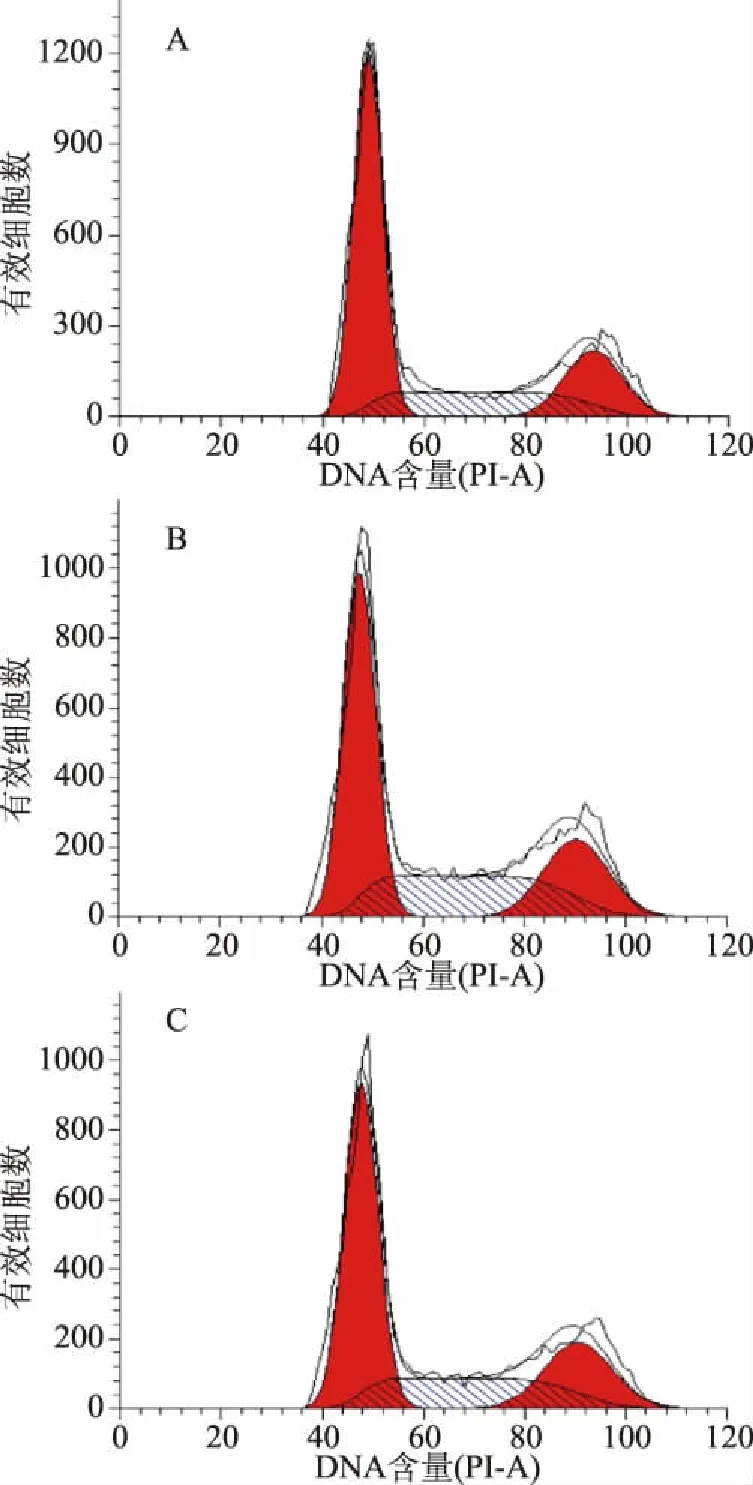
图7 表面蛋白和分泌蛋白对CCD841 CoN细胞周期分布的影响
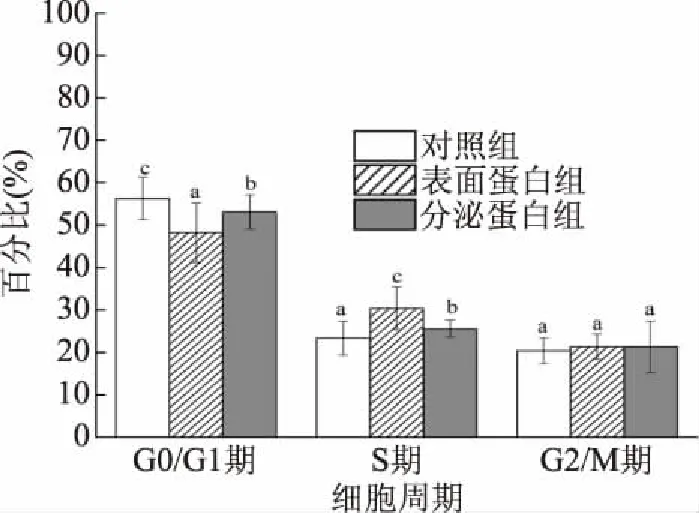
图8 表面蛋白和分泌蛋白细胞对各个细胞周期所占的百分比的影响
2.5 双歧杆菌H3-R2表面蛋白和分泌蛋白对增殖相关基因表达的影响
Lee等[8]的研究表明,给小鼠喂食双歧杆菌和乳杆菌等乳酸产生菌,可显著促进肠上皮的肠道干细胞、潘氏细胞和杯状细胞的增殖。乳酸作用于潘氏细胞和肠基质细胞上的G蛋白偶联受体Gpr81,影响β-catenin、c-Myc、Cyclin D1、Axin2和GSK-3β等相关基因的表达,刺激肠道细胞的增殖。
增殖相关基因进行荧光定量PCR检测结果见表2,与对照组相比,表面蛋白组和分泌蛋白组与CCD841 CoN细胞共作用24 h后,胞内β-catenin、c-Myc和Cyclin D1基因的表达量均显著上调(P<0.05),Axin2、GSK-3β基因的表达量显著下调(P<0.05)。该结果表明,在表面蛋白或分泌蛋白的作用下,抑制了降解β-catenin复合物(Axin1/2、GSK-3β等蛋白形成)的激活,β-catenin 可在细胞内蓄积并向细胞核转移,起始转录c-Myc、CyclinD1等靶基因,促进细胞增殖和迁移。其中CyclinD1与细胞周期直接相关[35],高表达时表明加快细胞从G0/G1期进入S期,从而促进细胞增殖,这与上述细胞周期检测结果相一致。因此可以从转录组水平验证了细胞增殖结果。

表2 表面蛋白和分泌蛋白的添加对相关基因表达的影响
3 结论
本试验从12株婴儿源双歧杆菌中筛选出双歧杆菌H3-R2,其发酵上清液和破碎物均对CCD841 CoN细胞有较好的增殖促进作用,表明该菌株具有促进新生儿肠道发育功能的潜在研究价值。菌株H3-R2的表面蛋白和分泌蛋白成分对细胞增殖有一定的积极作用,可加速细胞周期循环,并在转录组水平上调节增殖相关基因变化。本文初步探讨了双歧杆菌H3-R2对人胎结肠上皮细胞增殖促进作用及机制,但对蛋白成分的作用程度和具体的蛋白组分仍不清楚,有待进一步研究。
