功能化纳米金修饰电极检测食品中H2O2的残留量
2020-10-23陈林林范天娇吴嘉树辛嘉英
陈林林,范天娇,李 伟,吴嘉树,韩 可,辛嘉英,2
(1.哈尔滨商业大学省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州 730000)
过氧化氢俗称双氧水,化学式H2O2[1],由于其强氧化性可用于伤口、环境中的消毒,过氧化氢也广泛地应用于食品中,如食品漂白、食品防腐以及食品加工过程中包装消毒和乳制品生产过程中的消毒[2-4]。但过多的过氧化氢不仅会引起微生物突变,还会引起癌症,导致胃肠道损伤等。因此食品中的过氧化氢含量必须受到严格的控制,生命科学和食品工业领域都将过氧化氢的检测视为重点研究课题[5-6]。
到目前为止,许多学者对过氧化氢的检测方法进行了研究,包括荧光光谱、碘量法、容量分析、分光光度法、高效液相色谱法、电化学传感器等,并对这些检测方法进行了优化[7-12]。Tang等[13]制备荧光碳点,利用比色法检测过氧化氢,检出限为1.75 μmol/L。Lu等[14]利用二氧化锰纳米结构修饰在多壁碳纳米管表面建立过氧化氢传感器检测限为6.97 μmol/L,且稳定性高、选择性好、检测H2O2的货架期长。Niu等[15]通过建立过氧化氢传感器实现了在0.5~5 μm范围内高选择性地检测外源性H2O2,并可在30 s内快速检测大肠杆菌中的H2O2。池泉[16]利用罗丹明实现了荧光的方法对过氧化氢的检测,检出限较低,应用于雨水中过氧化氢的检测。Wang等[17]利用分光光度法实现了实际水样中的低浓度H2O2的准确测定。但这些方法都存在着灵敏度不高,操作复杂以及对仪器要求较高等不足。
由于纳米金具有良好的导电性,它可以加速电极表面的电子转移速度,因此纳米金固定在电极表面可以使电极表面的电子与被检测物质的传递速度加快[18]。纳米金粒子还能够催化很多物质的氧化还原反应并且在电化学中表现出催化活性。因此,纳米金在电化学领域的应用前景十分广阔。窦博鑫等[19]利用层层自组装的方法将功能化纳米金修饰在电极上,配位Cu2+后制作了一种新型过氧化氢传感器,表现出较强的还原过氧化氢催化活性。Manickam等[20]利用纳米金、壳聚糖和环糊精制备了水凝胶纳米复合材料,从而制备了一种灵敏度较高的过氧化氢生物传感器。
本实验利用电沉积的方法,将甲烷氧化菌素、半胱氨酸、色氨酸等功能化物质对柠檬酸钠还原法制备的纳米金进行功能化,通过循环伏安(CV)和交流阻抗(EIS)两种方式考察功能化物质、纳米金粒径、半胱氨酸浓度、扫描速度、缓冲溶液浓度对过氧化氢在修饰电极上的电化学行为,筛选出最佳电极修饰和检测过氧化氢的条件,并利用此电极建立检测过氧化氢的线性关系,绘制标准曲线,评价该修饰电极对过氧化氢的检测性能。
1 材料与方法
1.1 材料与仪器
β-巯基乙胺、β-环糊精、氯金酸 源叶生物有限公司;柠檬酸钠 天津市光复精细化工研究所;L-半胱氨酸 上海伯奥生物科技有限公司;色氨酸 北京芳草医药化工发展有限公司;自来水 哈尔滨市当地自来水;商用饮用水 超市购买农夫山泉矿泉水;牛奶 超市购买蒙牛纯牛奶。
CHI660A型电化学工作站 上海辰华仪器公司;BSA224S电子天平 赛多利斯科学仪器(北京)有限公司。
1.2 实验方法
1.2.1 纳米金(AuNPs)的制备 利用柠檬酸钠还原法[21]制得五种不同粒径AuNPs溶液,分别为10、13、15、17、20 nm。
1.2.2 修饰电极的制备 根据文献[22]进行裸电极的制备,配制色氨酸(Try)溶液、L-半胱氨酸溶、L-半胱氨酸(L-Cys)溶液和5 mmol/L的巯基乙胺溶液、0.01 mol/的L-半胱氨酸溶液和3 mmol/L的环糊精(CD)溶液,以及实验室进行培养和纯化的甲烷氧化菌素(Methanobactin,Mb)[23]。将抛光好的五根裸电极分别置于配制好的溶液中,利用电沉积的方法扫描电位为-0.6~0.4 V,循环伏安(CV)扫描20圈,将上述电极置于纳米金溶液中以上述的相同条件粒径进行循环伏安扫描20圈,在电解液中以电位窗口为-0.3~0.6 V,0.05 V/s扫描速度循环伏安扫描2圈并利用交流阻抗(EIS)进行表征。
1.2.3 过氧化氢在修饰电极上的电化学行为考察
1.2.3.1 修饰电极功能化物质的选择 分别将色氨酸、Mb(0.025 mol/L)、半胱氨酸、半胱氨酸/巯基乙胺功能化纳米金、半胱氨酸/环糊精功能化纳米金等5种修饰电极置于0.1 mol/L的过氧化氢与pH7.8的PBS缓冲液以3∶1体积比的混合液中进行电位窗口为-0.3~0.6 V,扫描速度是0.05 V/s的循环伏安扫描并利用交流阻抗表征。
1.2.3.2 修饰电极纳米金粒径的选择 将10、13、15、17、20 nm粒径的纳米金修饰电极于0.1 mol/L的过氧化氢与pH7.8的PBS缓冲液以3∶1体积比的混合液中进行电位窗口为-0.3~0.6 V,扫描速度是0.05 V/s的循环伏安扫描并利用交流阻抗表征。
1.2.3.3 修饰电极功能化物质浓度的选择 将0.0025、0.004、0.005、0.01、0.02 mol/L的半胱氨酸修饰电极分别于0.1 mol/L的过氧化氢与pH7.8的PBS缓冲液以3∶1体积比的混合液中进行电位窗口为-0.3~0.6 V,扫描速度是0.05 V/s的循环伏安扫描并利用交流阻抗表征。
1.2.3.4 修饰电极电沉积法扫描速度的选择 将扫描速度为90、100、110、120、130 mV/s修饰的电极分别置于0.1 mol/L的过氧化氢与pH7.8的PBS缓冲液以3∶1体积比的混合液中进行电位窗口为-0.3~0.6 V,扫描速度是0.05 V/s的循环伏安扫描并利用交流阻抗表征。
1.2.3.5 修饰电极检测体系缓冲溶液pH的选择 将根据选择的修饰条件修饰的电极于0.1 mol/L的过氧化氢与pH为5.0、6.0、6.7、7.8、8.5的PBS缓冲液以3∶1体积比的混合液中进行电位窗口为-0.3~0.6 V,扫描速度是0.05 V/s的循环伏安和交流阻抗表征。
1.2.4 修饰电极检测过氧化氢方法学的考察
1.2.4.1 修饰电极检测过氧化氢标准曲线的制作 将修饰的电极于1 mL pH6.0的PBS缓冲液中加入3 mL浓度分别为0.1、0.08、0.05、0.03、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00001 mol/L 的过氧化氢溶液,进行电位窗口为-0.3~0.6 V,扫描速度0.05 V/s的循环伏安扫描2圈进行过氧化氢的检测。利用选取的过氧化氢浓度(mol/L)与循环伏安扫描的氧化峰电流(A)绘制检测过氧化氢的标准曲线。
1.2.4.2 检出限与定量限 连续测定不加样的空白数据二十次,以空白值标准偏差的3倍与标准曲线的斜率比值计算出检出限(LOD),以空白值标准偏差的10倍与标准曲线的斜率比值计算出定量限(LOQ)。
1.2.4.3 精密度与稳定性实验 采用同一根功能性纳米金修饰电极检测过氧化氢5次,用平行制备的5根电极对过氧化氢进行检测,确定方法的精密度与稳定性。
1.2.4.4 修饰电极的抗干扰性能检测 考察葡萄糖、甘氨酸、组氨酸、抗坏血酸、精氨酸、钾盐和钠盐对功能性纳米金修饰电极检测过氧化氢的影响情况。采用电流-时间曲线法在-0.3 V的电位下测试。
1.2.4.5 方法的加样回收实验 为考察AuNPs/巯基乙胺/Cys/金电极在实际样品检测中的适用性,采用标准加入法,于3 mL自来水、商用饮用水、牛奶中分别加入200 μ L的 H2O2标准溶液,计算方法的加样回收率。
1.3 数据处理
所有实验均重复3次,不同组的数据使用SPSS 17.0软件采用LSD法进行显著性差异分析,显著性水平P<0.05。
2 结果与分析
2.1 过氧化氢在修饰电极上的电化学行为
2.1.1 功能化物质对修饰电极检测过氧化氢的影响 不同功能化物质修饰电极过氧化氢行为的峰电流如图1所示,其中Cys/巯基乙胺/AuNPs的修饰电极峰电流较高,平均值为3.596×10-6A,与其他各功能化物质修饰电极检测过氧化氢峰电流存在显著性差异(P<0.05),电信号有明显的增强。可知L-半胱氨酸与巯基乙胺可以对电子转移起到良好的促进作用,因此认为Cys/巯基乙胺/AuNPs修饰电极对过氧化氢的检测效果较优。
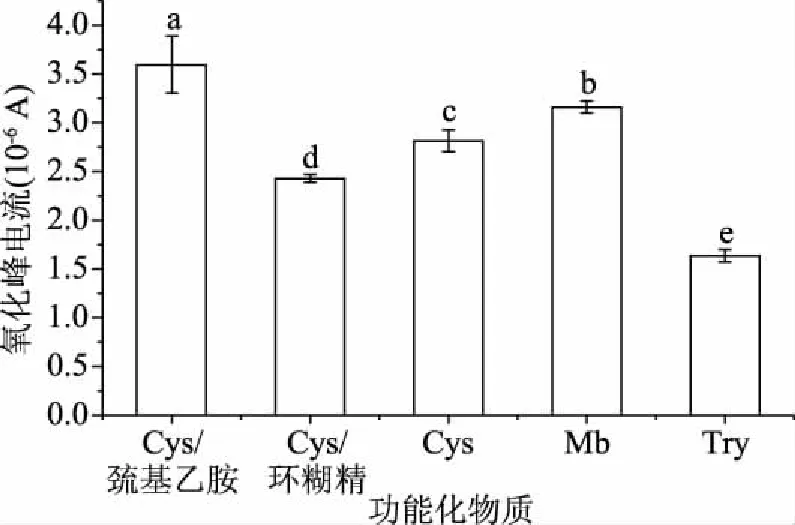
图1 不同功能化物质对修饰电极在H2O2溶液中氧化峰电流的影响
从图2的交流阻抗图可以看出,Cys/巯基乙胺/AuNPs修饰电极的的阻抗弧半径较小,它的大小决定了过氧化氢在电极表面的电子转移动力学,说明该功能化物质修饰电极对异向电子阻碍作用较小,修饰效果较好,Try/AuNPs修饰电极的阻抗弧半径较大,说明该功能化物质在金电极上修饰效果较差,与图1显示的结果一致。进一步说明对于修饰电极功能化物质的选择是合适的。与李明芳等[24]研究苯二酚测定所选用的功能化物质是相似的。
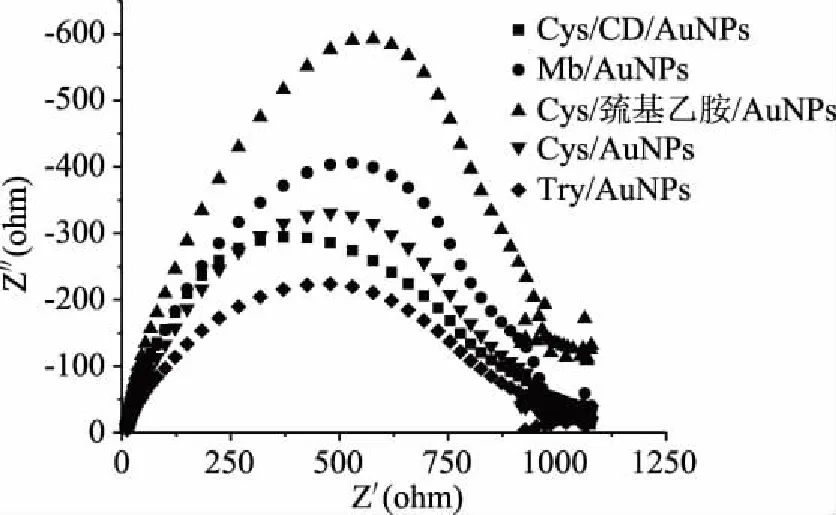
图2 不同功能化物质修饰电极在H2O2溶液中的EIS图谱
2.1.2 纳米金粒径对修饰电极检测过氧化氢的影响 如图3所示,修饰电极的纳米金粒径从10~15 nm,CV检测过氧化氢的峰电流有明显的上升趋势,从15~20 nm峰电流有明显降低趋势。不同粒径纳米金修饰电极检测过氧化氢峰电流均具有显著性差异(P<0.05)。15 nm修饰电极峰电流平均值较高为3.714×10-6A。可能是由于15 nm纳米金的小尺度,提供了更大的电极表面积,使其对电子的传递作用更好,使峰电流明显增加。可以认为15 nm纳米金修饰电极效果较优。
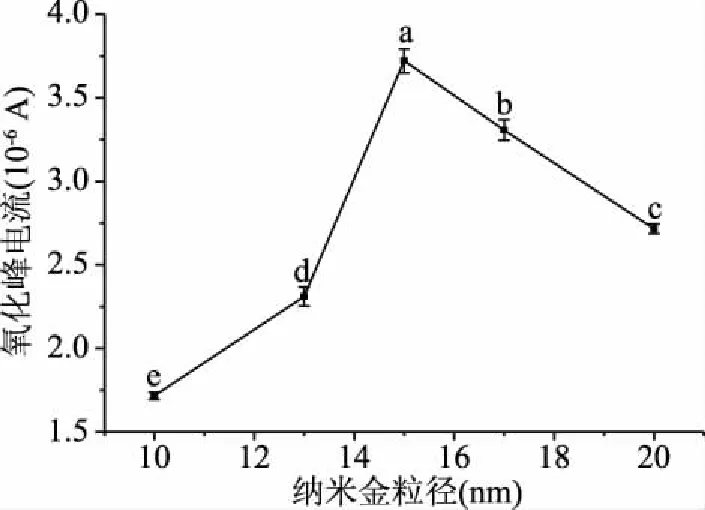
图3 不同粒径纳米金对修饰电极在H2O2溶液中氧化峰电流的影响
如图4交流阻抗图中可以看出,由于纳米金粒子的良好导电性及其小尺度,降低了电极的电阻,而15 nm的纳米金修饰电极的阻抗弧半径较小,证明其异向电子阻碍作用较小,从15~20 nm阻抗弧半径越来越大,从10~15 nm阻抗弧半径越来越小,与图3显示的结果一致,因此可以选择粒径大小为15 nm的纳米金。
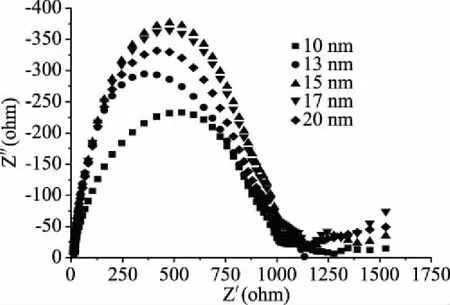
图4 不同纳米金粒径修饰电极在H2O2溶液中的EIS图谱
2.1.3 半胱氨酸浓度对修饰电极检测过氧化氢的影响 如图5,修饰了半胱氨酸浓度为0.005 mol/L电极的氧化还原峰电流平均值为9.570×10-6A,不同浓度半胱氨酸修饰电极检测过氧化氢的峰电流存在显著差异(P<0.05),半胱氨酸浓度在0.005~0.02 mol/L范围内峰电流逐渐下降,从0.0025~0.005 mol/L逐渐上升,可以看出浓度对半胱氨酸促进过氧化氢的催化氧化作用显著,认为半胱氨酸浓度为0.005 mol/L的修饰效果较好。
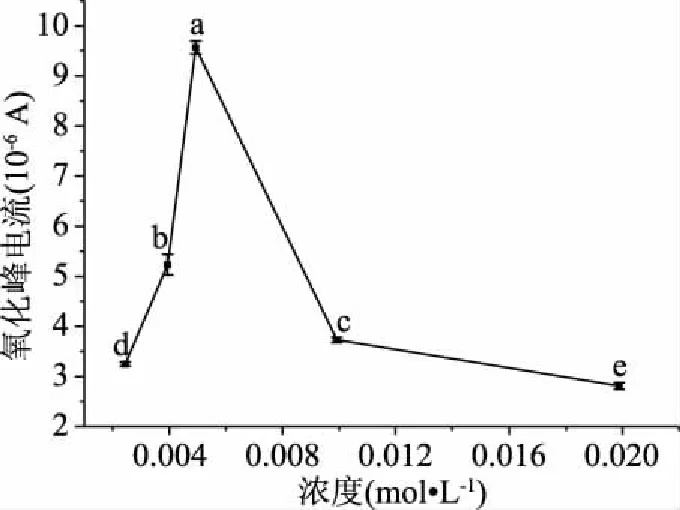
图5 不同浓度半胱氨酸对修饰电极在H2O2溶液中氧化峰电流的影响
如图6所示,不同的半胱氨酸浓度的交流阻抗图可以看出,半胱氨酸浓度从0.005~0.02 mol/L阻抗弧半径有变大趋势,从0.0025~0.005 mol/L阻抗弧半径有变小趋势,半胱氨酸浓度为0.005 mol/L时阻抗弧半径较小,异向电子的阻碍作用较小,半胱氨酸浓度为0.005 mol/L的电极修饰条件较优,与图5所得结果一致。
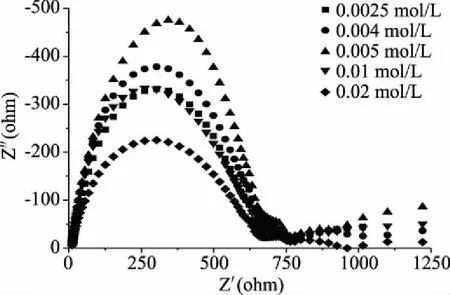
图6 不同功能化物质浓度修饰电极在H2O2溶液中的EIS图谱
2.1.4 电沉积法扫描速度对修饰电极检测过氧化氢的影响 如图7,扫描速度为110 mV/s的修饰电极的氧化还原峰电流平均值为9.428×10-6A,不同扫描速度修饰电极检测过氧化氢的峰电流存在显著差异(P<0.05),且从90~110 mV/s峰电流有上升趋势,从110~130 mV/s峰电流有降低趋势,110 mV/s的修饰条件峰电流较大。这表明过氧化氢在电极上的电化学反应主要受吸附控制,如果扫描速度过小,峰电流的变化较弱,如果扫描速率太大,导致电极充电电流过大,进而导致电极被击穿,因此可以认为110 mV/s扫描速度的修饰效果较好。
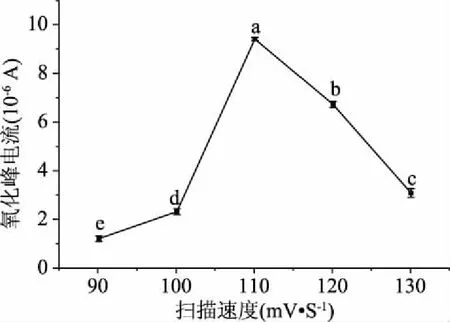
图7 不同扫描速度对修饰电极在H2O2溶液中氧化峰电流的影响
从图8交流阻抗图中可以看出,电沉积法修饰电极的扫描速度为110 mV/s的阻抗弧半径较小,其趋势与图7中的趋势具有一致性,进一步证明扫描速度的选择是合适的。
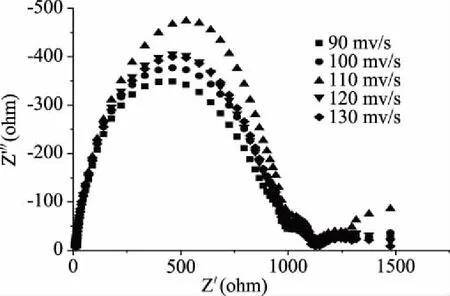
图8 不同扫描速度修饰电极在H2O2溶液中的EIS图谱
2.1.5 体系pH对检测过氧化氢的影响 如图9,pH5.0、pH6.0、pH6.7的检测条件检测过氧化氢的氧化还原峰电流之间存在显著差异(P<0.05),pH7.8与pH8.5检测条件差异不显著(P>0.05),pH为6.0时修饰电极检测过氧化氢的氧化还原峰电流较高,平均值为1.928×10-5A。在pH5.0~8.5的范围内,峰电流先增大后减小,这可能是由于质子参与了过氧化氢在电极上的氧化还原反应,所以为了提高检测的灵敏度,选择pH为6.0的检测体系。
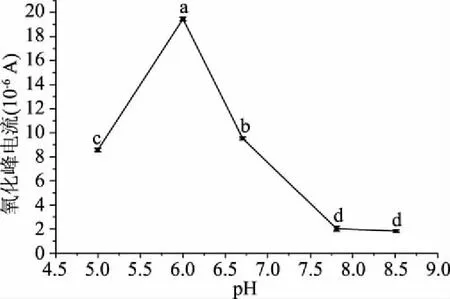
图9 不同缓冲溶液pH对修饰电极在H2O2溶液中氧化峰电流的影响
如图10,交流阻抗图中pH6.0的阻抗弧较小,说明修饰效果更好,交流阻抗阻抗弧大小趋势与图9所呈现的趋势均一致,进一步证明体系pH对过氧化氢检测效果的影响较大,pH6.0对过氧化氢的检测效果较优。与曹挺等[25]的实验结果一致。
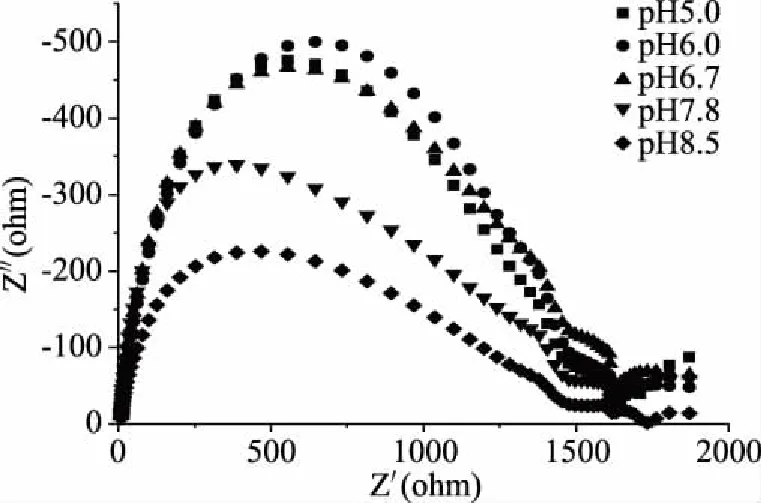
图10 不同缓冲溶液pH对修饰电极在H2O2溶液中EIS的影响
2.2 修饰电极检测过氧化氢的方法学考察
2.2.1 标准曲线的制作 如图11所示,随着过氧化氢浓度的升高,氧化还原峰电流出现了明显的升高,因此可以确定过氧化氢浓度与峰电流之间存现明显的线性关系,得到线性回归方程为y=5.82x+1.35,相关系数r=0.997,说明过氧化氢浓度与峰电流的线性关系良好。
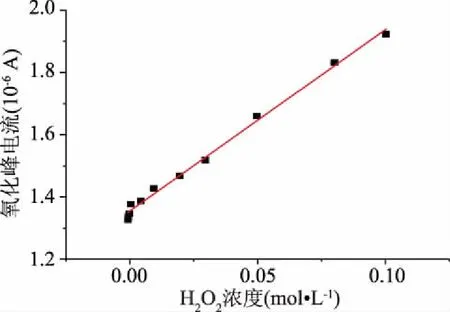
图11 修饰电极检测过氧化氢标准曲线
2.2.2 检出限与定量限 计算可得检出限达0.129 μmol/L,低于Wang等[26]、王任等[27]、Abdolmohammad-Zadeh等[28]检测过氧化氢的检出限,定量限为0.431 μmol/L。
2.2.3 修饰电极的精密度与稳定性实验 采用同一根功能性纳米金修饰电极检测过氧化氢5次,电流响应的标准偏差(RSD)为3.86%,用平行制备的5根电极对过氧化氢进行检测,电流响应的标准偏差(RSD)为4.42%,可证明该修饰电极检测过氧化氢具有良好的精密度和稳定性。
2.2.4 修饰电极的抗干扰性能 由图12,加入过氧化氢100倍浓度的精氨酸,峰电流仅从-2.726×10-7A降至-2.731×10-7A,加入过氧化氢100倍浓度的KCl溶液峰电流仅从-2.686×10-7A降至-2.697×10-7A,与曹嫱等[29]文献中检测过氧化氢抗离子干扰实验所用10倍过氧化氢浓度的离子浓度I-t曲线比较,可以证明该修饰电极对葡萄糖、甘氨酸、组氨酸、抗坏血酸、精氨酸、钾盐和钠盐的催化性能,即上述物质对过氧化氢的检测结果影响较小,表明该电极在过氧化氢的检测上具有较优的抗干扰能力。
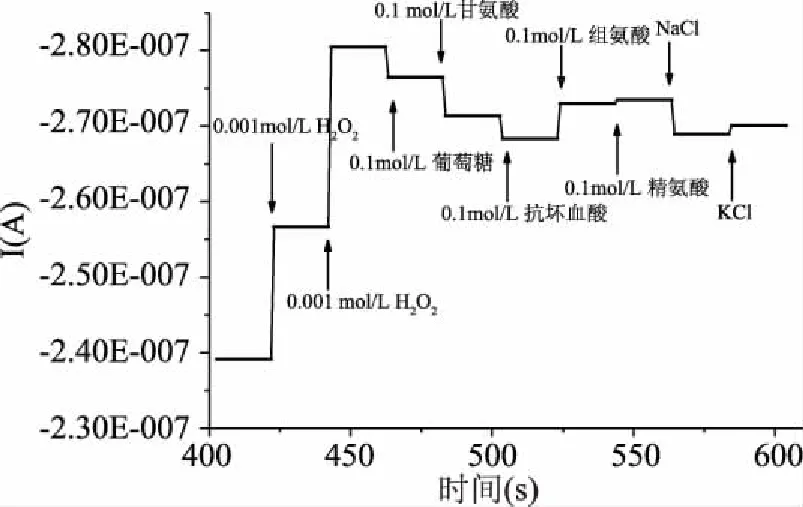
图12 修饰电极抗离子干扰I-t曲线
2.2.5 方法的加样回收率 通过于3 mL实际样品中添加200 μL的过氧化氢进行分析并计算回收率,结果如表1。可得回收率在92.1%~95.6%之间,RSD在2.26%~4.52%之间,表明该方法可用于实际样品中过氧化氢的检测。
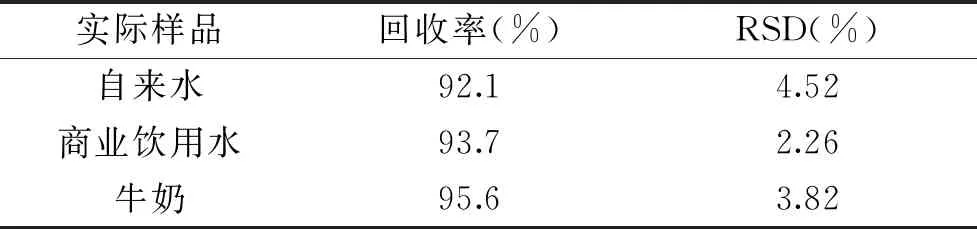
表1 修饰电极检测方法的加样回收率
3 结论
采用电沉积的方法修饰电极,通过考察对修饰修饰电极在修饰电极上的电化学行为,最终得到优化条件,优化条件下修饰电极检测过氧化氢的相关系数r=0.997,线性关系良好,检出限可达0.129 μmol/L,定量限可达0.431 μmol/L,具有较高的精密度以及较优稳定性和抗离子干扰能力,同时通过加标回收实验考察了检测方法的准确度,因此,该方法对真实样品和其他干扰物质的检测具有良好的灵敏度和选择性,可以被认为是一种具有高灵敏度和高选择性的过氧化氢检测方法,可用于食品中微量残留过氧化氢的含量测定,并为食品以及饮用水中过氧化氢残留量的检测提供了参考依据。
