猪小肠粘膜碱性磷酸酶的分离纯化及性质研究
2020-10-23谢智鑫刘丹怡刘容旭杨宏博韩建春
杨 红,谢智鑫,刘丹怡,刘容旭,杨宏博,韩建春,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.黑龙江省绿色食品研究院,黑龙江哈尔滨 150000)
碱性磷酸酶(Alkaline phosphatase,ALP)是一类磷酸酯水解酶,能水解磷酸单酯生成磷酸根离子以及对应的醇、酚等。ALP是具有两个锌离子和一个镁离子的同型二聚体蛋白。细菌及人体中都发现了ALP,存在于众多生物中,在生物体内能够维持钙磷酸代谢平衡[1]。在多项研究表明下,ALP水平已被用作疾病诊断的指标;其血清中升高的水平与骨骼、肝脏和其他疾病的存在相关[2]。在基因工程中,ALP可以作为工具酶使用,因此对不同来源的ALP进行分离、纯化及其性质研究具有重要意义[3]。
目前,国内外研究学者分别对不同种属来源的ALP进行分离、纯化。在动物体内研究颇多,例如鸡肝[4]、白鲢肠[5]、草鱼肝胰脏[6]等,少数学者也对动物肌肉组织中的ALP进行过分离、纯化。
虽然有大量学者对ALP进行过分离纯化,但总结目前常规纯化动物组织ALP的方法主要是利用正丁醇除脂、硫酸铵分级沉淀,然后采用阴离子交换层析和凝胶过滤的方法达到分离、纯化目的。例如余同等[7]也是通过正丁醇提取、硫酸铵作用下沉淀、经过EAE-32柱层析、最后凝胶过滤得到纯牛小肠的ALP;焉翠蔚等[8]用Tris-HCl缓冲液取代正丁醇提取、硫酸铵分级沉淀、柱层析、凝胶过滤等步骤从菲律宾蛤仔中分离纯化得到ALP。除此之外,Wang等[9]从牛小肠中采用仿生染料配体固定在Sepharose CL-6B上的方法,用亲和吸附剂与含有Cibacron Blue 3F-GA的非仿生吸附剂进行分离纯化ALP。近些年,国外的研究人员Farzi-Khajeh等[10-11]从蛋黄和脱脂牛乳中采用化学沉淀法和表面修饰等方法制备了碱性磷酸酶的专用纳米载体,用纳米载体方法快速、低成本的进行分离纯化ALP。
本文旨在探究以猪小肠粘膜为原材料的ALP分离、纯化的新方法,利用蛋白质的结构特性,通过疏水层析与离子交换层析相结合的方法对其进行纯化,对纯化后的猪小肠粘膜ALP进行酶学性质研究,本实验在传统分离、纯化的基础上增加疏水层析过程,改变蛋白质的疏水性从而直接结合在层析填料上,从而代替正丁醇除脂、硫酸铵分离沉淀蛋白的方法,达到分离、纯化猪小肠粘膜ALP的方法,为不同来源的ALP及蛋白质分离纯化提供新的方法,同时也为进一步研究该酶和不同来源的ALP分离纯化提供理论上的参考和思路。
1 材料与方法
1.1 材料与仪器
猪小肠 来源于黑龙江省甜草岗黑猪肉直营店,采用无菌薄膜包装后冷冻(-20 ℃)储存;BCA 蛋白定量试剂盒、丙烯酰胺、甲叉双丙烯酰胺、Tris(三羟甲基氨基甲烷)、SDS(十二烷基硫酸钠)、TEMED(四甲基乙二胺)、过硫酸铵 Sigma公司;碱性磷酸酶试剂盒 Beyotime公司;DEAE BestaroseTMFF弱阴离子交换介质、Phenyl BestaroseTMHP高分辨率疏水层析介质、Sephacryl S-200凝胶过滤层析介质 Bestchrom公司;蛋白质标准品 Solarbio公司;其他有机试剂 均为分析纯。
1.2 实验方法
1.2.1 猪小肠粘膜ALP的分离纯化 参照余同等[7]方法并适当修改,猪小肠经过蒸馏水清洗后刮取内壁黏膜,将其真空冻干(温度:-35~-50 ℃、时间:24 h)成水分含量小于5%的小肠粘膜冻干粉。
取4 g冻干粉按照1∶200 (m/V)加入含有0.8 mol/L(NH4)2SO4、0.1%吐温80的20 mmol/L Tris-HCl pH8.5的样品缓冲液,匀浆后均匀搅拌1 h;4 ℃条件下10000 r/min,离心20 min,上清液滤过(0.45 μm滤膜),获得猪小肠ALP粗酶液。将准备好的粗酶液用AKTA pure 蛋白纯化仪进行纯化。
首先采用疏水层析。在上样前要平衡疏水层析柱,洗脱过程按直线梯度,洗脱缓冲液浓度为20 mmol/L Tris-HCl(pH8.5),其中含有0.8~0 mol/L(NH4)2SO4,收集每管5 mL洗脱峰用于检测活性,合并活力峰后用20 mmol/L Tris-HCl pH8.5的缓冲液进行脱盐置换。然后将上一步所得液进行DEAE阴离子层析,进行直线梯度洗脱的洗脱过程同上,但将上述洗脱缓冲液(NH4)2SO4换成NaCl为 0~0.5 mol/L的浓度进行,活性检测同上述,合并活力峰超滤浓缩后过Sephacryl S-200凝胶过滤层析得猪小肠ALP。
1.2.2 酶活力的检测 采用碱性磷酸酶试剂盒[12-13]测定其酶活力,原理为酶在底物p-NPP(对硝基苯酚磷酸二钠)作用下呈现黄色产物,可在400~415 nm检测吸光度。酶活力计算:在pH9.8的DEA缓冲液、37 ℃条件下,每分钟水解p-NPP显色底物所产生1 μmol对硝基苯酚所需的碱性磷酸酶的量定义为一个酶活力,具体根据试剂盒说明书。
1.2.3 蛋白质浓度的测定 采用Bradford法[14]测定蛋白质浓度,牛血清蛋白为标准样品。
1.2.4 SDS-PAGE电泳 采用分离胶和浓缩胶体积分数分别为10%、5%的聚丙烯酰胺凝胶电泳进行鉴定,利用考马斯亮蓝R-250进行染色。
1.2.5 圆二色谱(CD)检测 参考陈凤娟[15]方法,对分离纯化后的猪小肠粘膜ALP进行圆二色谱检测。
1.2.6 猪小肠ALP酶学特性研究
1.2.6.1 最适pH及其pH稳定性的测定 缓冲液配制成浓度为20 mmol/L,不同pH的Tris-HCl(pH7.0~8.0)、Gly-NaOH(pH9.0~10.0)、NaHCO3-NaOH(pH11.0~12.0)。将不同pH的缓冲液取0.9 mL、加入0.1 mL的蛋白质酶液混合,然后在37 ℃预热5 min后检测活性。在不同pH下,得到的酶活力绘制成曲线,求出猪小肠ALP的最适pH。室温下,测定稳定性时,将酶液于不同pH下静置1 h后测定其酶活。酶活测定方法同1.2.2。
相对酶活(%)=测定pH的酶活/最适pH的酶活×100
1.2.6.2 最适温度及温度稳定性的测定 采用pH9.5的样品缓冲液(Gly-NaOH),温度分别设定为从10、20~60 ℃(每间隔5 ℃),共10个温度值。保温时间10 min,测定酶活力。测定稳定性时,将测的酶液放在不同温度下保温1 h后测定其酶活,酶活测定方法同1.2.2。
相对酶活(%)=测定温度的酶活/最适温度的酶活×100
1.2.6.3 金属离子及EDTA对酶活的影响 取等量酶液分别加入MgCl2、ZnCl2、CaCl2、EDTA及蒸馏水,使其最终浓度1、5、25、50 mmol/L,在最适温度和pH下,37 ℃预热10 min,检测酶活。
相对酶活(%)=加入金属离子的酶活力/未加入金属离子的酶活力×100
1.3 数据处理
采用SPSS 16.0软件进行数据处理,Origin 8.0软件及CDPro软件包进行数据分析。
2 结果与分析
2.1 小肠粘膜ALP的分离纯化
2.1.1 Phenyl High Performance疏水层析 制备猪小肠粘膜粗酶液完成后,首先对其进行疏水层析。将疏水层析柱装好后,用含有0.8 mol/L(NH4)2SO4、20 mmol/L Tris-HCl pH8.5的缓冲液平衡4~5个柱体积,使疏水填料达到稳定状态;然后以5 mL/min的流速进行上样,完成后再用上述缓冲液进行再平衡达到稳定。疏水层析图及酶活力如图1所示。
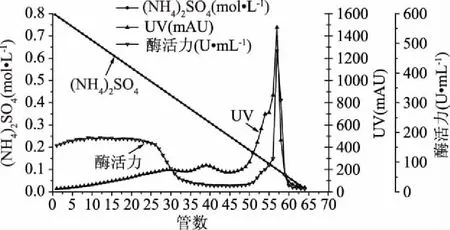
图1 ALP的Phenyl High Performance疏水层析图
由图1可知,当(NH4)2SO4浓度由0.8 mol/L逐渐降低到0 mol/L时,疏水层析过程中主要出现4个洗脱峰,其中峰1主要集中在1~34管区域,峰2主要集中在35~45管区域,峰3集中在46~55管区域,峰4集中在56~65管区域。当(NH4)2SO4浓度由0.8 mol/L降低到0.4 mol/L时,根据酶活力的测定结果可知,小肠粘膜ALP被大量洗脱下来;当(NH4)2SO4的浓度小于0.4 mol/L后,出现三个洗脱峰,但是根据酶活力测定结果显示,在35~45管区域酶活力逐渐降低,46~65管区域虽然有活力,但是蛋白质含量逐渐升高,说明此区域有大量杂质蛋白被洗脱,故将35~65管区域中的洗脱液舍去,1~34管合并为一管,用20 mmol/L Tris-HCl pH8.5的缓冲液进行脱盐置换。经过过滤(0.2 μm滤膜)后冷藏保存待用。
2.1.2 DEAE Fast Flow阴离子层析 2.1.1所得洗脱液进行DEAE弱阴离子层析。首先用20 mmol/L Tris-HCl pH8.5的缓冲液进行平衡后上样,待上样完成后用相同的缓冲液进行再平衡,待达到平衡后进行洗脱。
洗脱缓冲液进行直线梯度洗脱,洗脱速度为5 mL/min,洗脱液收集为5 mL每管,用于检测活性,结果如图2所示。
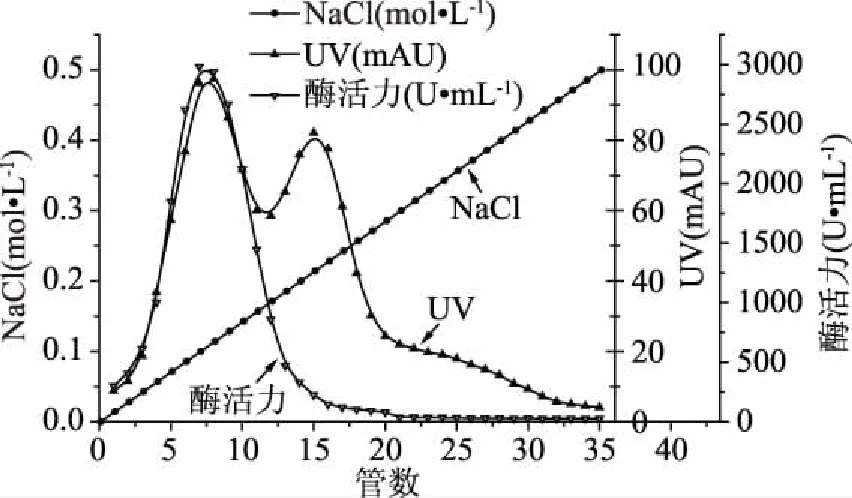
图2 ALP的DEAE Fast Flow阴离子层析图
由图2可知,当NaCl浓度由0 mol/L逐渐升高到0.5 mol/L时,DEAE阴离子交换层析过程中主要出现3个洗脱峰,其中峰1主要集中在1~12管区域,峰2主要集中在13~21管区域,峰3集中在22~35管区域。根据酶活力测定结果可知,峰1为主要的活力峰,峰2、3区域虽有活性但酶活迅速降低,与此同时其他的杂质蛋白被大量洗脱下来,故将13~35管舍去,留下1~12管。
2.1.3 Sephacry S-200凝胶过滤层析 将2.1.2所得到洗脱液经过浓缩后过S-200凝胶层析,洗脱液为20 mmol/L Tris-HCl pH8.5,洗脱速度为1 mL/min,以每管1 mL收集洗脱峰并检测活性,Sephacry S-200凝胶过滤层析结果如图3所示。

图3 ALP的Sephacry S-200凝胶层析图
由图3可知,经Sephacry S-200凝胶过滤层析后得到1个洗脱峰。根据酶活力测定结果可知,随着蛋白浓度的升高酶活力增强,并且洗脱峰有良好的对称性,说明可能是一类蛋白被洗脱下来。可以通过SDS-PAGE电泳图对其纯度进行测定。
2.1.4 猪小肠ALP分离纯化小结 猪小肠粘膜经过真空冻干、缓冲溶液充分溶解、离心等步骤处理后,先后经过Phenyl High Performance疏水层析,DEAE Fast Flow阴离子层析,Sephacryl S-200凝胶层析纯化后得到猪小肠粘膜ALP,分别留样测定蛋白浓度和活性。结果见表1。

表1 猪小肠粘膜中ALP的分离纯化
由表1可知,猪小肠粘膜粗酶冻干粉(经正丁醇处理)经过Tris-HCl溶解后,利用Phenyl High Performance疏水层析介质对其进行纯化,碱性磷酸酶的比活力由0.28 U/mg升至为7.9 U/mg,纯化倍数达到28.2,酶活损失约为68.5%,剩余酶活约为31.5%。表明原料中约有30%甚至更高的碱性磷酸酶可以与Phenyl High Performance疏水层析介质发生结合,说明Phenyl High Performance疏水层析介质可以利用碱性磷酸酶的蛋白质疏水性对其进行分离纯化。经过Sephacryl S-200凝胶过滤的碱性磷酸酶比活力达到19.1 U/mg,纯化倍数68.2。纯化倍数低于牛肝[16]获得的ALP的纯化倍数(228.74),高于从海参肠[17]中获得的ALP的纯化倍数(10.93)和合浦珠母贝[18]的纯化倍数(48.56)。
2.2 SDS-PAGE 电泳图
取纯化好的猪小肠ALP(已完成凝胶过滤层析),通过SDS-PAGE电泳得到的电泳图如图4所示。
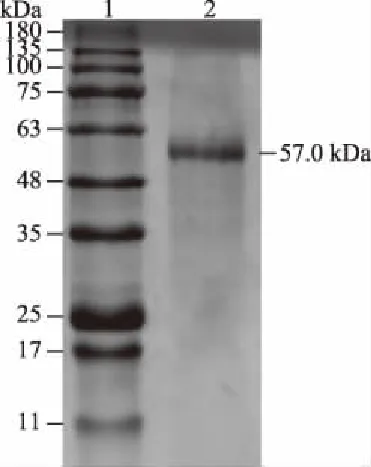
图4 ALP的SDS-PAGE电泳图
图4中,能够清晰看到单独一条带为纯化后的ALP,已达到电泳纯,根据已知标准第一列的分子量Maker,得到纯化后的样品分子量为57.0 kDa。与马金虎等[6]从草鱼肝胰脏ALP中分离得出的分子量约为54 kDa相近。而不同种属来源的ALP的分子量大小也不尽形同,大凉疣螈[19]为48.1 kDa,乳酸菌[20]为40 kDa,墨吉明对虾[21]为70 kDa,罗氏沼虾[22]为72 kDa。
2.3 圆二色谱(CD)检测结构的分析
本实验采用200~260 nm远紫外光谱下测定经分离纯化后的碱性磷酸酶样品,测定结果如图5所示。
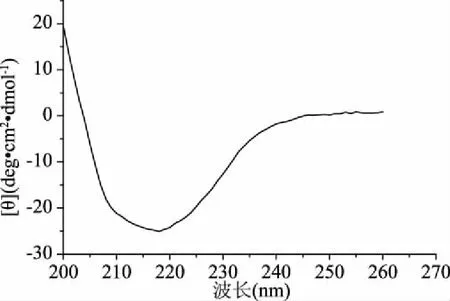
图5 ALP的圆二色谱图谱

表2 ALP二级结构含量
根据Origin 8.0软件及CDPro软件包分析进行图谱分析,分离纯化后的猪小肠粘膜ALP的蛋白质溶液中,α-螺旋、β-折叠、β-转角、无规则卷曲分别为3.6%、41.8%、21.5%、33.1%。
2.4 小肠粘膜ALP的酶学特性
2.4.1 ALP的最适pH及其稳定性 采用1.2.2方法测定pH对ALP相对酶活力的影响见图6,猪小肠粘膜ALP在pH7.0~8.5时相对酶活力较低,随着pH增加相对酶活力逐渐升高,当pH9.5时ALP相对酶活力达到最高,当pH大于9.5时,相对酶活力呈下降趋势。猪小肠ALP最适pH为9.5,与牛小肠[7]、猪肌肉组织[23]、合浦珠母贝[18]以及菲律宾蛤仔[8]接近,与其他ALP来源,例如南方鲇[24]10.1、白鲢肠[5]10.2、黄鳝肝脏[25]10.4、鸡肝[4]10.5均有不同程度的差异性,由此说明不同物种来源的ALP的性质也不尽相同。
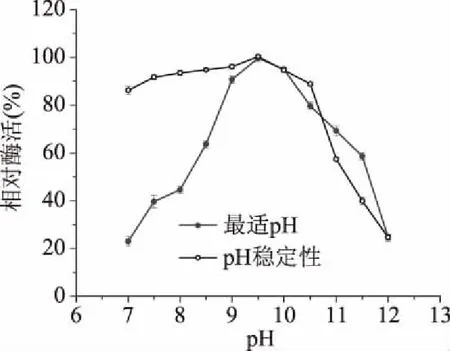
图6 pH对ALP活力及其稳定性的影响
pH对ALP稳定性的影响见图6,猪小肠粘膜ALP在pH7.0~10.5时相对酶活力较为稳定,在pH超过10.5后相对酶活迅速下降,由此可以猜测当pH大于10.5时,ALP的结构发生变化导致酶活力迅速下降。
2.4.2 ALP最适温度及其稳定性 温度对ALP相对酶活力的影响,见图7,温度在10~30 ℃之间相对酶活力逐渐上升时,高于30 ℃时,随着温度升高相对酶活力逐渐减少,由此说明猪小肠粘膜ALP在30 ℃时相对酶活力最高。牛小肠[7]和海参肠[17]中的为45 ℃、地衣芽孢杆菌[26]为50 ℃,由此可见差异性。
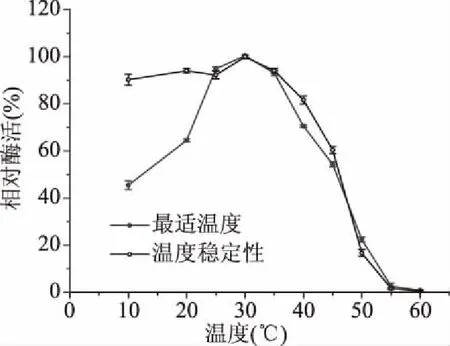
图7 温度对ALP酶活力及其稳定性的影响
温度对ALP稳定性的影响如图7,在40 ℃前相对酶活力随着温度升高能够保持平稳,在此之后随着温度变化相对酶活力逐渐减少,由此说明当温度超过40 ℃时,ALP相对酶活力稳定性差且迅速降低。
2.4.3 金属离子及EDTA对ALP酶活力的影响 金属离子对ALP酶活力有影响,是源于ALP作为金属酶。测定猪小肠ALP活性受不同浓度的金属离子的影响,结果如表3所示。

表3 常见金属离子对酶活力的影响(%)
Mg2+、Zn2+、Ca2+以及EDTA对猪小肠粘膜ALP的酶活力均有一定程度的影响,其中起到猪小肠ALP激活作用的为Mg2+、Ca2+,抑制作用的为Zn2+、EDTA。起到激活作用的浓度在低浓度(1 mmol/L)时,Mg2+和Ca2+有不同的激活效果,Ca2+比Mg2+的作用强,随着浓度升高Mg2+和Ca2+对猪小肠ALP的激活能力逐渐增强,当浓度大于25 mmol/L时,Mg2+和Ca2+对ALP酶活力的影响相对稳定。当Zn2+浓度在1~5 mmol/L时,猪小肠ALP的酶活力呈下降趋势明显,对其影响相对稳定时的浓度大于5 mmol/L。在金属离子Zn2+的影响下,随着浓度的增加使得ALP的蛋白质变形失活,可能由于Zn2+本身结合力使其占据底物与酶的结合位点。EDTA作为金属螯合剂对ALP酶活力有较强的抑制作用,随着浓度的增加ALP酶活力逐渐降低,因此可知ALP作为一种金属酶,会受到金属离子影响自身的结构和活性[27]。ALP作为一种生物体物质代谢的糖蛋白,研究金属离子和EDTA对酶活性的影响是有必要的,可以通过合适的金属离子来改善猪小肠粘膜的ALP酶活性,有助于提高经济效益,为将来继续进一步探究金属离子对猪小肠ALP酶活性提供方法。
3 结论
猪小肠粘膜经过分离纯化得到的猪小肠粘膜ALP,该酶达到电泳纯,分子量为57.0 kDa,纯化倍数为68.2,比活力倍数为19.1 U/mg。利用圆二色性光谱测定纯化后蛋白二级结构,结果为α-螺旋3.6%、β-折叠41.8%、β-转角21.5%、无规则卷曲33.1%。ALP在催化底物对硝基苯磷酸二钠(p-NPP)作用下最佳温度30 ℃、最佳pH为9.5;金属离子对ALP起到激活的离子为Mg2+和Ca2+,起到抑制的离子为Zn2+和EDTA。
