γ-聚谷氨酸生产菌株的鉴定及发酵培养基优化
2020-10-23王玲莉魏占波高纪超石元亮
张 雷,张 蕾,王玲莉,魏占波,李 杰,周 怡,丁 芳,高纪超,石元亮,*
(1.中国科学院沈阳应用生态研究所,辽宁沈阳 110016;2.中国科学院大学,北京 100049 3.吉林农业科技学院,吉林吉林 132000)
γ-PGA(γ-聚谷氨酸)是由谷氨酸单体脱水缩合形成的一种阴离子异性肽,骨架由γ-酰胺键连接,其侧链为游离的羧基,分子量一般在104~2×106Da之间[1]。聚谷氨酸分子与水形成氢键连接后,使其具备了良好的水溶性、强保湿性、粘结性等功能[2]。根据分子量不同呈现出的功能差异,γ-PGA分别用于化妆品、食品、医药、农业等众多领域[3-4]。γ-PGA对人体无毒无害,吸附性良好,形成的胶体稳定性强,常用作食品增稠剂和祛苦味剂等[5]。
γ-PGA生产方法有化学合成法、酶催化法、微生物发酵法等[6]。其中,微生物发酵的生产条件简单、目标产物含量高,目前已经成为γ-PGA工业生产的首选方法。按照发酵中微生物培养状态,又可将其分为固态发酵和液态发酵。相比于液态发酵,虽然固体发酵中γ-PGA的产量高,但是提取十分困难[7],难以实现工业化生产。现阶段,国内外对γ-PGA发酵的研究仍集中在液体发酵。随着工业中γ-PGA产量需求不断增加,如何通过液体发酵提高γ-PGA产量是目前γ-PGA的产业化进程中最重要的任务之一。目前,对该问题的研究主要集中在菌株筛选、发酵工艺优化和基因工程改造等三个方向,并取得一定成果[8-10]。但由于聚谷氨酸代谢的调控基因众多,通过单一基因的敲除、敲入或过表达,容易引起细胞内代谢的紊乱;同时,菌株筛选存在周期长和稳定性不佳等方面的问题,短期内难以满足现实生产需求。因此,优化γ-PGA发酵工艺,尤其对培养基的优化仍是当前提高工业发酵生产γ-PGA产量的重要手段。目前,培养基优化试验设计的方法主要有因子设计、响应曲面设计、田口设计、人工神经网络设计等[11-14]。其中,响应面不仅可以从众多因子中筛选出具有显著效应的因子,作出正确评价,还能够展示出主要影响因素的交互作用,从而高效地得到最优解,因而被广泛应用[15-17]。但是由于培养基成分复杂、因子间交互作用等原因,人们难以对γ-PGA发酵优化进行全面而系统的研究,形成了目前γ-PGA生产中发酵产物浓度低、底物转化率低等不利局面,导致其市场供应能力严重不足,阻碍了γ-PGA的商业化进程[10]。
菌株N-2是本实验室筛选的一株γ-PGA生产菌株,当培养基中添加谷氨酸时显示出强大的γ-PGA合成能力(γ-PGA的产量21.20 g/L)。本文通过对该菌株培养基组分优化,旨在进一步提高其发酵产量,降低生产成本,为其工业化应用提供技术支撑。
1 材料与方法
1.1 材料与仪器
N-2菌株 中科院土壤养分高效利用工程研究室保存;EasyPure Bacteria Genomic DNA Kit 北京全式金生物技术有限公司;Taq PCR 试剂盒 北京百奥莱博科技有限公司;溶菌酶 北京索莱宝科技有限公司;聚谷氨酸标品 上海源叶生物科技有限公司;本试验所用其余试剂 均为分析纯。
OLB-200B欧莱博试验室恒温摇床 济南欧莱博科学仪器有限公司;台式高速冷冻离心机TGL-16M 长沙湘仪离心机仪器有限公司;净化工作台 苏州净化设备有限公司;GeneAmp 2700 PCR仪 美国赛默飞世尔科技公司;JY1000C电泳仪、JY04S-3C凝胶成像系统 北京君意东方电泳设备有限公司;BioSpec-nano核酸浓度测定仪 日本岛津株式会社;UV755B分光光度计 常州三丰仪器科技有限公司;MLS-3751L-PC型高压蒸汽灭菌器 松下健康医疗器械株式会社。
1.2 实验方法
1.2.1 培养基配制 液体LB培养基(Luria-Bertani medium,LB medium)(g/L):牛肉膏10,蛋白胨5,氯化钠10,pH7.2;种子培养基(g/L):葡萄糖30,谷氨酸钠10,酵母浸粉8,K2HPO4·3H2O 4,(NH4)2SO42,MgSO4·7H2O 0.1,MnSO4·H2O 0.04,pH7.0;初始发酵培养基(g/L):葡萄糖 30,谷氨酸钠30,酵母浸粉8,K2HPO4·3H2O 4,(NH4)2SO42,MgSO4·7H2O 0.1,MnSO4·H2O 0.04,pH7.0;灭菌条件:115 ℃灭菌20 min,葡萄糖与其它物质独立分装,灭菌后混合。
1.2.2 菌种培养方法 种子培养:以1%接种量将甘油菌种接至50 mL种子培养基(250 mL三角瓶),37 ℃,220 r/min,恒温振荡16 h[18]。发酵培养:5%的种子液接至1.2 mL发酵培养基中(于24孔方形深孔板)[19],32.5 ℃,220 r/min,恒温振荡54 h。
1.2.3γ-PGA含量的测定 参考文献[20],浊度法测定γ-PGA含量。取γ-PGA标品,配制成不同浓度的γ-PGA标准液;另取发酵液,移液枪充分吹打,3500 r/min离心25 min,取上清液,加入3倍体积的无水乙醇,4 ℃下静置过夜,10000 r/min离心10 min,弃去上清液,加入等体积的无菌水溶解后,稀释适当倍数,得待测液。分别在标准液和待测液中等体积加入5 g/L的CTAB溶液,常温孵育3 min,测定吸光度A250,并绘制标准曲线并计算聚谷氨酸含量Y。
Y(g/L)=2 VCA250N
式中:CA250标准曲线中对应的聚谷氨酸浓度(μg/mL),V为待测液体积,N为稀释倍数。
1.2.4 16s rDNA序列同源性分析及系统发育树构建
1.2.4.1 基因组DNA的提取 按EasyPure Bacteria Genomic DNA Kit说明书进行。
1.2.4.2 16S rDNA的扩增和测序反应体系的构建 按照Taq PCR试剂盒说明书构建。引物[21]27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-TACCTTGTTACGACTT-3′);PCR扩增条件如下:94 ℃预变性5 min,1个循环;94 ℃变性30 s,56 ℃退火1 min,72 ℃延伸1 min 30s,35个循环;72 ℃后延伸10 min,1个循环,4 ℃保存。扩增产物的纯化和测序工作由深圳华大基因科技有限公司(北京分公司)完成,测序结果提交GenBank数据库(https://submit.ncbi.nlm.nih.gov/subs/genbank/)。
1.2.4.3 系统发育树构建 利用NCBI的BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.c-gi)进行同源序列比对,根据比对结果选取相应的模式菌株序列[22];使用MEGA X软件(https://www. megasoftware. net/)构建系统发育树并确定菌株的分类学地位。
1.2.5 单因素试验 参照文献[23-26],以γ-PGA产量为目的指标,对碳源、氮源、无机盐种类进行优化。选取等质量甘油、蔗糖、果糖、麦芽糖、柠檬酸替换初始发酵培养基中的葡萄糖;等质量的大豆蛋白胨、牛肉蛋白胨等复合氮源替换复合氮源酵母浸粉;等质量的NH4NO3、NH4Cl、尿素等无机氮源替换(NH4)2SO4,其余成分均与 1.2.1所示的初始发酵培养基相同,于37 ℃、pH7.0,220 r/min条件下恒温振荡培养54 h,考察不同碳、氮源对γ-PGA产量的影响;在去除无机盐的初始发酵培养基中逐一添加K2HPO4·3H2O、(NH4)2SO4(2 g/L),MgSO4·7H2O(0.1 g/L),MnSO4·H2O、ZnCl2·7H2O、Na2MoO4·3H2O(0.05 g/L),考察不同无机盐对γ-PGA产量的影响。
1.2.6 PB试验 参考文献[27],以γ-PGA产量(Y)为响应值,选取单因素试验的9个因素(葡萄糖、酵母膏和谷氨酸钠、K2HPO4·3H2O、(NH4)2SO4、MgSO4·7H2O、MnSO4·H2O、ZnCl2·7H2O、Na2MoO4·3H2O)为自变量,分别编号为A、B、C、D、E、F、G、H、I,考察培养基组分对发酵的影响。使用Minitab 18软件进行N=12的PB试验设计安排,每个因素取高(+)和低(-)两个水平,高水平为低水平的1.25倍,见表1。
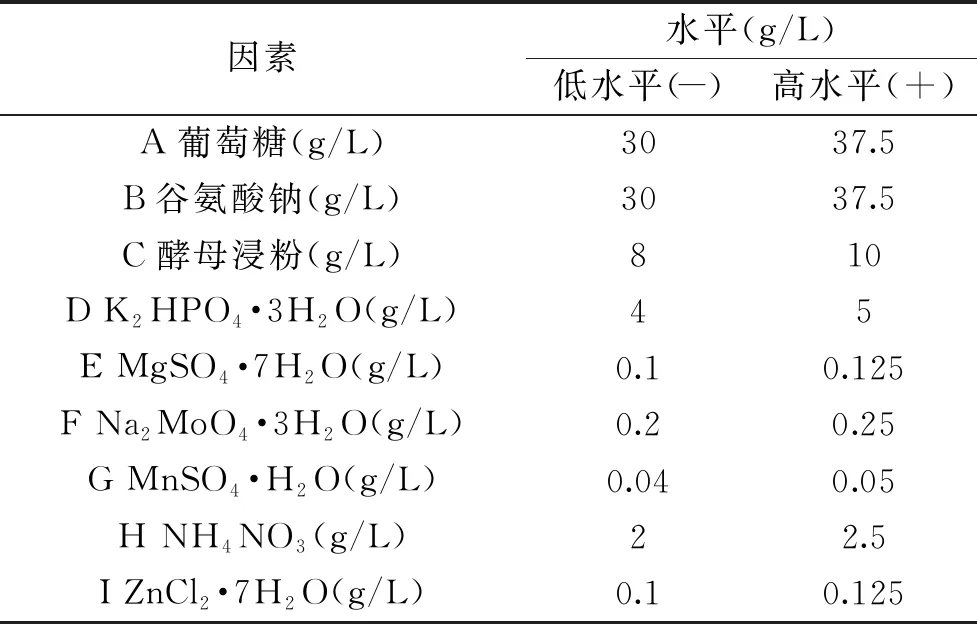
表1 Plackett-Burman 试验设计因素与水平表
1.2.7 最陡爬坡试验设计 参照文献[28],依据PB设计试验结果选出显著影响γ-PGA产量的三个因子(葡萄糖、谷氨酸钠、K2HPO4·3H2O),并根据因子的正负效应设定步长及变化方向,以逼近最佳响应面区域,确定响应面分析的中心点。正效应取PB试验高水平,方向向上,负效应取低水平,方向向下。
1.2.8 响应面设计与分析 以PB试验筛选出的因子为自变量,爬坡试验的中心点为自变量零点,γ-PGA的产量作为响应值,利用minitab软件设置三因素三水平(n=15)的Box-Behnken响应面试验(见表2),并进行统计分析。上述所有试验,每个试验点均设置三次平行。

表2 Box-Behnken试验设计因素与水平表
1.3 数据处理
采用IBM SPSS Statistics 22软件one-way ANOVA方法进行方差分析,LSD法进行多重比较。P<0.05表示差异显著,P>0.05表示差异不显著。单因素试验结果采用OriginPro 8.6软件进行图表绘制。PB试验、响应面设计数据由软件Minitab 18进行数据处理和图形绘制。
2 结果与分析
2.1 菌株鉴定
试验提取了N-2的基因组,经过PCR扩增、纯化、测序后获得1170 bp的16s rDNA核酸片段。通过Blast同源比对发现N-2菌株的16s rDNA与枯草芽孢杆菌(Bacillussubtilis)MT081485.1、MN696247.1、MK578252.1等核酸序列的相似度达99%。通过选取相应的模式菌株,利用Mega X软件,以Aureibacillushalotolerans为外群构建系统发育树并进行系统发育分析(图1)。由图可知:N-2菌株与Bacillussubtilis的进化距离最近,经过Bootstrap法评估,二者聚为同一分枝的支持率为86%,由此将N-2菌株鉴定为枯草芽孢杆菌,命名为BacillussubtilisN-2,将其16s rDNA核酸序列提交至Genebank,获得接收号为MK027094.1。

图1 基于邻接法(Neighbor-Joining method,N-J method)构建的N-2菌株16S rDNA序列的系统发育分析(K-2模型,自展法采样1000次)
2.2 单因素实验结果
2.2.1 不同碳源对发酵的影响 碳代谢是生物体中心代谢的核心,为生物体提供能量和有机碳骨架,是生物体生长的最重要能源物质之一。不同碳源对γ-PGA发酵产量影响的统计结果见图2。由图2可知:经不同碳源发酵后,γ-PGA的产量大小顺序为:葡萄糖>蔗糖>果糖>甘油>麦芽糖>柠檬酸。多重比较分析表明:葡萄糖发酵后的γ-PGA的产量显著(P<0.05)高于其它碳源,由此确定葡萄糖为本组试验的最佳碳源。其原因可能是葡萄糖作为一种速效碳源,在发酵初期可以快速供给菌体营养物质,使菌体快速生长[29]。以柠檬酸为碳源的培养基,γ-PGA的产量非常低,这与前人研究相似[30]。可能是由于试验菌株缺乏顺乌头酸活性,致使α-酮戊二酸(α-Ketoglutaric acid,α-KG)合成受阻和柠檬酸的过度积累,导致细胞体内L-谷氨酸(γ-PGA合成前体)浓度下降,γ-PGA无法积累[31]。

图2 不同碳源对γ-PGA发酵产量的影响
2.2.2 不同氮源对发酵的影响 氮源对生物体的生长和目标物的积累有重要的影响,一方面是生物体酶、结构蛋白等的最重要来源;另一方面可以作为代谢的前体物质,直接参与次级代谢[32]。不同氮源对γ-PGA发酵产量影响的统计结果见图3。有机氮源方面,发酵后γ-PGA均产量顺序为:酵母浸粉>大豆蛋白胨>牛肉蛋白胨,三者统计结果并无显著差异。其中酵母浸粉营养成分为酵母来源,其营养结构与微生物较为相似,试验选取酵母浸粉作为有机氮源来源。无机氮源试验均产量顺序为:NH4NO3>(NH4)2SO4>NH4Cl>尿素。NH4NO3发酵后γ-PGA均产量显著(P<0.05)高于其它氮源,因此选取NH4NO3作为最适氮源。总体来看,使用有机氮源发酵后γ-PGA的平均产量高于无机氮源,其原因可能是有机氮源除了为菌体提供必要的氮元素之外,还提供很多必需的生长因子[33]。考虑到菌株发酵时间较长,试验选用有机氮源和无机氮源搭配以延长氮源供应时间,此外有研究表明有机氮源、无机碳源与碳源存在明显的交互作用[34]。
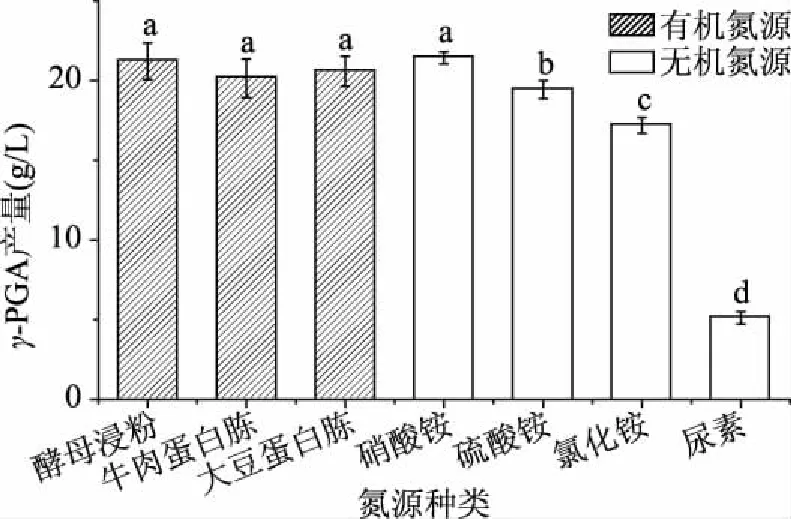
图3 不同氮源对γ-PGA发酵产量的影响
2.2.3 不同无机盐对发酵的影响 无机盐是生物体生长中不可或缺的营养物质,其主要作为生理活性物质的调节剂参与生物体生理活性的调控,对培养基的氧化还原电位、渗透压、酸碱度等影响很大[35]。不同无机盐对γ-PGA发酵产量影响的统计结果见图4。发酵后γ-PGA均产量顺序为:K2HPO4·3H2O>MgSO4·7H2O>MnSO4·H2O>Na2MoO4·3H2O>ZnCl2·7H2O。统计结果表明:添加K2HPO4·3H2O发酵后γ-PGA产量显著高于其它无机盐。研究表明Mg2+、Mn2+,Mo2+,等金属离子均有增产效果[24-26],因此后续研究中,考虑使用复合无机盐展开试验。
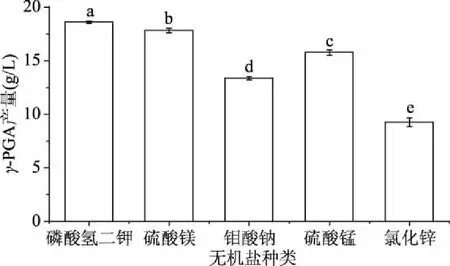
图4 不同无机盐对γ-PGA发酵产量的影响
2.3 Plackett-Burman试验
Plackett-Burman试验的试验设计及结果分析见表3和表4。T-检验结果表明,在显著水平α=0.05的情况下,因素A、B、D显著影响γ-PGA产量(P<0.05)。通过回归分析发现,A、B的回归系数大于0,D的回归系数小于0,表明A、B为正影响因素,D为负影响因素。因此,试验选取葡萄糖、谷氨酸钠、K2HPO4·3H2O进行最陡爬坡试验,考虑到经济因素,其余因子含量选取低水平。

表3 Plackett-Burman试验设计及结果
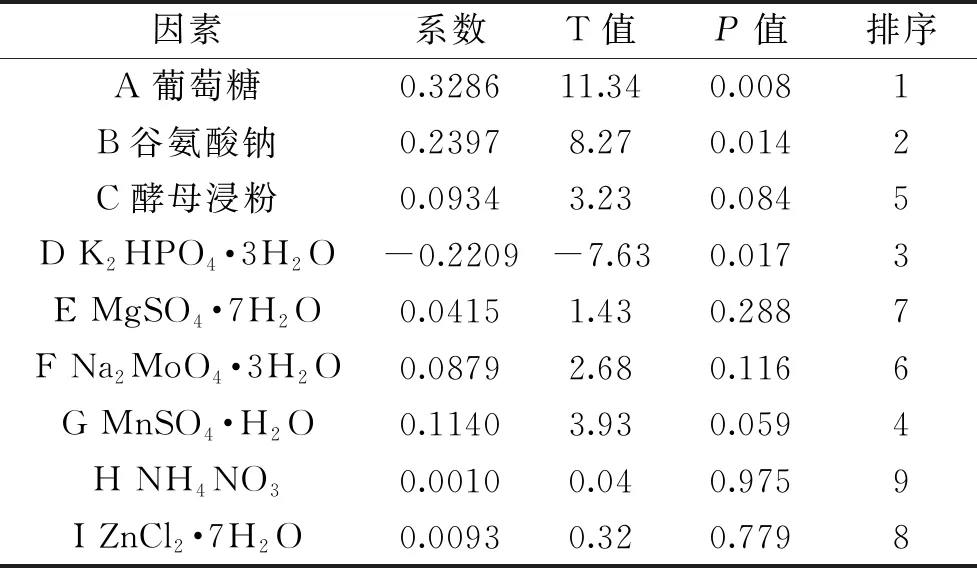
表4 PB试验设计和分析结果
2.4 最陡爬坡试验
由PB试验可知,葡萄糖和谷氨酸钠为正效应因素,K2HPO4·3H2O为负效应因素。试验依据上述因素的正负效应,设定爬坡方向与步长,试验设计及结果见表5。如表所示,第4试验组中γ-PGA产量达到最大值,因此将该组水平确定Box-Behnken试验的中心点。
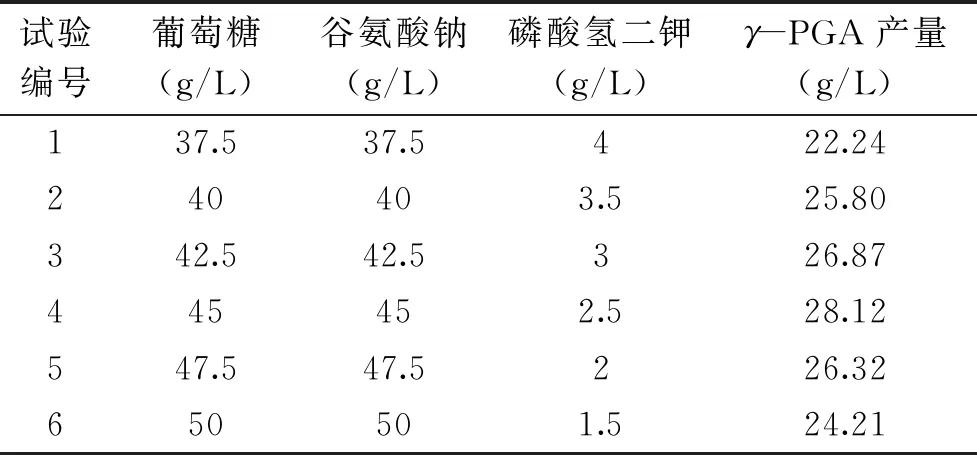
表5 最陡爬坡试验设计及结果
2.5 响应面设计与分析
以γ-PGA产量(Y)为响应值,采用Box-Behnken试验设计对PB试验筛选的3个显著影响因子和最陡爬坡试验得到的中心点作进一步的优化。Box-Behnken试验结果与方差分析结果显示见表6、表7。对表6结果进行多元二次回归,得到回归模型方程:

表6 Box-Behnken试验设计与结果(g/L)
Y=28.26-2.231A+0.089 B-0.887C-2.909A2-2.519B2-2.927 C2+0.075AB+0.843AC+0.903BC。
由表7可知:模型中A、B的线性项,A、B、C二次项、以及BC的交互项对γ-PGA产量有显著影响,模型失拟项P=0.129>0.05,说明二次多项回归失拟不明显,模型无需纳入更高次幂函数。决定系数为R2=98.27%,调整后的决定系数R2(调整)=95.16%,模型的P值为0.001,说明模型与试验数据拟合程度良好,拟合效果显著,可以用于γ-PGA生产的理论预测。
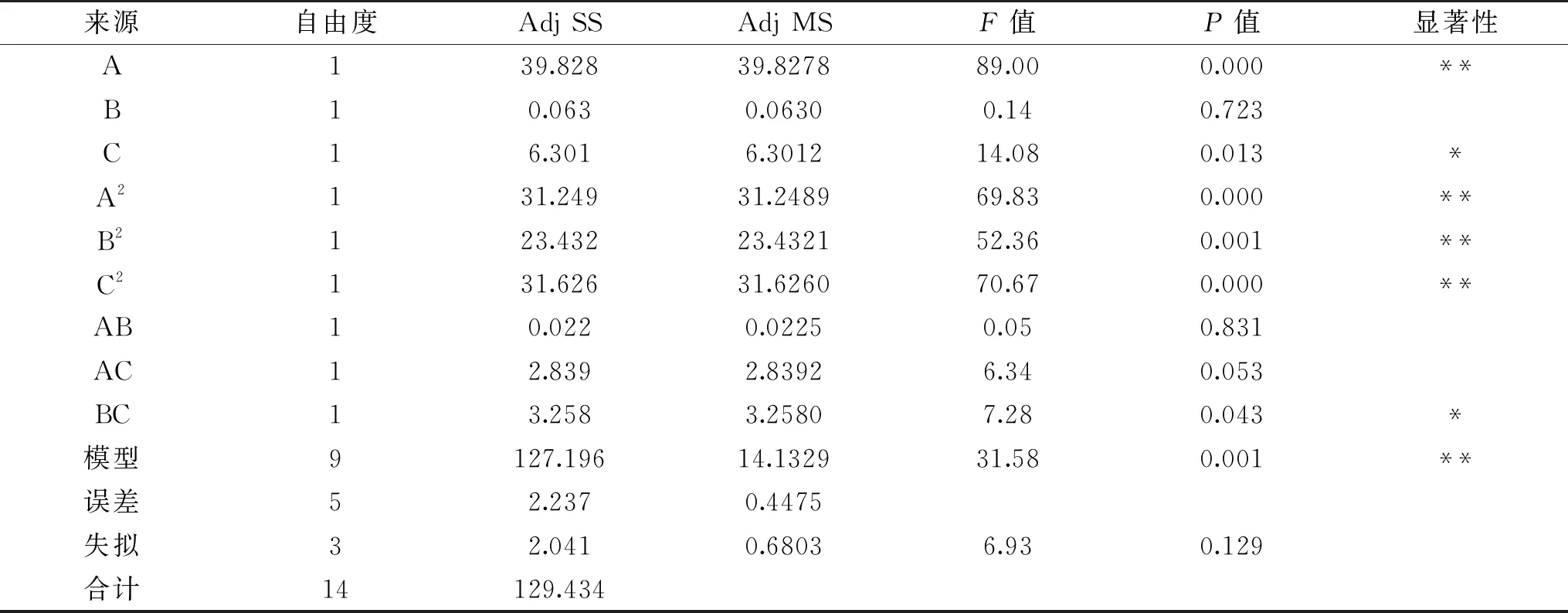
表7 Box-Behnken设计试验结果的方差分析
为了更直观的看出两两交互的作用对γ-PGA产量的影响,试验对回归方程进行了可视化分析:利用Minitab18软件绘制出等高线图和响应曲面图,结果见图5~图7。在等高线图中,等高线围成的区域长短轴之比越小(越接近圆形),说明因素之间的交互作用对响应值的影响越不显著;在响应曲面图中,响应曲面开口向下,呈闭合凸形,说明响应值存在极大值,反之存在极小值,若图形不闭合则不存在极值[22,36-37]。谷氨酸钠与K2HPO4·3H2O之间的交互作用见图7,分析可知:等高线呈椭圆形,响应面曲面的坡度陡峭,说明谷氨酸钠和K2HPO4·3H2O之间交互作用较强,γ-PGA产量对谷氨酸钠和K2HPO4·3H2O 的变化比较敏感,二者对γ-PGA产量的影响显著(P=0.043<0.05)。葡萄糖-谷氨酸钠的交互作用(图5)和葡萄糖-K2HPO4·3H2O的交互作用(图6)中,等高线近圆形,响应面坡度平缓,说明葡萄糖-谷氨酸钠、葡萄糖-K2HPO4·3H2O之间的交互较弱。葡萄糖-谷氨酸钠间的交互作用和葡萄糖-K2HPO4·3H2O间的交互作用小于谷氨酸钠-K2HPO4·3H2O之间的交互作用对γ-PGA产量的影响,三者两两交互均存在极值。
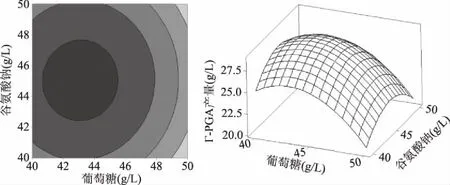
图5 葡萄糖和谷氨酸钠的交互作用对γ-PGA产量影响的等高线图和响应曲面

图6 葡萄糖和K2HPO4·3H2O的交互作用对γ-PGA产量影响的等高线图和响应曲面

图7 谷氨酸钠和K2HPO4·3H2O的交互作用对γ-PGA产量影响的等高线图和响应曲面
为取得最优解,试验对所得的回归拟合方程中的三个自变量(A、B、C)分别求一阶偏导,并令∂Y/∂A=0;∂Y/∂B=0;∂Y/∂C=0,取得极值。解得:葡萄糖=42.9293 g/L,谷氨酸钠=44.8485 g/L,K2HPO4·3H2O=2.39394 g/L。此时模型预测产量Y=28.8207 g/L。根据实际试验情况稍作调整,并进行三次平行试验,在葡萄糖=42.93 g/L,谷氨酸钠=44.85 g/L,K2HPO4·3H2O=2.39 g/L时,得到γ-PGA均产量为28.51 g/L,与预测值相差较小,说明此模型能很好的预测实验因素对γ-PGA产量的影响。
3 结论与讨论
本试验通过分子生物学方法对初始菌株进行了鉴定,确定了N-2菌株为枯草芽孢杆菌(BacillussubtilisN-2)。研究针对γ-PGA发酵产量低下等问题,通过单因素试验确定了该菌株最佳碳源为葡萄糖,酵母浸膏和NH4NO3分别为该菌株的最佳有机氮源和无机氮源;结合单因素试验结果,采用PB设计和BBD试验优化了发酵培养基的组分。最终,培养基优化后γ-PGA的发酵产量为28.51 g/L,比优化前提高了34.48%。
相比于正交试验等常用设计,响应面法可以通过有限的实验次数获得更加精确的经验模型,同时可以分析各因素的变化对响应值的影响。根据本研究结果:模型误差仅为1.1%,由此,采用响应面法对菌株培养基进行优化是优化培养基,提高γ-PGA产量的有效方式。
目前来看,国内外γ-PGA的液态发酵产量总体不高。最主要的原因在于:随着发酵液中γ-PGA浓度增加,发酵液粘度显著上升,氧气传质系数明显下降,细胞中能量代谢受阻,进而造成细胞生长异常。氧气传质问题现已成为液态发酵中γ-PGA产量提升的瓶颈。虽然目前有学者将血红蛋白转入γ-PGA生产菌株,取得了一定成效[38],但是提升的幅度依然不大;此外,发酵原料成本高、菌株产能低,也是γ-PGA商业化进程中的巨大障碍。因此,加强对γ-PGA合成调控的研究,结合合成生物学、系统生物学等,系统设计或改造γ-PGA合成的底盘生物,应该是今后研究的热点,这也是本课组今后研究的重要方向。
