超声波、紫外线、超声波联合紫外线对鲜切香菇多酚氧化酶与过氧化物酶的钝化及其机理研究
2020-10-23付秀丽丁德胜郑淇心
吴 咏,金 建,付秀丽,田 蕾,丁德胜,舒 畅,郑淇心
(西南科技大学生命与科学工程学院,四川绵阳 621010)
香菇是我国的传统食用菌,其营养丰富、味道鲜美,并具有一定的生理活性,深受人们的喜爱。随着城市化和生活节奏的加快,鲜切蔬菜逐渐成为蔬菜消费的新趋势。然而,褐变尤其是酶促褐变的发生会造成产品色泽差,严重影响消费者的感官接受度。多酚氧化酶(PPO)与过氧化物酶(POD)广泛存在于植物组织结构中。相关研究表明,PPO是引起鲜菇发生酶促褐变的主要酶,且褐变度与PPO活性正相关,其原因在于PPO能将鲜菇中的多酚类物质进行氧化聚合而引起褐色变化[1-2]。POD作为另一关键酶,它能催化过氧化物对酚类、黄酮类物质发生氧化作用,然后再进行脱水、聚合,从而导致组织的褐变[3]。因此,为保证鲜切产品的质量,必须从根本上控制褐变的发生,鲜切香菇钝酶的研究具有重要的经济意义。
近年来,物理加工技术在鲜切果蔬上的应用逐渐成为本领域的研究热点之一。辐照处理[4-6]、微波处理[7]、超声处理[8-10]、脉冲强光处理[11-12]均能抑制果蔬PPO与POD的活性,从而达到减轻褐变的目的。周磊等[13]发现超声处理双孢蘑菇60 min后,PPO活性仍高达81.8%;超声协同20 mmol/L苹果酸处理60 min后,PPO活性为12.6%。Cheng等[10]研究表明,在温度55~75 ℃范围内,与单独热处理相比,超声协同热钝化PPO酶活的D值(酶活降低90%所需的时间)降低了1.3~3倍。由此可见,超声波技术能够用于鲜切蔬菜酶活的钝化。然而,单独的超声波处理效果并不是太理想,需要寻求一种或几种处理进行联合处理,以达到更好的酶活抑制效果。目前的研究,大多都是将超声波与热处理、超声波与有机酸处理相结合,但是热或有机酸介质的引入,可能会导致营养素的损失加剧,产品安全性也可能会受到威胁。
超声波与紫外线在一定程度上既能杀灭物体表面的微生物,也能钝化酶活,其产品安全性相对较高,成本较低。相对其它热物理加工而言,这两种处理方式在短时间内不会引起温度的大幅度升高。因此,本文对比研究了单一紫外线、单一超声波、超声波联合紫外处理对引起鲜切香菇发生褐变的两种主要酶(PPO、POD)的钝化效果,并初步探讨了作用机理,以期为鲜切果蔬的前处理提供理论依据。
1 材料与方法
1.1 材料与仪器
当日采摘的新鲜香菇(LentinusedodesBerk. sing) 购自绵阳青义福润万家超市;KBr(光谱纯) 国药集团化学试剂有限公司;邻苯二酚、愈创木酚、没食子酸等 均为国产分析纯。
KH-300SP型双频数控超声波清洗器 昆山禾创超声仪器有限公司;SWCJ-1F超净工作台 苏州安泰空气技术有限公司;5805 R台式冷冻离心机 德国艾本德公司;UV-1800PC紫外可见分光光度计 翱艺仪器(上海)有限公司;Freezezone 12 L冻干机 美国LABCONCO实验设备公司;U-3900H紫外分光光度计 日本HITACHT公司;X’Pert Pro X-射线衍射仪 荷兰帕纳科公司;Spectrum One傅里叶变换红外光谱仪 美国PE仪器公司。
1.2 实验方法
1.2.1 样品处理 挑选大小均匀、结构完整的香菇,洗净并沥干水分,切成厚度约2 mm薄片,封口包装,然后进行紫外线、超声波以及紫外线联合超声波处理。紫外线处理:将上述样品置于紫外超净工作台(有效波长254 nm),根据前期单因素试验结果,设置紫外线处理剂量为1.8 kJ/m2(紫外强度2 W/m2、处理时间15 min);超声波处理:将准备好的样品置于双频超声清洗器中,根据前期单因素实验和正交试验结果,设定双频顺序工作模式为20与40 kHz交替工作100 s、超声温度20 ℃、超声功率密度70 W/L、超声时间15 min;紫外联合超声波处理:双频顺序工作模式为20 kHz超声波与40 kHz超声波交替工作100 s,超声处理参数为温度15 ℃、超声功率密度70 W/L、超声时间15 min,超声处理结束后,立即进行紫外线处理,剂量为1.8 kJ/m2(紫外强度2 W/m2、处理时间15 min)。所有样品处理结束后立即测定PPO与POD酶活、褐变度与多酚含量,每个样品重复三次处理,每个处理平行测定三次,对照组不作任何处理。
1.2.2 多酚氧化酶(PPO)的提取及酶活测定
1.2.2.1 PPO粗酶液的提取 取1.0 g香菇样品,加入预冷的pH7.0磷酸盐缓冲液3.0 mL,在冰浴条件下研磨匀浆并转移到离心管中,再用7.0 mL磷酸盐缓冲液冲洗研钵,合并提取液,4 ℃下5000 r/min离心10 min,上清液即为PPO粗提液,收集并于4 ℃冰箱保存待用。
1.2.2.2 PPO粗酶液的活性测定 PPO活性的测定采用比色法[14],将0.5 mL邻苯二酚加入到2.0 mL磷酸盐缓冲液(pH7.0)中,然后加入0.5 mL酶提取液,立即于波长410 nm下测定吸光值,2 min后再次测定吸光值,以不加酶提取液的反应液作为空白对照,1个酶活单位定义为每1 min吸光度变化0.01。PPO酶活计算公式如下:

式(1)
式中:ΔA410为反应时间内吸光值的变化,比色波长410 nm;V为提取酶液总体积,mL;Δt为酶促反应时间,min;W为样品鲜重,g;Vt为测定时所用酶液体积,mL。
最终结果以PPO相对酶活表示:
式(2)
式中:APPO处理组为经超声、紫外、或超声联合紫外处理后的PPO酶活;APPO未处理为对照组(未经处理)的PPO酶活。
1.2.3 过氧化物酶(POD)的提取及酶活测定
1.2.3.1 POD粗酶液的提取 POD的提取参照李合生的方法[15],并略作改动。称取1.0 g香菇样品,置于研钵中,加入预冷的0.1 moL/L磷酸盐缓冲液(pH6.0)2.0 mL,在冰浴条件下进行研磨提取并转移至离心管中,再用7.0 mL磷酸缓冲液冲洗研钵,合并提取液,4 ℃下4000 r/min离心10 min,上清液即为POD粗提液,收集并于4 ℃保存待用。
1.2.3.2 POD粗酶液的活性测定 取一只试管,加入0.1 moL/L磷酸盐缓冲液(pH6.0)2.0 mL、酶液1.0 mL、0.05 mol/L愈创木酚1.0 mL,混匀,再加入1.0 mL 2% H2O2并立即计时,再次混匀并迅速倒入比色皿中,于470 nm波长下进行比色,从第20 s开始记录初始值,随后每隔30 s记录一次,每组共记录4个数据。空白对照用缓冲液代替酶液,1个酶活单位定义为每1 min吸光度变化0.01。POD酶活计算公式如下:
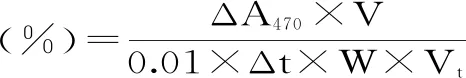
式(3)
式中:ΔA470为反应时间内吸光值的变化,比色波长470 nm;V为提取酶液总体积,mL;Δt为酶促反应时间,s;W为样品鲜重,g;Vt为测定时所用酶液体积,mL。
最终结果以POD相对酶活表示:
式(4)
式中:APOD处理组为经超声波、紫外线、或超声联合紫外处理后的POD酶活;APOD未处理为对照组(未经处理)的POD酶活。
1.2.4 褐变度(BI)的测定 褐变度(BI)的测定采用韩春然等[14]的方法,并稍作修改,称取1.0 g香菇切片于研钵中,加入5.0 mL蒸馏水并研磨1 min后,转移至15 mL离心管中,用蒸馏水冲洗研钵2次,合并,以5000 r/min离心10 min,定容至25 mL,在波长为410 nm处测定其吸光度值,结果以相对褐变表示:

式(5)
式中:A410处理组为经超声、紫外、或超声联合紫外处理后的香菇研磨液在波长410 nm处的吸光度;A410对照组为对照组的香菇研磨液在波长410 nm处的吸光度。
1.2.5 总多酚含量的测定 总多酚的测定采用Gao等[16]的方法,并稍作修改,称取1.0 g香菇切片于研钵中,加入5.0 mL蒸馏水并研磨1 min后,转移至15 mL离心管中,用蒸馏水冲洗研钵2次,合并,5 000 r/min离心10 min。移取1.0 mL上清液,加入1.0 mL福林酚试剂,漩涡振荡10 s,加入7% Na2CO3溶液10 mL,振荡10 s,用去离子水定容至25 mL,暗处静置1 h后在75 0 nm处测吸光值,以没食子酸作标准曲线并计算总酚含量。结果以多酚相对含量表示:
式(6)
式中:C处理组为经超声、紫外、或超声联合紫外处理后的香菇中多酚含量;C对照组为对照组的香菇中多酚含量。
1.2.6 紫外-可见光谱扫描 将按照方法1.2.2.1和1.2.3.1提取的PPO和POD进行冻干,然后分别溶于0.01 mol/L磷酸盐缓冲液(pH7.0),配成浓度为1.0 mg/mL的酶溶液,在25 ℃的环境温度下,采用紫外分光光度计在波长为190~400 nm的范围内进行紫外-可见光谱扫描,扫描条件为:石英皿池长1.0 cm,扫描速度为60 nm/min,步长2.0 nm。0.01 mol/L磷酸盐缓冲液(pH7.0)的光谱为空白光谱,酶溶液的光谱与空白光谱的差谱,即为酶的紫外光谱。
1.2.7 红外光谱扫描 将按照方法1.2.2.1和1.2.3.1提取的PPO和POD进行冻干,然后分别称取20 mg于玛瑙研钵中,加入150 mg KBr并磨成细粉,压片,在波数4000~400 cm-1范围、分辨率在2 cm-1的条件下扫描64次,并用KBr作为空白对照。数据经Omnic软件转换后,采用Peakfit对酰胺Ⅰ带(1700~1600 cm-1)进行解卷积和分峰拟合,并对各归属峰进行二级结构指认。
1.2.8 X衍射光谱测定 将按照方法1.2.2.1和1.2.3.1提取的PPO和POD进行冻干,然后分别在玻璃样品槽中压平,X衍射扫描测定参数:管压40 kV,Cu K射线(λ1=1.5406 Å,λ2=1.5444 Å,)扫描速度为2 °/min,扫描范围2θ为3 °~80 °。
1.3 数据处理
每个试验点重复3次,结果以平均值±标准差(Mean±SD)的形式表示。数据显著性(P<0.05)分析采用SPSS 21.0,图形的绘制采用Origin 8.5。
2 结果与分析
2.1 不同处理方式对鲜切香菇PPO与POD的酶活影响
超声波、紫外线和超声波联合紫外线对鲜切香菇PPO与POD酶活、相对褐变度以及多酚相对含量的影响如图1所示:
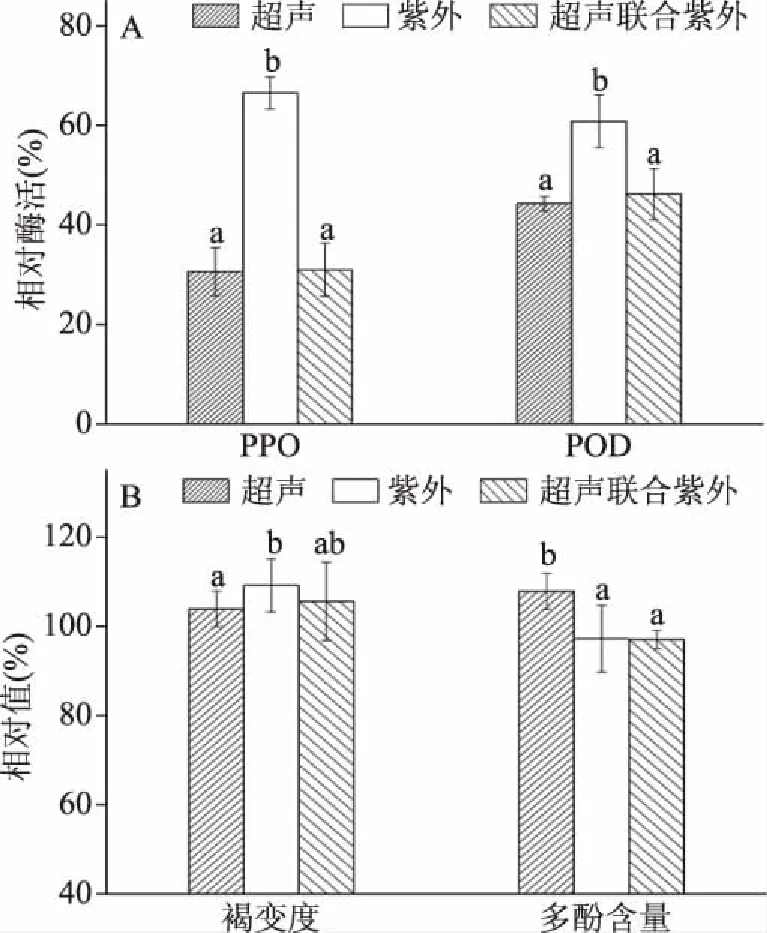
图1 超声波、紫外线和超声波联合紫外线对鲜切香菇PPO酶活、POD酶活、褐变度和多酚含量的影响
如图1A所示:超声波、紫外线、超声波联合紫外线处理均能钝化鲜切香菇中的PPO与POD,其中单一超声处理或超声联合紫外线处理对两种酶的钝化效果最佳,两种处理无显著性差异(P>0.05),单一紫外线对酶活的钝化效果较差。经超声波、紫外线、超声联合紫外线处理后,PPO相对酶活分别为30.6%、66.5%和31.0%,POD的相对酶活为44.3%、60.8%和46.2%。相比而言,PPO对紫外线或超声波的敏感性较POD强。超声波能够钝化酶活的原因在于香菇中的自由水在超声波的空化作用下产生自由基,迫使蛋白质分子空间构象发生改变,从而发生酶活的变化[8]。酶的本质是蛋白质或者RNA,紫外线中的短波部分(波长100~280 nm)能够使蛋白质分子失去生理活性或碱基突变,从而导致酶的失活[17]。
经超声波、紫外线、超声波联合紫外线处理后,鲜切香菇都发生了不同程度的褐变(图1B),其中单一紫外处理较其它两种方式,相对褐变度更高,可能原因在于紫外照射后,香菇表面发生脱水,从而使得颜色加深。吴本刚[18]对胡萝卜干燥的研究表明,胡萝卜片表面颜色变化是由表层脱水干燥引起。超声处理过程中产生的自由基可能将酚类物质氧化成醌类,从而加深颜色。张清安等[19]研究发现,黑米酒经超声处理后,其颜色特性增加,而酚类物质含量与抗氧化活性下降。然而,超声处理后,总多酚相对含量较高(图1B),其根本原因在于,超声能破坏细胞的结构组织[20],从而有利于多酚的溢出。单一紫外线处理、超声联合紫外处理,其相对多酚含量无显著性差异(P>0.05),其原因可能在于:紫外处理后,细胞内多酚仍以结合态[21]形式存在;而超声联合紫外处理过程中,超声可能破坏了香菇的表面结构,溢出的多酚在紫外线产生的活性氧的作用下发生了多酚氧化[22]。
2.2 PPO与POD的紫外-可见光谱分析
蛋白质的紫外吸收光谱与它的芳香族氨基酸——色氨酸、酪氨酸和苯丙氨酸密切相关,它可以用来表征蛋白结构的完整性,其中波长250~300 nm区域能够提供蛋白质分子在溶液中的构象变化信息[23]。超声波、紫外线和超声波联合紫外线对鲜切香菇PPO与POD的紫外光谱影响如图2所示。

图2 超声波、紫外线和超声波联合紫外线对PPO与POD紫外光谱的影响
蛋白分子展开时,表面的生色团含量增加,从而引起紫外吸收强度增加[23]。PPO是一种酪氨酸酶,以无活性的前体形式存在。前体一般由富含羟基亲水性氨基酸的N-端导肽、富含His残基的中间高度保守的Cu结合区和疏水性C-端三部分组成,其中Cu结合区是该酶的主要功能区,其它部分则对酶的构象、高级结构的形成和维持起作用[24]。从图2中可以看出,经超声波、紫外线或超声联合紫外处理后,相同浓度下的酶分子的紫外吸光度增加,表明不同的处理暴露出了埋藏在C端的疏水性基团,导致酶的活性发生变化。
2.3 PPO与POD的红外光谱及二级结构含量
傅里叶变换红外光谱属于分子振动光谱,可用来分析多肽和蛋白质的二级结构含量,并且不受样品所处物理状态的影响[25]。不同处理对鲜切香菇PPO与POD的红外光谱的影响如图3所示:
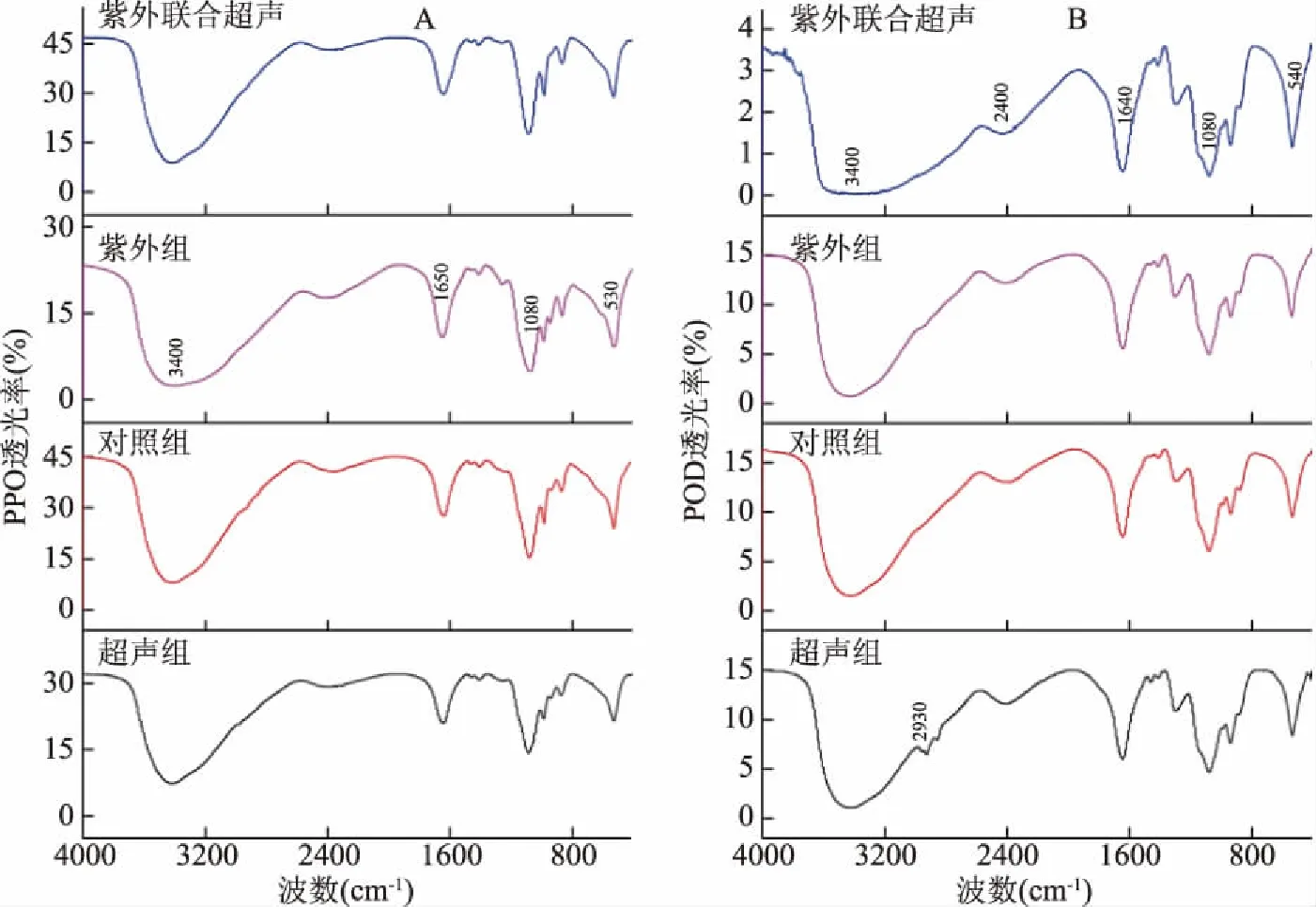
图3 超声波、紫外线和超声波联合紫外线对PPO与POD红外光谱的影响
从图3中可以看出,与对照组相比,经超声处理的香菇,其POD在2930 cm-1处出现弱吸收峰,经紫外处理的PPO,尤其是经超声联合紫外处理的POD在3400 cm-1处的吸收峰展宽,其原因可能在于分子中氨基酸残基上的羟基之间的氢键作用力增强[26],这也在一定程度上反应了疏水基团的暴露,促使分子趋于最低能级状态。采用解卷积技术,利用PeakFit软件对酰胺Ⅰ带(1700~1600 cm-1)进行分峰、拟合,根据参考文献[25,27-28]对各子峰归属进行二级结构指认、合并,其结果如表1:
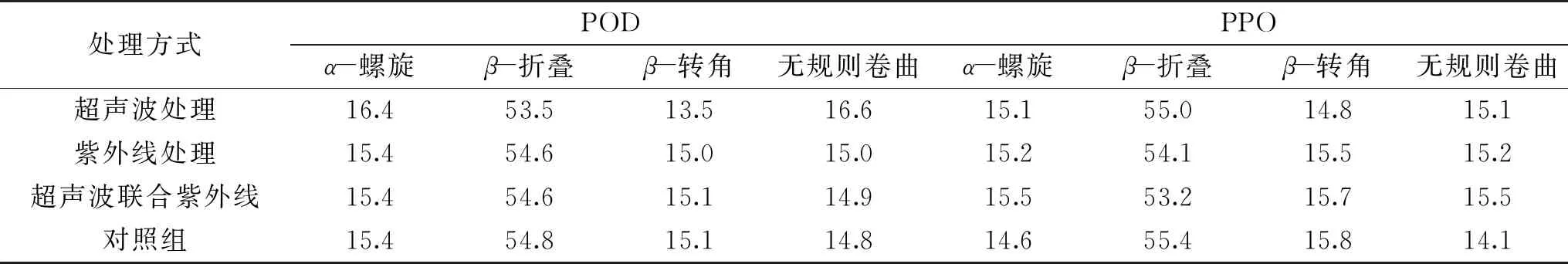
表1 不同处理条件下PPO与POD的二级结构含量(%)
由表1可知,经紫外线或超声联合紫外处理,鲜切香菇中的POD的各二级结构含量变化不大。经单一超声波处理后,POD中的α-螺旋和无规则卷曲含量明显上升,分别增加了6.49%和12.16%,β-折叠和β-转角含量分别减少了2.4%和10.60%;PPO中的α-螺旋和无规则卷曲含量分别增加了3.42%和6.94%,β-转角下降6.33%。经单一紫外线处理后,PPO中的α-螺旋和无规则卷曲含量分别增加了4.11%和7.80%,β-折叠含量降了2.35%。超声波联合紫外线处理后,PPO中的α-螺旋和无规则卷曲含量分别增加了5.81%和9.93%,β-折叠含量减少了3.97%。综上可知,POD与PPO失活的根本原因在于α-螺旋、无规则卷曲含量的上升和β-折叠含量的减少。刘野等[29]采用高压CO2(30 MPa,60 min)处理PPO的结果也表明,PPO失活后,其α-螺旋和β-转角含量升高,β-折叠含量降低。Subhedar等[30]采用超声激活纤维素酶时,发现α-螺旋含量降低了12.38%、β-转角含量上升了9.17%,酶的均一性和弹性减弱。然而,这与Yu等[31]研究发现刚好相反,可能在于研究的对象与作用方式的差异。
2.4 X衍射光谱分析
X衍射光谱能够提供蛋白质的完整三维构象信息[32]。不同处理对鲜切香菇PPO与POD的XRD光谱的影响如图4A、4B所示:

图4 超声波、紫外线和超声波联合紫外线对PPO与POD的XRD光谱的影响
如图4所示:无论是PPO还是POD,经超声处理后,其衍射峰的位置与对照组保持一致,表明超声波处理后的PPO和POD三维构象可能保持不变,但峰强度发生了明显的变化。紫外线处理后的PPO在2θ为10.5 °、16.7 °、19.0 °、26.5 °、27.2 °和39.8 °处出现了衍射峰,紫外线处理后的POD在2θ为24.2 °、25.5 °处的衍射峰消失或者强度明显减弱,表明了紫外线处理后,PPO与POD的三维构象可能发生了改变。超声波联合紫外线处理后的PPO在2θ为20.8 °和29.4 °处分别出现了一个极强和中等强度的衍射峰,其余峰的位置基本与单独紫外处理和单独超声处理保持一致。超声波联合紫外线处理后的POD在2θ为26.5°处极强的衍射峰,其余峰发生了消失。因此,可以推断三维构象发生改变是酶活性变化的根本原因。Chen等[32]发现某些位置的衍射峰的消失或强度发生变化可以反映出蛋白质二级结构及其含量的变化。
3 结论
超声波、紫外线、超声波联合紫外线处理均能钝化鲜切香菇中PPO与POD的酶活,其中以超声波或超声波联合紫外线处理的效果较佳。在超声功率密度70 W/L、双频超声20 kHz与40 kHz顺序工作15 min后,PPO和POD相对酶活分别为30.6%和44.3%;紫外剂量为1.8 kJ/m2处理后,PPO和POD相对酶活分别为66.5%和60.8%;超声联合紫外处理后,PPO和POD相对酶活分别为31.0%和46.2%。紫外光谱、红外光谱以及X衍射光谱表明:酶活发生改变的原因在于酶分子疏水性基团的暴露,α-螺旋、无规则卷曲含量的上升和β-折叠含量的减少,酶分子三维空间构象以及衍射峰强弱的变化。本研究仅考查了三种处理方式对引起褐变发生的主要酶的活性影响,后续尚需研究不同处理对鲜切香菇微生物含量与营养品质、包装方式与储藏过程中的生理特性变化以及货架期等一系列问题。
