无溶剂高效合成1,4-二取代-1,2,3-三唑类衍生物
2020-10-23卢俊瑞谢志强刘金彪
万 乐,卢俊瑞,谢志强,刘金彪
(1.天津理工大学化学化工学院,天津300384;2.天津瑞岭化工有限公司,天津300384)
在传统有机合成化学中,虽然添加溶剂使反应系统达到了均一稳定的状态,但大多数有机溶剂有毒有害,不可避免地对环境造成了损害和负担,因此在有机合成中,追寻清洁高效的合成方法已成为当前社会各界化学家们努力钻研的方向,也成为了杂环领域合成中的一项重大挑战,在化学反应中,使用环境友好型溶剂甚至排除溶剂是当前绿色化学的主要标准之一[1-2].
1,2,3-三唑类化合物是一类重要的含氮杂环化合物,在生物科学、药物化学和材料科学等领域均有着广泛的应用[3-6].另外,由于1,2,3-三唑药动学和安全性良好,并且在体内条件下刚性和稳定性强,从而促使它成为了药物发展的最优选择之一[7-8].目前,含三唑环的一些化合物已经在临床上有了广泛的应用,在抗菌、抗病毒、消炎镇痛、抗过敏、抗惊厥等方面均具有显著疗效[9-12],还有一些具有这种结构的衍生物被发现能够抑制肿瘤的增殖、侵袭和转移,具有抗HIV活性[13].
铜催化叠氮化物-炔烃环加成(CuAAC)反应是Click反应的主要例子,在该反应中铜(I)离子催化具有决定性作用,它不仅提高了反应速率和产率,并使叠氮-炔环加成反应完全向1,4-取代区域异构体方向发展,解决了1,4和1,5-取代异构体的选择性问题,该反应被称之为“一套近乎完美的”反应,可高效选择性生成1,4-二取代的1,2,3-三氮唑类化合物[14-15].
由于1,2,3-三唑类化合物在药物发现中的重要作用,其新的合成方法的发展持续受到热切关注.在此基础上,本文在无溶剂下,经Click反应成功合成了一系列1,4-二取代-1,2,3-三唑,避免了溶剂对环境的污染以及资源的浪费,且操作简便,底物适用性良好.
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪,北京科仪电光仪器公司,温度计未经校正.德国Bruker 400 MHz型核磁共振波谱(NMR)仪,德国Bruker公司,CDCl3-d1和DMSO-d6为溶剂,TMS为内标,1H NMR磁场频率为400 MHz,13C NMR磁场频率为100 MHz.Waters Xevo-G2 QTOf型高分辨质谱(HRMS)仪、Waters Acquity I Class超高效液相色谱(UPLC)仪、Waters超高液相色谱高分辨质谱联用(UPLC-HRMS)仪;层析薄板,天津市江天统一科技有限公司.
苯乙炔、1-庚炔、4-乙炔基甲苯、対氟苯乙炔、间氟苯乙炔、邻氟苯乙炔、対氯苯乙炔、対溴苯乙炔、対硝基苯乙炔、4-乙炔基苯腈、4-乙炔-α,α,α-三氟甲苯、4-乙炔基苯甲酸、4-乙炔基苯甲醛、4-乙炔基苯胺、対甲氧基苯乙炔、三甲基硅基乙炔、3-乙炔基吡啶、3-乙炔基噻吩、4-乙炔基联苯、苄基叠氮,分析纯,天津希恩思生化科技有限公司.
1.2 实验过程
以各种不同基团取代的苯乙炔和叠氮化物(叠氮乙酸乙酯或苄基叠氮)为原料,以一价铜盐作催化剂.取25 mL单口瓶,加入等物质的量(2 mmol)的反应物料和适量的催化剂,在一定温度下反应,用薄层色谱(TLC)监测反应进程,直至反应完全,然后用少量二氯甲烷溶解,过滤除掉催化剂,将滤液减压蒸馏可得粗产品,再用适量石油醚/二氯甲烷体系重结晶即得纯物质.
2 结果与讨论
2.1 反应条件优化
将苯乙炔和叠氮乙酸乙酯作为模型反应(图1)的底物,以一价铜盐作催化剂,由TLC监测可知,无溶剂时该反应在室温(r.t.)下便可发生转化,当反应完全后,取样分析检测,经1H NMR分析确定是想要的目标产物,说明该方案的可行性.

图1 无溶剂合成1,4-二取代-1,2,3-三氮唑(3a)Fig.1 Solvent-free synthesis of 1,4-disubstituted-1,2,3-triazole(3a)
故在此基础上,展开了一系列探索,其中包括对催化剂的筛选以及与溶剂效应的对比,并做了底物拓展.
2.1.1 催化剂的筛选
在催化剂方面,选择了常见的卤化亚铜和抗血酸钠还原下的CuSO4·5H2O,对他们的催化效果进行比较,如表1所示.
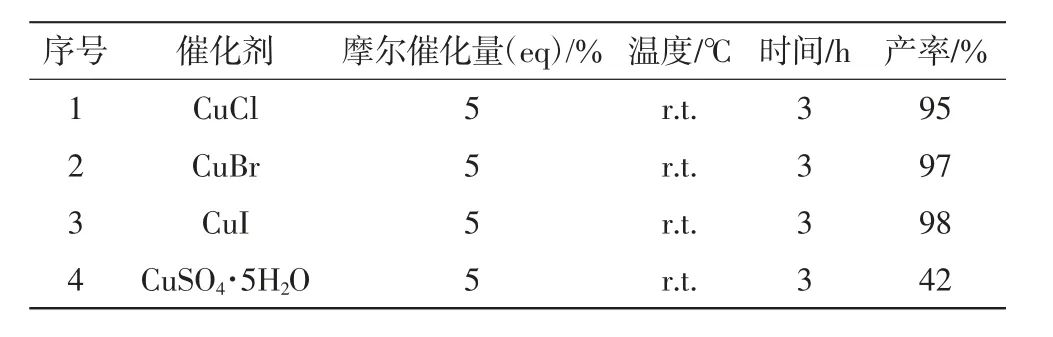
表1 不同催化剂的催化效果Tab.1 Effect of different catalysts
从表中数据可知,不同卤化亚铜的催化效果差别不大,都能以较高的收率获得终产物,而CuSO4·5H2O在抗血酸钠还原下的催化效果并不是很理想,这主要是由于该催化剂在无溶剂反应体系中分散不均匀,抗坏血酸钠没办法充分还原二价铜离子而达到真正的催化效果所致.因此,最终选择了廉价易得且较为稳定的CuI作为该反应体系的催化剂.
2.1.2 溶剂效应
从模型反应出发,加入等摩尔量的反应物料,以5%摩尔当量的CuI作为催化剂,选择了常用溶剂甲醇、四氢呋喃(THF)、二甲基亚砜(DMSO)、二氯甲烷(DCM)、乙腈和N,N-二甲基甲酰胺(DMF)作为反应溶剂,室温下反应3 h,探究了不同溶剂(10 mL)下的反应效果,结果如表2所示.
从表中可清楚地看出,该反应在大多数溶剂中均可发生,虽然在二氯甲烷和二甲基亚砜作溶剂时,反应效果较好,收率接近100%,但无溶剂条件下的反应收率也达到了98%,结合环境发展趋势综合考虑,无溶剂合成是当下最优的选择.

表2 溶剂效应Tab.2 Solvent effect
2.2 底物普适性拓展及讨论
在上述最佳反应条件下,设计了一系列具有不同电子效应和空间效应的底物(图2),使用该方法在合适的温度下进行反应,由于不同物料的物性差别较大,所以反应温度也不尽相同,会做相应的调整,实验结果如表3所示.

图2 无溶剂合成1,4-二取代-1,2,3-三唑Fig.2 Solvent-free synthesis of 1,4-disubstituted-1,2,3-triazole
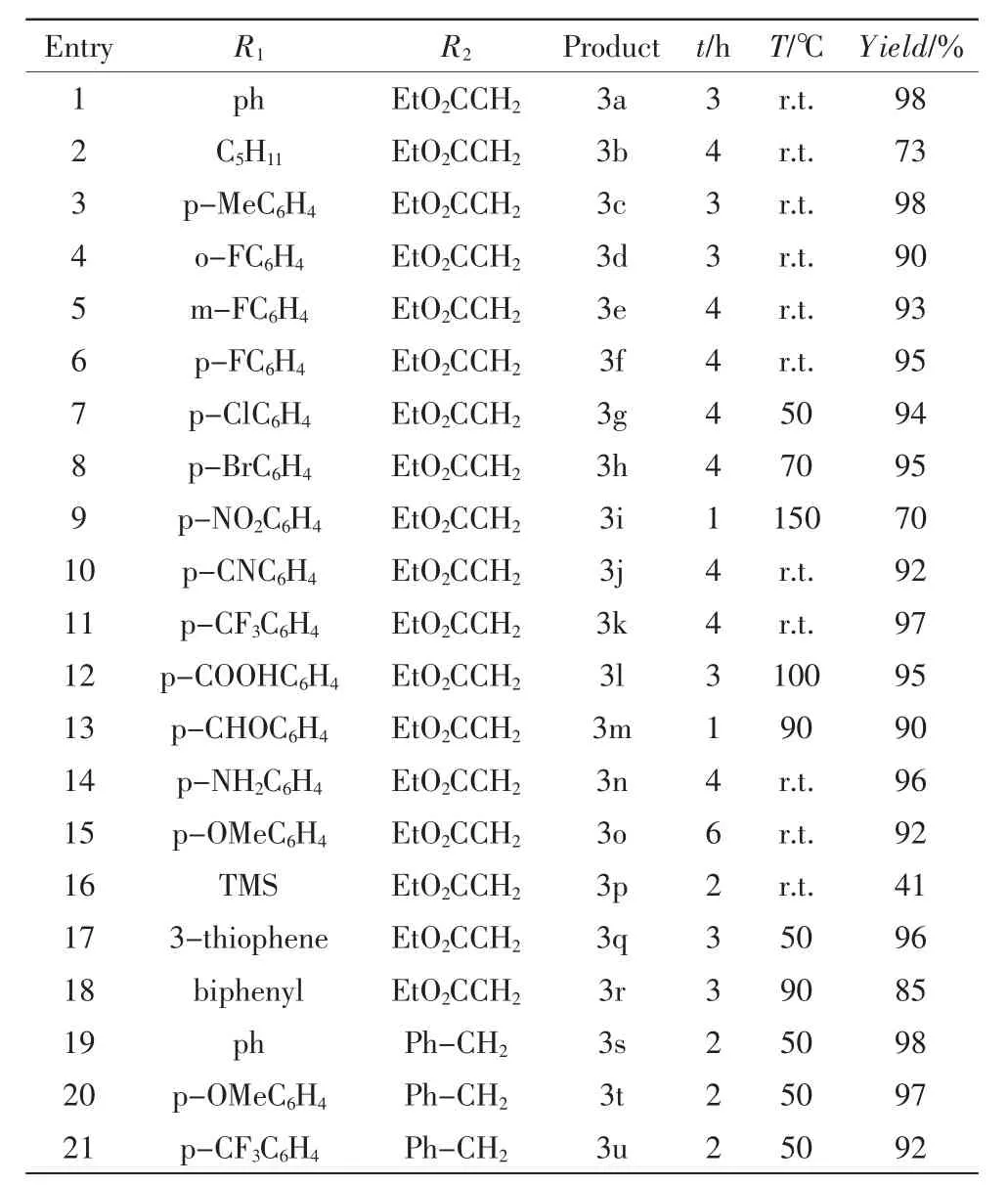
表3 底物拓展Tab.3 Substrate development
从上表可以看出,在所涉及的底物中大多数反应效果较为良好,收率绝大多数在90%以上.将其展开来说,在反应过程中,为了考察空间效应对反应结果的影响,设计了分别在邻、间、对位取代的氟基苯乙炔(Tab.3 entries 4-6),结果表明,反应均能平稳进行,产率也并无较大差异,可见,单取代时的空间效应在该方法下对反应效果影响并不是很大.同样地,不同卤素取代(Tab.3,entries 6-8)时,反应仍能顺利进行,且反应效果优良.对于具有不同电子效应的苯乙炔而言,吸电子基(Tab.3,entries 10-13)和给电子基(Tab.3,entries 14、15)并未带来不理想的反应结果,收率均较高,且其中涉及氨基、羧基、醛基等各种官能团,说明该方案官能团容忍性强.此外,还探究了杂环取代的反应效果,如3-噻吩和联苯(Tab.3,entries 17、18),依旧取得了令人满意的结果.但也有少数底物(Tab.3,entries 2、9、16)反应效果不是很理想,其中直链炔烃和对硝基苯乙炔与叠氮乙酸乙酯的反应产物(Tab.3,entries 2、9)收率仅在70%左右,从实验中TLC监测来看,反应中有副产物生成,并非单一的产物点,故收率较低;而TMS(三甲基硅基乙炔)(Tab.3,entries16)则是由于位阻较大导致的反应效果较差.但综合来看,在无溶剂的条件下,该法具有广泛的底物范围,如各种卤代苯基、吸电子基、给电子基和杂环等.另外,为了进一步验证不同叠氮化物的适用性,选择苄基叠氮代替叠氮乙酸乙酯和不同电子效应的取代苯乙炔(Tab.2.3,entries 19-21)反应,发现依然能够很好地得到目标化合物.
2.3 目标化合物的表征
在结构上,通过该法所得目标化合物3a-3u经1H NMR、13C NMR及质谱(HRMS)综合确定,其表征数据如表4所示.
3 结论
本文开发出了一种无溶剂下,铜催化叠氮化物-炔烃环加成(CuAAC)反应的绿色便捷高效的合成方法,并运用此方法成功合成了一系列1,4-二取代-1,2,3-三氮唑类化合物.与合成该类化合物的传统方法相比较,该方法主要具有以下突出优点:1)反应不需添加任何溶剂,绿色友好,并且减少了资源浪费和三废的生成;2)原子利用率很高,容易分离纯化;3)实验操作简便,反应条件温和,且后处理简单,仅需简单的重结晶即可,避免了繁杂的柱层析分离工作,节省了大量的人力和物力,时间成本也随之降低.
从长远意义来看,该法对开发含三唑环的药物合成研究具有一定的可行性和实用价值.

表4 目标化合物的状态、熔点、质谱及1H NMR和13C NMRTab.4 Appearence,m.p.,HRMS(ESI-MS),1H NMR and 13C NMR data of target compounds 3a-3u

续表4目标化合物的状态、熔点、质谱及1H NMR和13C NMRTab.4 Appearence,m.p.,HRMS(ESI-MS),1H NMR and 13C NMR data of target compounds 3a-3u
