尿液细胞外囊泡的单颗粒水平多参数定量表征
2020-10-22刘海生袁文理陈永钰颜晓梅
刘海生 袁文理 陈永钰 陈 晨 田 野 颜晓梅
(厦门大学化学化工学院化学生物学系, 谱学分析与仪器教育部重点实验室, 化学生物学福建省重点实验室, 厦门 361005)
1 引 言
细胞外囊泡(Extracellular vesicles, EVs)是由细胞分泌到细胞外基质中的纳米尺度 (30~1000 nm)、具有磷脂双层膜结构的小囊泡[1]。根据分泌机制的不同,EVs主要包括由多泡小体与细胞膜融合释放的外泌体(Exosomes, 30~150 nm)和从细胞膜出芽脱落的微囊泡(Microvesicles, 100~1000 nm)[2]。EVs携载有亲本细胞来源的蛋白质、脂质、核酸和其它生物分子,参与细胞间通讯、抗原呈递、血管新生、肿瘤侵袭等生理病理过程,在疾病诊断、预后和治疗中显示出巨大的应用前景[3]。EVs广泛存在于人类各种体液和排泄物中,如血液、唾液、汗液、眼泪、粪便和尿液等[4],其中,尿液样本因具有简单易得、非侵入性采样和标本量大等特点备受关注。2002年,Thongboonkerd等[5]通过对尿液超速离心后的沉淀物进行蛋白质组学分析,发现沉淀物中含有大量膜蛋白,为尿液中存在具有膜结构的EVs提供了实验证据。2004年,Pisitkun等[6]通过超速离心,首次提纯了uEVs,并且通过蛋白质组学发现uEVs携载的很多蛋白与人类疾病密切相关。近几年,uEVs携载的分子标志物已被用于多种泌尿系统疾病(如急性肾损伤、前列腺癌和膀胱癌等)的诊断与治疗监控[7~13]。尽管uEVs的生物学功能及临床应用价值不断地被发掘,但由于uEVs自身具有高度的个体差异性和多样性,同时缺乏相应的单颗粒表征技术,研究者对于uEVs自身组成、结构和功能的了解较少,这严重阻碍了uEVs研究的进一步深入[14]。
透射电子显微镜、扫描电子显微镜和原子力显微镜等显微技术被广泛应用于EVs物理性状(如粒径、浓度和形态等)的表征,但这些技术存在样品制备繁琐、测量速度慢、粒径分布缺乏统计代表性等缺点[15]。动态光散射技术(Dynamic light scattering, DLS)、纳米颗粒跟踪分析技术(Nanoparticle tracking analysis, NTA)、可调电阻脉冲传感技术(Tunable resistance pulse sensing, TRPS)和流式细胞术(Flow cytometry, FCM)等,常被用于EVs粒径和浓度的快速测定。采用DLS测量EVs时,测量的散射强度由颗粒尺寸加权所得,与粒径的六次方成正比,因此,少量的大粒径杂质颗粒或囊泡会湮没小粒径EVs的信号,使得小颗粒信号失真,不适于EVs等高度异质性颗粒样本的表征[16]。与DLS不同,NTA是对单个纳米颗粒的散射光强进行测量,采用激光照射纳米颗粒悬浮液,通过高速相机对视野中的颗粒进行拍照,从而对每个颗粒的散射光点进行跟踪记录,以获得纳米颗粒布朗运动的轨迹,进而计算出单位时间间隔内每个纳米颗粒的均方位移和扩散系数,最后将每个颗粒的扩散系数代入Stokes-Einstein方程,计算出各自的水合动力学直径。然而,NTA得到的粒径包含颗粒外的水化层,将颗粒在x-y-z三维空间的布朗扩散变成x-y二维平面的颗粒追踪,导致测得的速率比颗粒的实际运动速率偏小,使得颗粒粒径的测定结果偏大,同时,也使测得的颗粒粒径分布相比于真实分布存在展宽。此外,由于EVs粒径分布较宽,为了防止大颗粒的散射光信号过饱和,必须降低相机亮度,导致小颗粒的散射光信号较弱,难以被仪器跟踪分析。因此,NTA仅能检测粒径大于70 nm的EVs,并且颗粒粒径分布结果通常大于电镜的测定结果,且展宽较为严重[17]。TRPS是一种利用纳米孔技术对溶液中纳米颗粒的粒径分布和浓度在单颗粒水平进行快速测定的方法,其对于EVs样本的表征存在以下挑战:(1)校准粒子应与EVs样本具有相同的缓冲液组分,然而在测量EVs,尤其是生物样本中的EVs时,缓冲组分通常是未知的; (2)由于EVs的粒径分布广,样品中的大尺寸EVs常会造成纳米孔的堵塞,从而阻碍测量[18]。FCM是一种对悬液中的细胞或细胞大小的颗粒进行快速定量分析的先进技术,散射光可揭示细胞或颗粒的粒径以及材质的疏密程度,多色荧光标记可实现细胞内基因表达、特异性蛋白表达、酶活、离子浓度等生化性状的测定。基于米氏散射模型的散射光与粒径的关系,2018年,van der Pol等[19]对各种商品化流式细胞仪可检测到的EVs的粒径范围进行了评估,发现只有少数几款高灵敏设备(包括Apogee A50- Micro,BD influx以及BD LSR II)可检测300~600 nm范围的EVs,其它常规配置的流式细胞仪只适用于检测粒径范围在600~1200 nm和/或1200~3000 nm的大尺寸EVs。
传统的EVs生化检测方法主要是基于集权平均的分析方法,如Western blotting、酶联免疫法(Enzyme-linked immunosorbent assay, ELISA)和聚合酶链式反应(Polymerase chain reaction, PCR)、蛋白质组学分析、核酸测序等。这些方法虽可对EVs样本中的生物分子丰度进行整体分析,却无法揭示EVs在蛋白、核酸等方面的个体差异性,而EVs亚类的分析对于EVs分泌机制和功能的研究至关重要[20~22]。因此,如何在单颗粒水平对EVs的理化性质进行精准测量,以揭示EV颗粒间异质性,是一个亟待解决的科学难题[23]。为了实现纳米颗粒的高灵敏度多参数检测,本研究组结合瑞利散射和鞘流单分子荧光检测技术,成功研制出纳米流式检测装置(Nano-flow cytometer, nFCM),将EVs、病毒、二氧化硅纳米颗粒 (SiNPs)、纳米金颗粒 (AuNPs) 的散射检测下限分别降低至40、27、24和7 nm,较传统流式细胞仪的散射检测灵敏度提升4~5个数量级,检测速率高达每分钟上万个颗粒,粒径表征分辨率与冷冻透射电镜[17,24,25]相当。在荧光检测方面,nFCM可检测到单个藻红蛋白的荧光信号,较传统流式细胞仪灵敏1~2个数量级[26]。本研究采用nFCM对uEVs在单颗粒水平进行多参数定量表征。
uEVs提取的方法主要有超速离心法、非对称场流分离、密度梯度离心法、免疫亲和分离法、超滤法和聚合物沉淀法等[27,28]。其中,超速离心法最为常用,其提取步骤一般为:(1) 3000 g离心10 min,取上清液,以17000 g离心20 min,去除尿液中的细胞和细胞碎片; (2)200000 g超速离心110 min, 2次,提取uEVs沉淀; (3)对提纯的uEVs进行密度梯度离心,提高EVs纯度[27,29]。其中,差速离心需要5~6 h,密度梯度离心约需要24 h,非常耗时费力。为了能在较短的时间内获得高纯度的uEVs,本研究采用配备了TLA-120.2转头的Beckman Coulter Optima MAX-XP台式超速离心机对uEVs进行纯化,将EVs的单次超速离心时间从110 min缩短至17 min。具体提取步骤如图1所示:(1) 3000 g离心20 min, 去除尿液中的细胞碎片; (2)100000 g离心17 min,2次,提取uEVs。整个提纯过程仅需1 h。基于nFCM散射和荧光检测的高灵敏和快速性,本研究对尿液提纯的uEVs的纯度、浓度、粒径分布、核酸和蛋白丰度等进行了定量表征。此外,本研究还对10位健康受试者连续5天的中段晨尿进行了uEVs的追踪分析。
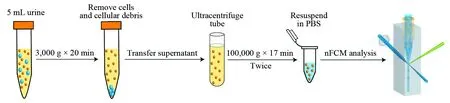
图1 uEVs的超速离心纯化步骤及纳米流式分析图Fig.1 Schematic depiction of urinary extracellular vesicles (uEVs) isolation by differential ultracentrifugation and nano-flow cytometer (nFCM) analysis
2 实验部分
2.1 仪器与试剂
5810R冷冻离心机(德国Eppendorf公司); Optima Max-XP超速离心机,配备TLA 120.2转头(美国Beckman Coulter公司)。 nFCM为本研究组自行开发[30],本研究在检测uEVs的纯度、浓度、粒径和蛋白时所用的仪器参数与之前报道的相同。532 nm (16 mW) 激光器发出的激光经反射镜反射后,被消色差胶合透镜聚焦为直径约10 μm的激光光斑,激光光斑与鞘液聚焦后的uEVs样品流正交于石英流动室的中心处,uEVs颗粒穿越激光探测区所发出的光信号被显微镜物镜收集后,由二向色分光镜Dic-F(美国Semrock公司,FF555-Di03)分为两束光路,波长λ<555 nm的光被反射至第一个APD进行散射检测,而波长λ>555 nm的光经过FF01-579/34带通滤波片BP(美国Semrock公司)被第二个APD接收,进行荧光检测。当检测绿色荧光染料CFSE、SYTO16和RNASelect标记的uEVs时更换为488 nm激光器(20 mW), 此时二向色分光镜FF555-Di03更换为FF500-Di01,λ<500 nm的光被反射至第一个APD进行散射检测,而λ>500 nm的光经过FF01-525/45带通滤波片BP(美国Semrock公司)被第二个APD接收,进行荧光检测。仪器其它参数不变。
磷酸盐缓冲液 (PBS, pH 7.4)经220 nm滤膜过滤,于4℃保存,备用; Triton X-100(美国Sigma-Aldrich公司); 荧光标记的抗体(美国BD Biosciences公司),包括藻红蛋白(Phycoerythrin, PE)标记小鼠IgG 1, κ(Clone MOPC-21)、PE标记鼠抗人CD9抗体(Clone M-L13)、PE标记鼠抗人CD63抗体(Clone H5C6)、PE标记鼠抗人CD81抗体(Clone JS-81)和 PE标记鼠抗人CD24抗体(Clone ML5),5(6)-羧基二乙酸荧光素琥珀酰亚胺酯(CFDA-SE, CFSE,美国MedChemExpress公司,HY-D0938); RNase-free DNase I (日本Takara公司,2270A); RNase A(EN0531)、SYTO 16(S7578)和SYTO RNASelect(S32703)(美国Thermo Fisher公司)。
2.2 实验方法
2.2.1 uEVs的纯化中段晨尿来源于10名年龄20~30岁的健康志愿者(5名男性,5名女性),受试者无肾脏和糖尿病等慢性病史,尿液留取两周内,受试者无急性感染、无用药史,女性受试者均避开生理期。5 mL尿液以3000 g离心20 min(5810 R冷冻离心机),去除细胞和细胞碎片,取上清液。将1 mL上清液转入超速离心管,100000 g离心17 min(Optima Max-XP超速离心机),弃上清液,沉淀重悬于1 mL PBS中; 100000 g离心17 min,弃上清液,uEVs重悬于100 μL PBS中,备用。
2.2.2 冷冻透射电镜观测uEVs 冷冻透射电镜拍摄使用Tecnai F20透射电子显微镜在120 kV的电压下拍摄。
2.2.3 uEVs纯度鉴定将10 μL PBS稀释的10% Triton X-100加到90 μL uEVs中,Triton X-100的终浓度为1%。样品振荡混匀后,冰上孵育30 min, 以裂解uEVs。反应结束后,将样品稀释20倍,使用nFCM检测Triton X-100处理前后uEVs的颗粒浓度变化。
2.2.4 CFSE标记uEVs将100 μL 稀释于PBS的200 μmol/L CFSE加到100 μL 6 ×108个/mL的uEVs中 (CFSE终浓度为100 μmol/L),37℃避光孵育2 h。将样品转入超速离心管,用PBS补至1 mL, 100000 g离心17 min。弃上清液,向超速离心管加入1 mL PBS, 100000 g离心17 min。将标记后的uEVs重悬于100 μL PBS,用于nFCM检测。
2.2.5 uEVs核酸标记将4 μL 5 U/μL RNase-free DNase I或1 μL 10 mg/mL RNase A加入到100 μL 3 × 108个/mL uEVs中,37℃孵育30 min。随后,将SYTO 16或SYTO RNASelect加入uEVs中,使其终浓度为6 μmol/L或10 μmol/L,37℃孵育20 min,用于nFCM检测。
2.2.6 uEVs蛋白标记将尿液3000 g离心,取1 mL上清液转入超速离心管,100000 g离心17 min,弃上清液,将uEVs重悬在50 μL PBS中,分别加入20 μL PE标记小鼠IgG 1, κ同型对照、PE标记鼠抗人CD9抗体、PE标记鼠抗人CD63抗体、PE标记鼠抗人CD81抗体或 PE标记鼠抗人CD24抗体原液,37℃孵育30 min。用PBS补至1 mL, 100000 g离心17 min。弃上清液,向超速离心管加入1 mL PBS, 100000 g离心17 min,将标记后的uEVs重悬于100 μL PBS,用于nFCM检测。
3 结果与讨论
3.1 uEVs形态与纯度
普通透射电镜在制备样本时会造成EVs脱水,无法展示EVs的真实形态。在低温下,冷冻透射电镜将溶剂中的EVs快速冷冻固定后拍摄,能够保持EVs的原始形态[15]。为了获得uEVs的真实形态,本研究采用冷冻透射电镜对uEVs进行拍摄,其形态如图2A所示,主要有球形和棒状两种形态,此外,还存在着一些具有多层膜结构的囊泡。Triton X-100是一种非离子型表面活性剂,可裂解uEVs的磷脂双分子层,不会破坏无脂膜结构的杂质颗粒[30]。通过使用nFCM测定Triton X-100处理前后uEVs的颗粒浓度,可对uEVs的纯度进行评估。图2B和2C分别为nFCM检测1% Triton X-100处理前后的uEVs的侧向散射信号(Side scattering, SSC)波形图和统计直方图。计算结果表明,uEV的纯度为92%,而超速离心纯化获得的血浆和细胞上清液来源的EVs的纯度通常为90%和70%~80%[17],这主要是因为与血浆和细胞上清液相比,尿液中含有少量脂蛋白、血清蛋白等杂质颗粒。CFSE是一种可穿透细胞膜的荧光染料,自身不具有荧光性质。当CFSE进入囊泡内部,其乙酸基团被囊泡内部的酯酶水解,此时,CFSE可发出较强的绿色荧光,但不再具有膜通透性; 同时,CFSE含有的琥珀酰亚胺基团可与囊泡内蛋白的游离胺基反应,形成具有荧光的蛋白加合物[31]。本研究使用CFSE对uEVs进行标记,CFSE荧光强度与侧向散射强度的二维散点图(图2D)表明,82.6%的uEVs可被CFSE标记,标记比例与uEVs的纯度相近,且粒径越大的EVs,CFSE的荧光亮度越强。
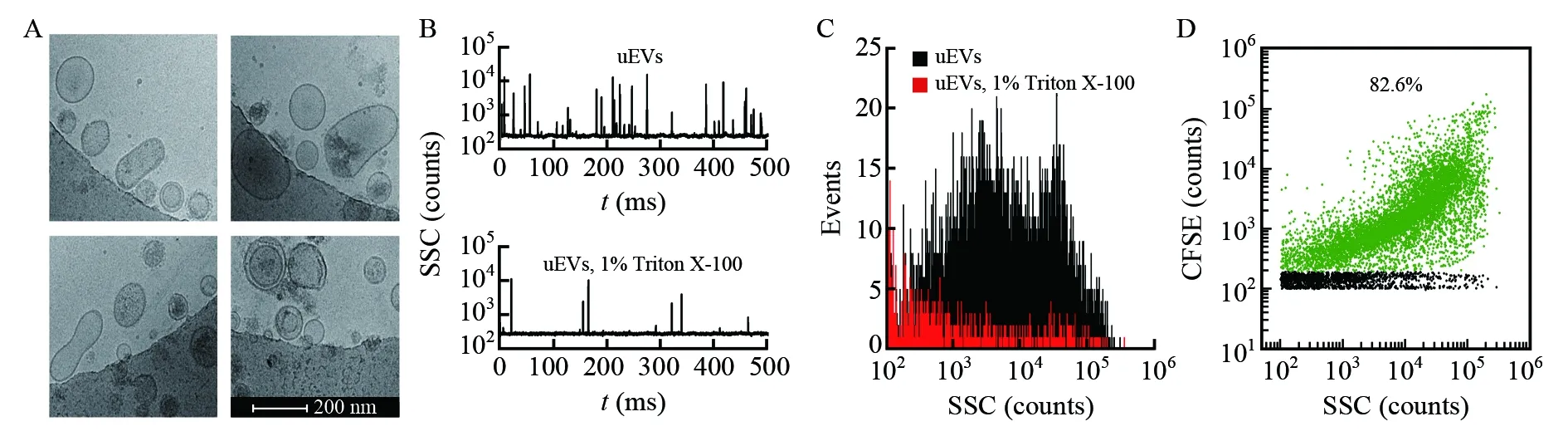
图2 uEVs的形态与纯度鉴定:(A)uEVs冷冻透射电镜图; (B)nFCM检测Triton X-100处理前后,uEVs的散射信号波形图; (C)nFCM检测Triton X-100处理前后,uEVs的散射信号统计直方图; (D)CFSE标记uEVs的散射-荧光信号二维散点图Fig.2 Morphology and purity identification of uEVs: (A) Representative cryo-transmission electron microscopemicrographs of uEVs; (B) Representative side scatter (SSC) burst traces of uEVs before and after 1% Triton X-100 treatment for 30 min by nFCM; (C) SSC distribution histograms of uEVs before and after 1% Triton X-100 treatment; (D) Bivariate dot-plots of green fluorescence versus SSC for uEVs fluorescently labeled with CFSE
3.2 uEVs颗粒浓度测定
虽然尿液样本具有简单易得、无创取样等优点,但尿液中uEVs的浓度易受昼夜节律、水合状态的变化、锻炼和饮食等因素影响[32]。因此,对于不同个体或同一个体不同时间点uEVs进行浓度测定对于后续的研究具有一定的指导意义。首先使用nFCM对初始浓度为2.03 × 109个/mL 的100 nm聚苯乙烯荧光标准球进行梯度稀释检测(采样时间为1 min),建立聚苯乙烯荧光标准球的浓度与nFCM单位时间检测颗粒数之间的标准工作曲线(图3A和3B),相关系数R2=0.998。随后,在相同进样压力条件下对uEVs样本的散射信号进行检测,采样时间为1 min,将检测到的uEVs的颗粒数代入标准工作曲线,即可得到待测样本中uEVs的颗粒浓度。基于此方法,本研究对10名受试者每天晨尿中uEVs的颗粒浓度进行了为期5天的连续追踪。图3C表明,所有受试者的uEVs浓度均分布在3.0 × 109~8.9 ×1010个/mL之间,这个浓度远高于文献报道的2.0 × 108~4.0 × 108个/mL[33],这主要是因为nFCM灵敏度高,能检测到小粒径的uEVs。对比每位受试者连续5天的uEVs浓度,可知受试者的浓度变化存在较大的个体差异,个人5天的浓度变异系数(Coefficient of variation, CV)在18.5%~142.0%之间。此外,虽然男性受试者和女性受试者的uEVs浓度不存在显著差别,但女性受试者5天的浓度变异系数(47.1%~142.0%)略高于男性(18.5% ~82.1%)。
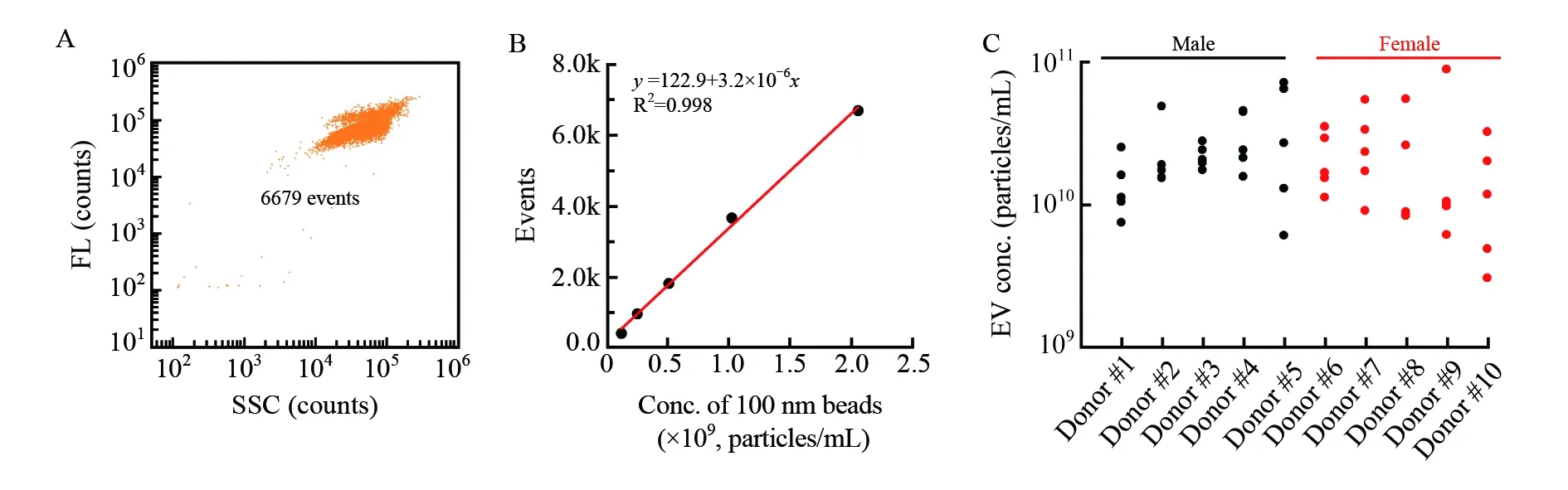
图3 uEVs的浓度测定:(A)100 nm聚苯乙烯荧光标准球的散射-荧光二维散点图; (B)nFCM单位时间(1 min)检测到的100 nm聚苯乙烯荧光标准球颗粒数与其实际浓度的线性关系曲线; (C)10名受试者连续5天晨尿中uEVs的浓度检测结果Fig.3 Concentration measurement of uEVs by nFCM: (A) A bivariate dot-plot of fluorescence versus side scattering for 100 nm fluorescent polystyrene beads; (B) Linear relationship between the events rate measured by the nFCM in 1 min and the true concentration of 100 nm fluorescent polystyrene beads; (C) Concentrations of uEVs isolated from 10 healthy donors for five consecutive days
3.3 uEVs粒径分布测定
粒径分布是细胞外囊泡研究中重要的物理参数,粒径与囊泡的分泌来源和携载分子的丰度密切相关[21]。基于nFCM对单个EVs散射光强度的快速检测,同时,采用单分散性良好的SiNPs粒径标准球建立散射光强度与粒径的关系曲线,并结合米氏散射理论对SiNPs和EVs的折射率偏差进行校正,实现了对粒径低至40 nm的EVs的粒径快速表征,其准确性和分辨率与冷冻透射电镜[17]相当。图4A是10位健康受试者同一天uEVs粒径分布统计直方图,虽然不同的个体在分布上略有差异,uEVs的粒径主要分布在40~120 nm之间。5位男性受试者uEVs的中位粒径(Median size)分别为69、66、67、63和67 nm, 5位女性受试者uEVs的中位粒径分别为65、62、63、67和62 nm。通过对比可知,男性受试者uEVs的粒径略大于女性受试者,但并无显著区别(p= 0.08),这种结果可能是样本量较少造成的。随后,对其中1位男性受试者uEVs的粒径进行了连续5天的追踪分析,由图4B可知,同一受试者uEVs的粒径分布在不同的日期粒径分布差异并不明显,5天粒径中位值为(68 ± 4) nm。上述实验结果表明,不同受试者或同一受试者在不同日期uEVs的粒径分布变化不大。
3.4 uEVs的核酸检测
根据文献报道,uEVs中存在DNA片段和多种类型的RNA(miRNA、mRNA和rRNA等)[34~36]。这些DNA和RNA在基于uEVs的疾病诊断研究中至关重要,如以uEVs携载RNA为检测靶标的前列腺癌诊断试剂盒ExoDxTMProstate (IntelliScore) 已被用于临床分析[37]。然而,现有的表征技术尚无法确定DNA和RNA是否存在于每个uEVs颗粒中,是携载于uEVs的内部,还是粘附于uEVs的外部,以及核酸丰度等问题。本研究使用SYTO 16对一位男性健康受试者uEVs的DNA进行标记,采用nFCM在单颗粒水平检测uEVs的荧光和散射信号,探究DNA在uEVs中的分布及其与粒径的关系。SYTO 16是一种可跨膜的绿色荧光核酸染料,荧光光谱表明,SYTO 16与DNA结合的荧光强度比与相同浓度的RNA结合高15倍,说明其对DNA具有高度的特异性(图5A)。为了探究uEVs表面是否黏附有DNA片段,在核酸染色前使用DNase I对uEVs进行处理。由于uEVs具有完整封闭的磷脂双分子膜,DNase I只能作用于uEVs外表面,无法水解uEVs内部包裹的DNA片段。由SYTO 16荧光强度与散射光强度的二维散点图(图5B)可知,DNase I处理前后uEVs的染色比例和荧光强度均无明显变化。此实验现象表明uEVs外表面没有DNA片段黏附,uEVs的DNA主要分布在uEVs内腔。结合散射信号强度可知,DNA主要分布在粒径较大的uEVs的内腔中。为了分析RNA在uEVs中的分布与丰度,使用SYTO RNASelect对uEVs中的RNA进行定量标记。SYTO RNASelect是目前唯一商业化的RNA特异性荧光染料,是一种跨膜的绿色荧光染料,通过荧光光谱(图5C)可知,其与RNA结合的荧光强度比与同浓度DNA高30倍。为了探究uEVs外表面是否黏附RNA,采用RNase A处理uEVs。由SYTO RNASelect荧光强度与散射光荧光强度的二维散点图(图5D)可知,RNase A处理前后uEVs的染色比例分别为5.2%和4.7%,而且荧光强度也没有明显变化。结果说明,uEVs表面几乎没有RNA黏附,RNA同样主要分布在uEVs的内腔中。
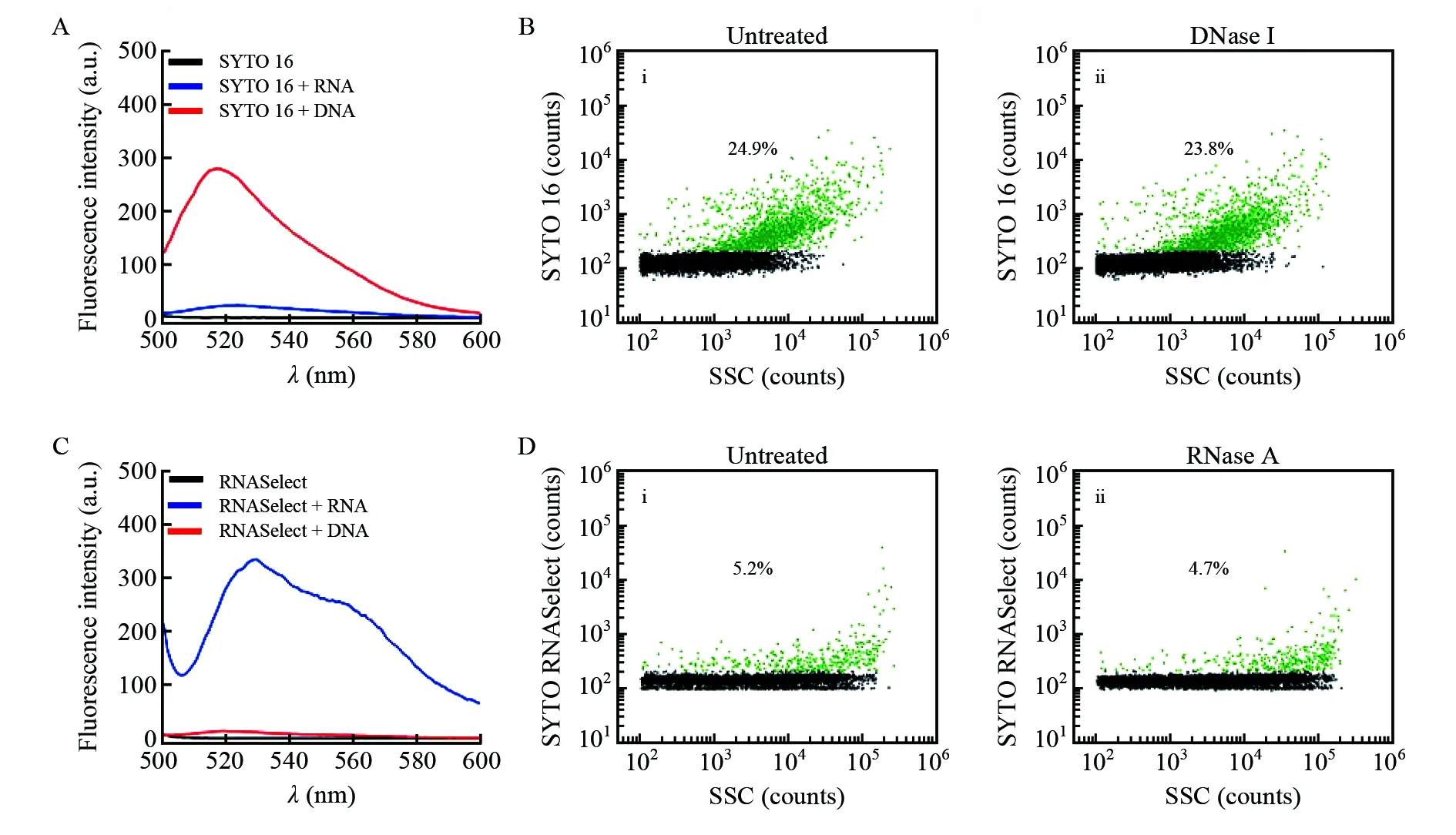
图5 uEVs的核酸检测:(A)荧光分光光度计考察SYTO 16对于DNA和RNA荧光标记的特异性(SYTO 16浓度为6 μmol/L,DNA和RNA的浓度均为5 μg/mL); (B)nFCM测定uEVs未经DNase I处理和处理后使用6 μmol/L SYTO 16染色的散射-荧光二维散点图; (C)荧光分光光度计考察SYTO RNASelect对于RNA和DNA荧光标记的特异性(SYTO RNASelect浓度为10 μmol/L,DNA和RNA的浓度均为5 μg/mL); (D)nFCM测定uEVs 未经RNase A处理和处理后使用10 μmol/L SYTO RNASelect染色的散射-荧光二维散点图Fig.5 nFCM analysis of DNA and RNA on single uEVs: (A) Fluorescence emission spectra of SYTO 16 without or with RNA or DNA binding. The concentration of SYTO 16 is 6 μmol/L, and the concentrations of RNA and DNA were both 5 μg/mL. (B) Bivariate dot-plots of green fluorescence versus SSC for uEVs without or with DNase I treatment and then fluorescently labeled with SYTO 16. The concertation of SYTO 16 is 6 μmol/L. (C) Fluorescence emission spectra of SYTO RNASelect without or with RNA or DNA binding. The concentration of SYTO RNASelect is 10 μmol/L, and the concentrations of RNA and DNA are both 5 μg/mL. (D) Bivariate dot-plots of green fluorescence versus SSC for uEVs without or with RNase A treatment and then fluorescently labeled with SYTO RNASelect. The concertation of SYTO RNASelect is 10 μmol/L
3.5 uEVs的蛋白标志物检测
CD9、CD63和CD81是鉴定EVs最经典的蛋白标志物,这3种蛋白也常被用于EVs的亲和捕获,以提纯EVs[20,38]。但是否每个uEVs都携载这3种蛋白标志物尚不清楚。nFCM的荧光通道可高灵敏度地检测单个藻红蛋白PE的荧光信号,本研究使用PE标记的抗体对CD9、CD63和CD81在单个uEVs中的表达进行定量检测。图6显示对于受试健康男性uEVs样本,CD9、CD63和CD81阳性的uEVs比例分别为26.8%,21.0%和6.0%,因此,如果用这些蛋白的抗体对uEVs进行亲和捕获,将会遗漏大部分的uEVs。CD24是一种糖基磷脂酰肌醇锚蛋白,是黏蛋白样黏附分子,通过糖基磷脂酰肌醇黏附在细胞膜上。文献[39]报道,CD24在健康人uEVs中高表达,被认为是uEVs的蛋白标志物。通过nFCM对uEVs表面的CD24进行检测,结果表明,CD24在uEVs中的阳性比例为19.9%,荧光强度比CD9、CD63和CD81高,说明CD24的单颗粒表达水平比这3种蛋白高。
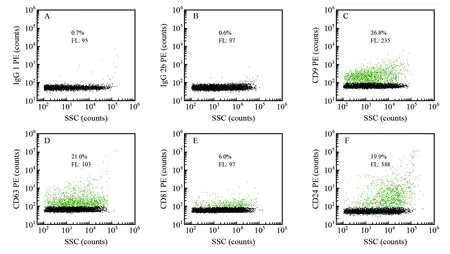
图6 uEVs蛋白标志物的免疫荧光检测,(A~F)uEVs的抗体PE荧光-散射二维散点图:(A)同型对照IgG 1; (B)同型对照IgG 2b; (C)CD9; (D)CD63; (E)CD81; (F)CD24Fig.6 Protein marker analysis of uEVs by nFCM upon immunefluorescent staining. (A-F) Bivariate dot-plots of PE orange fluorescence versus SSC for a uEV isolate fluorescently labeled with PE-conjugated monoclonal antibody specific to IgG 1 (A), IgG 2b (B), CD9 (C), CD63 (D), CD81 (E) or CD24 (F)
4 结 论
基于nFCM可在单颗粒水平对纳米颗粒进行高灵敏、高通量和多参数定量检测的独特优势,本研究对uEVs的纯度、浓度、粒径、DNA、RNA以及蛋白标志物进行了表征。研究表明,采用超速离心纯化的uEVs纯度高达92%,整个提纯过程仅需1 h; 对10位健康受试者uEVs的检测结果表明,uEVs的颗粒浓度主要分布在3.0 × 109~8.9 ×1010个/mL之间,存在较大的个体差异,且同一受试者不同日期也存在较大的差别。此外,uEVs的粒径主要分布在40~120 nm之间,个体差异和同一受试者不同日期的差异不大。核酸检测结果表明,uEVs的外表面均无DNA或RNA黏附,核酸主要存在于uEVs的内腔。蛋白标志物的检测结果表明,并不是每个uEVs都表达CD9、CD63、CD81等蛋白,对于所测样本,这3种蛋白的阳性率分别为26.8%、21.0%和6.0%,而CD24的阳性率为19.9%。本研究对uEVs的多种物理和生化参数在单个颗粒水平进行了精确的定量表征,nFCM可为uEVs的分泌方式研究、亚群鉴定以及临床价值挖掘提供强大的技术支撑。
