采用固相萃取结合高效液相色谱测定清香型白酒中酚类活性化合物
2020-10-22吴子阳李贺贺孙金沅孙啸涛孙宝国
吴子阳 何 菲 李贺贺*,2 孙金沅,2 孙啸涛,2 孙宝国,2
(北京工商大学 食品质量与安全北京实验室1, 食品营养与人类健康北京高精尖创新中心2, 北京 100048)
1 引 言
白酒是中国特有的一种蒸馏酒,历史悠久,在我国酒文化中占有重要地位[1]。青稞酒是生产于我国青海省的一种清香型白酒,因其独特的地理环境、酿酒原料、大曲配料和生产工艺而形成了独特的产品风格[2]。
2016年,孙宝国等[3]首次提出健康白酒可通过“内寻外加,自然强化”实现。“内寻”指的是通过现代分析手段检测发现白酒中含有的健康因子。酚类活性化合物因其优良的抗氧化性而被广泛关注,对冠心病、糖尿病、高血脂、痛风等都有一定的预防作用[4~9]。白酒的酿酒原料(大麦、小麦、麦麸、大米、玉米)中,阿魏酸的含量最丰富,其它有特征代表性的酚类活性化合物包括没食子酸、对香豆酸、丁香酸、儿茶素等[10~15],青稞酒是以青稞为酿酒主要原料,青稞中也含有包括阿魏酸在内的大量酚类活性化合物[16]。
关于黄酒和葡萄酒中酚类活性化合物研究较多,主要集中在定性定量分析、地域性差异、不同发酵工艺对酒质影响、生理功效、酿酒微生物等方面[17~21]。近年来,关于白酒中酚类活性化合物的研究较少,主要涉及功效综述、定性与定量分析和生物活性分析[22]。白酒中酚类活性化合物属痕量化合物,难以通过直接检测的方法测得,因此,需采取适当的提取分离方法。2016年,黄蕴利等[23]指出白酒中含有少量儿茶酚、愈创木酚、阿魏酸,并对其抗氧化、防癌、抗血小板聚集、镇痛等一系列生理活性作用进行简要阐述。王银辉等[24]基于超高效液相色谱-串联质谱(UPLC-ESI-MS(QQQ))建立了一种高效测定白酒中没食子酸、阿魏酸、儿茶素、对香豆酸等7种微量有机酸的方法。样品经过氮吹复溶后,结合LC-MS直接分析,对实验仪器要求较高,直接氮吹无法排除干扰组分。2019年,王戎等[25]通过固相萃取(Solid phase extraction, SPE)结合LC-MS法测定了白酒中酚酸类化合物和酚酸酯类化合物,并未对前处理条件进行优化。
本研究建立了SPE结合高效液相色谱 (HPLC)简便高效分析白酒中上述5种谷物中有代表性的酚类活性化合物的方法。对目前研究较少且采用清蒸清烧四次清的工艺制备的青稞酒中酚类活性化合物进行定性与定量分析,并与其它清香型白酒和不同香型白酒进行对比。通过对白酒中5种酚类活性化合物的快速检测和综合分析,为白酒老熟和提升白酒中酚类活性化合物的含量提供理论基础,并为实现“内寻外加,自然强化”提升白酒中酚类活性化合物含量提供研究参考。
2 实验部分
2.1 仪器与试剂
Agilent 1260高效液相色谱仪(美国Agilent公司); VISIPREP 24TMDL SPE装置(美国Supelco公司); UV-2700 220V CH UV-VIS 紫外-可见光谱仪(Shimadzu 苏州仪器有限责任公司); Waters Oasis HLB LP Extraction Cartridge SPE小柱、Waters Xselect HSST3色谱柱(美国Waters公司); Advanntage A10 Milli-Q超纯水仪(德国Merk Millipore公司); RE-5205旋转蒸发仪(上海亚荣生化仪器厂); 0.22 μm针头过滤器(天津市津腾实验设备有限公司)。
阿魏酸、没食子酸和(+)-儿茶素水合物(纯度>99%,北京J&K公司); 对香豆酸、丁香酸(纯度>99%,美国Admas公司); 甲醇、乙醇、乙腈和乙酸(色谱纯,纯度>99%,北京伊诺凯科技有限公司); HCl(国药集团化学试剂有限公司); 实验用水为超纯水, 由Milli-Q超纯水仪制备。酒样共46个,分别为酒厂取得的不同贮酒容器、不同贮藏时间的青稞酒原酒(QKYJ(1)~(17)); 当地商场购买的3个芝麻香型商品白酒(ZMX(1)~(3))、3个酱香型商品白酒(JX(1)~(3))、3个浓香型商品白酒(NX(1)~(3))、20个清香型商品白酒(QK(1)、QK(2)、QK(3)、FJ(1)、FJ(2)、FJ(3)、HX(1)、HX(2)、HX(3)、XHC(1)、XHC(2)、XHC(3)、SMC(1)、SMC(2)、NLS(1)、NLS(2)、NLS(3)、JJ(1)、JJ(2)、JJ(3))。
2.2 实验方法
2.2.1 高效液相色谱方法流动相A为2%乙酸溶液,流动相B为乙腈; 梯度洗脱: 0~10.0 min,84% A; 10.0~18.0 min,84%~70% A; 18.0~19.0 min, 70%~84% A; 19.0~21.0 min,84% A。流速:1.0 mL/min; 柱温:30℃; 检测波长:280和330 nm; 进样量为5 μL。
2.2.2 标准溶液和标准曲线准确称取标准品没食子酸、(+)-儿茶素水合物、丁香酸、对香豆酸和阿魏酸各100.0 mg,用色谱纯甲醇分别溶解定容至10 mL,配制成10 g/L标准品母液,于-20℃保存,备用。
配制没食子酸、(+)-儿茶素水合物和丁香酸的标准品溶液,浓度梯度为0.05、0.5、1.0、2.0、5.0和10 mg/L; 配制对香豆酸和阿魏酸标准溶液的浓度梯度为0.05、0.2、0.5、2.0、4.0和20 mg/L。各梯度的混合标准品溶液过0.22 μm针头过滤器后,按2.2.1节的方法进行HPLC测定,绘制标准曲线,通过外标法进行定量分析。
2.2.3 样品前处理先用超纯水将酒样酒精度调成10%(V/V),用1 mol/L HCl调节至pH=2。用6 mL甲醇和6 mL超纯水活化SPE小柱后,将酒样加入SPE小柱,缓慢旋转SPE装置真空阀,保持流速为1 mL/min。 待样品完全上样,取下SPE小柱。用6 mL超纯水冲洗小柱,除去干扰物。用6 mL甲醇(pH=4)洗脱酚类活性化合物,收集洗脱液。在35℃下旋转蒸发至干,加入0.5 mL甲醇复溶。将样品过0.22 μm滤器,进行HPLC测定。
2.2.4 最大检测波长的确定用色谱纯甲醇配制50 mg/L的5种酚类活性化合物标准品溶液。 将紫外-可见光谱仪用甲醇调零后,测定样品最大吸收波长。光谱扫描范围为180~600 nm。
2.2.5 前处理条件的优化由于白酒中5种酚类活性化合物为痕量化合物,不同条件下易受仪器状态等因素影响,导致变化趋势不明显。因此,配制5种酚类活性化合物混合标准品溶液于白酒样品(以下称为“模拟酒样”)中,添加阿魏酸和对香豆酸的浓度为150 μg/L,没食子酸和丁香酸的浓度为200 μg/L, (+)-儿茶素水合物浓度均为250 μg/L。对模拟酒样pH值(1、2、3、4、5)、甲醇溶液pH值(2、3、4、5、6)及甲醇溶液用量(2、3、4、5、6和8 mL)进行优化。以上所有样品均按2.2.3节的前处理步骤处理,平行3次实验。
3 结果与讨论
3.1 最大吸收波长和检测波长
没食子酸、(+)-儿茶素水合物和丁香酸的最大吸收波长均接近280 nm,对香豆酸和阿魏酸的最大吸收波长均接近330 nm。因此,选择在280 nm处检测没食子酸、(+)-儿茶素水合物和丁香酸,在330 nm处检测对香豆酸和阿魏酸,如表1所示。
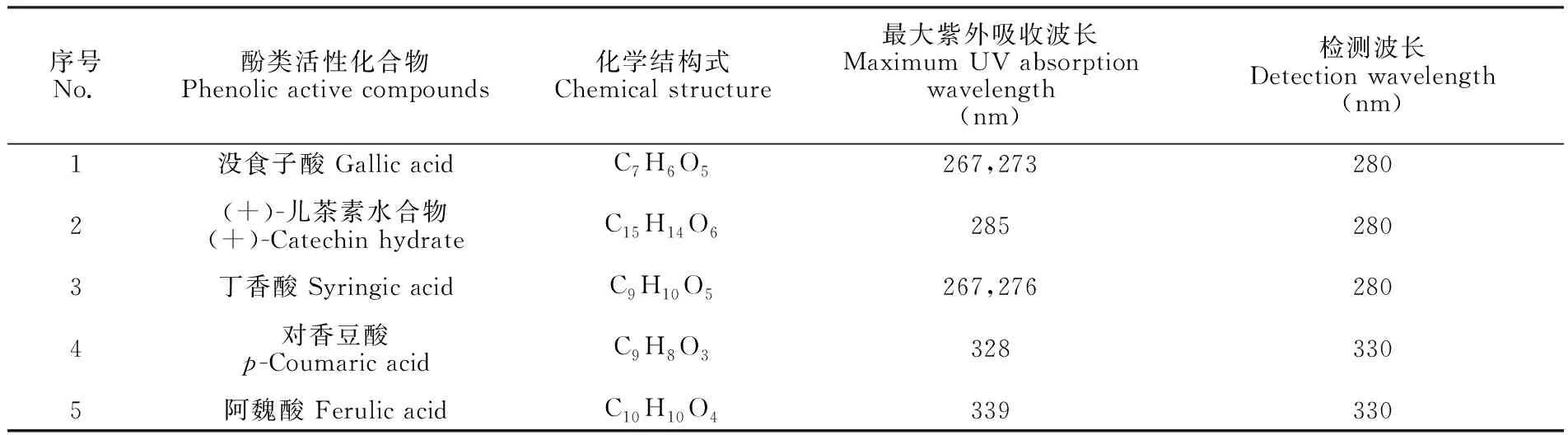
表1 5种酚类活性化合物最大吸收波长和检测波长
3.2 5种酚类活性化合物的定性分析
在280 nm处,5种酚类活性化合物均有响应,而在330 nm处时,(+)-儿茶素水合物和丁香酸的响应不佳。因此,选择UV 280 nm以确定5种酚类活性化合物的保留时间,酒样中5种酚类活性化合物的HPLC图如图1所示。5种酚类活性化合物的保留时间为:没食子酸(3.57 min)、(+)-儿茶素水合物(5.42 min)、丁香酸(8.39 min)、对香豆酸(13.86 min)、阿魏酸(16.42 min)。在当前洗脱条件和HPLC条件下,5种酚类活性化合物分离效果良好。
3.3 前处理条件的优化
3.3.1 酒样pH值的影响除(+)-儿茶素水合物外,其余4种酚类活性化合物均含有羧基,pH值对其影响较大。在甲醇洗脱液pH=4、洗脱液用量为6 mL时,选择模拟酒样pH分别为1、2、3、4和5进行实验。由图2可知,(+)-儿茶素水合物的提取效率在酒样pH值从1上升至4的过程中逐渐增大,在pH值上升至5时有一定程度的下降,但提取效率变化不大。其余4种酚类活性化合物在pH=2时,提取效率最大。综合考虑,将酒样调整为pH 2进行提取效果较好。
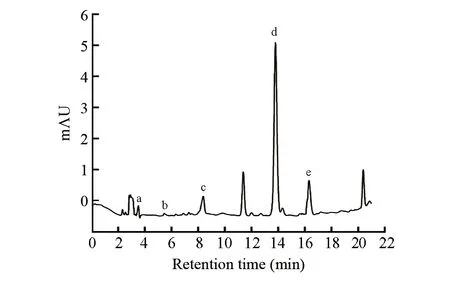
图1 白酒样品中5酚类活性化合物HPLC图Fig.1 High performance lipid chromatogram (HPLC) of 5 kinds of phenolic active compounds in baijiu samplesa, Gallic acid; b, (+)-Catechin hydrate; c, Syringic acid; d, p-Coumaric acid; e, Ferulic acid
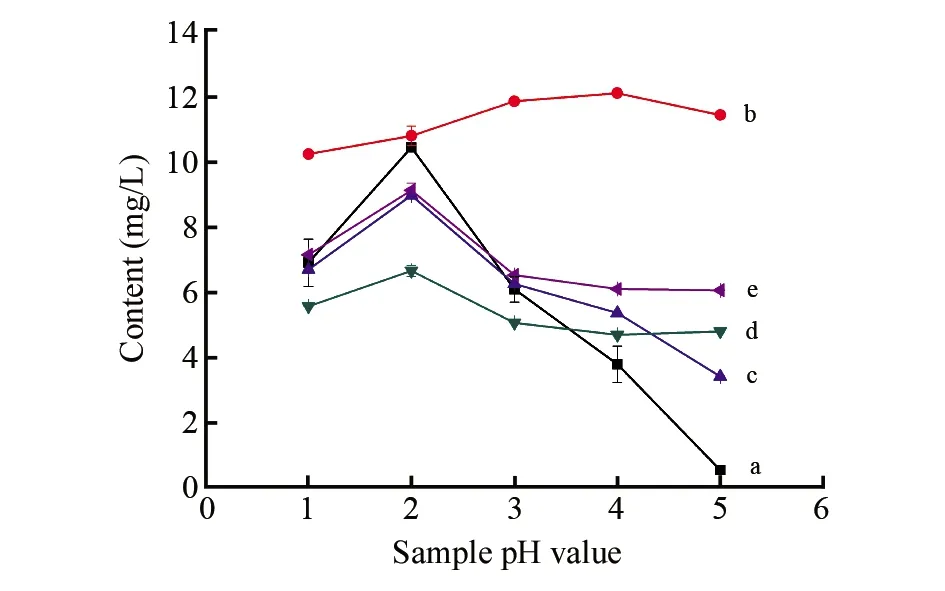
图2 白酒样品pH值对酚类活性化合物提取效率的影响Fig.2 Effect of baijiu sample pH value on extraction efficiency of phenolic active compoundsa. Gallic acid; b. (+)-Catechin hydrate; c. Syringic acid; d. p-Coumaric acid; e. Ferulic acid
3.3.2 甲醇洗脱液pH值的影响pH值对酚类活性化合物结构具有较大影响,且不同的pH值的洗脱溶液对酚类活性化合物的洗脱效率不同,因此洗脱液需选择合适的pH值。在酒样pH=2、洗脱溶液用量6 mL的情况下,选择甲醇洗脱液的pH值分别为2、3、4、5和6进行考察。由图3A可知,在洗脱溶剂pH值由2上升至3时,勤5种酚类活性化合物的提取效率均得到提升; pH值进一步增加至4时,(+)-儿茶素水合物和丁香酸的提取效率略有下降,其它3种酚类活性化合物的提取效率继续提高,其中,没食子酸和丁香酸的提取效率达到最大值。对香豆酸和阿魏酸在洗脱溶剂pH=5时提取效率最佳,但与pH=4时差距较小。没食子酸在pH值从4上升至5时,提取效率骤降。选择甲醇洗脱溶液的最佳pH=4。
3.3.3 甲醇洗脱液用量的影响选择酒样pH=2,甲醇洗脱溶液pH=4时,分别用2、3、4、5、6和8 mL甲醇溶液进行洗脱。由图3B可知,在洗脱溶剂为2 mL时,5种酚类活性化合物的提取效率很低,其中,(+)-儿茶素水合物未检出。洗脱溶剂用量增加至6 mL时,5种酚类活性化合物的提取效率逐渐增加,在洗脱剂用量2~3 mL时,除(+)-儿茶素水合物外,其余4种酚类活性化合物的提取效率迅速上升。在洗脱剂用量由3 mL增加至4 mL时,丁香酸的提取效率降低,但含量变化不大。(+)-儿茶素水合物的提取效率在洗脱剂用量大于3 mL后迅速上升,用量为6 mL时达到最大值。在洗脱溶剂含量从6 mL增加至8 mL时,酚类活性化合物提取效率变化不大。因此,选择洗脱溶剂最佳用量为6 mL。
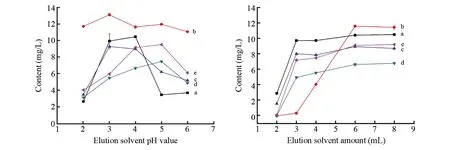
图3 洗脱溶剂pH值(A)和洗脱溶剂用量(B)对酚类活性化合物提取效率的影响Fig.3 Effect of elution solvent pH value (A) and elution solvent amount (B) on extraction efficiency of phenolic active compounds a. Gallic acid; b. (+)-Catechin hydrate; c. Syringic acid; d. p-Coumaric acid; e. Ferulic acid
3.4 方法的分析性能
5种酚类活性化合物标准曲线的线性相关系数(R2)在0.9945~0.9999之间,线性关系良好,检出限为0.98~12.2 μg/L,定量限为3.3~40.1 μg/L,回收率为84.1%~100.7%。具体参数见表2。
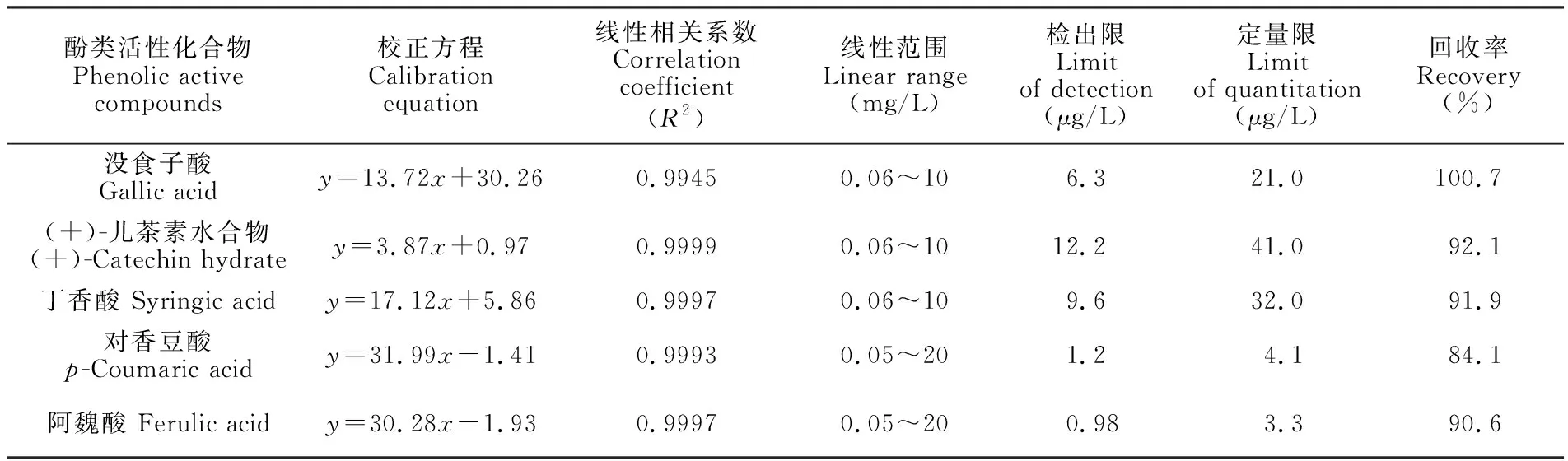
表2 5种酚类活性化合物线性范围、检出限、定量限、标准曲线方程及回收率
3.5 在不同容器中种贮藏的17种青稞原酒中酚类活性化合物含量对比
由表3所示,17种青稞酒原酒中均含有对香豆酸和没食子酸,含量分别为11.05~28.74 μg/L和2.68~5.80 μg/L。仅青稞原酒(7)中未检测出丁香酸和阿魏酸,其余16种原酒中丁香酸和阿魏酸的含量分别为0.67~5.87 μg/L和0.79~2.74 μg/L。未检出(+)-儿茶素水合物(0.58~5.54 μg/L)的样品数量较多,为11种。5种酚类活性化合物在青稞酒原酒中平均含量顺序为: 对香豆酸(20.75 μg/L)>没食子酸(4.19 μg/L)>丁香酸(1.71 μg/L)>阿魏酸(1.19 μg/L)>(+)-儿茶素水合物(1.10 μg/L)。17种青稞酒原酒中5种酚类活性化合物平均总量为30.93 μg/L。贮藏在新陶坛中的青稞酒原酒中的没食子酸的平均含量(4.81 μg/L)高于不锈钢大罐(3.72 μg/L)和老陶坛(3.22 μg/L),且丁香酸(1.76 μg/L)平均含量最高; 贮藏在不锈钢大罐中的青稞酒原酒中的(+)-儿茶素水合物(3.28 μg/L)和阿魏酸(1.45 μg/L)的平均含量最高; 贮藏在新陶坛中的青稞原酒未检出(+)-儿茶素水合物; 贮藏在老陶坛中的青稞原酒中对香豆酸(27.06 μg/L)的平均含量最高。5种酚类活性化合物的平均总量排序为:老陶坛(32.88 μg/L)>不锈钢大罐(31.80 μg/L)>新陶坛(23.84 μg/L)。
由于青稞酒贮酒容器不同, 5种酚类活性化合物的含量也有差异。选择不同贮酒容器贮存的17种青稞酒,采用SPE-HPLC法对5种酚类活性化合物进行测定,将酚类活性化合物的含量与样品建立矩阵,采用Origin 9.0 软件结合系统聚类法对样品进行聚类分析。采用最远距离法,以欧式距离为度量标准,获取不同贮藏容器中5种酚类活性化合物的聚类谱系图,聚类分析结果用树状图(图4)表示。由图4可知,QKYJ(8)和QKYJ(9)、QKYJ(13)和QKYJ(14)及QKYJ(15)和QKYJ(16)在最小距离水平上形成3个聚类,表明QKYJ(8)和QKYJ(9)、QKYJ(13)和QKYJ(14)及QKYJ(15)和QKYJ(16)之间分别具有最大相似性。随着欧氏距离的增大,其它样品也随之并入到不同的类别当中。当欧氏距离增至9.5时, 17个青稞原酒样本可被划分为4类,第一类包括样本1、2、3、4、5、6,第二类包括样本7、8、9,第三类包括样本10、13、14、11和12,第四类包括样本15、16和17。17个样本汇总最大欧氏距离差值为8,随着欧氏距离的继续增大至12时,样本7、8、9和10、13、14、11和12并为第二类,可将17种不同贮酒容器青稞酒进行区分。由聚类分析的结果可知,贮酒容器不同导致青稞酒原酒中5种酚类活性化合物不同,可以为白酒老熟容器后续的研究提供依据。
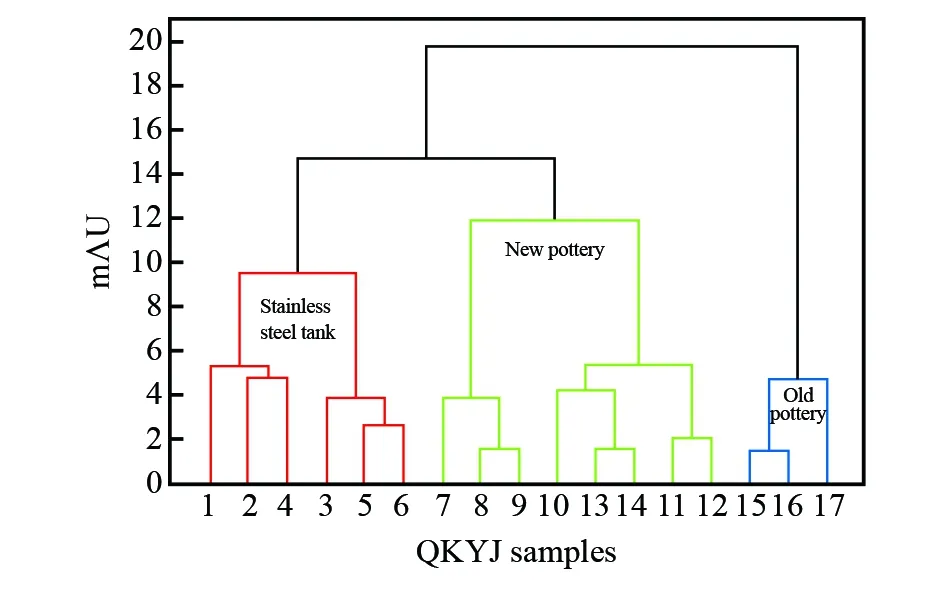
图4 17种青稞原酒最远距离树状图Fig.4 Average connection tree diagram of 17 kinds of barley baijiu
3.6 20种不同清香型白酒中酚类活性化合物含量对比
通过分析表4中数据可知,7个品牌的20种清香型白酒中均含有没食子酸、丁香酸和对香豆酸,含量分别为1.29~6.32 μg/L、0.48~57.01 μg/L和7.00~75.57 μg/L。 仅有XHC(2)中未检测出阿魏酸,其余19种白酒中阿魏酸含量为0.90~9.89 μg/L。未检出(+)-儿茶素水合物的样品较多,为6种,其余14种清香型白酒中(+)-儿茶素水合物的含量为0.58~8.99 μg/L。5种酚类活性化合物在清香型白酒中平均含量大小为对香豆酸(31.49 μg/L)>丁香酸(11.28 μg/L)>没食子酸(3.74 μg/L)>阿魏酸(3.02 μg/L)>(+)-儿茶素水合物(2.82 μg/L)。20种清香型白酒中5种酚类活性化合物平均总量为52.04 μg/L,QK(1)~QK(3)的5种酚类活性化合物的平均总量为64.94 μg/L,对比其它清香型白酒,青稞酒中5种酚类活性化合物的总含量高于除HX(1)和HX(2)外的清香型白酒。
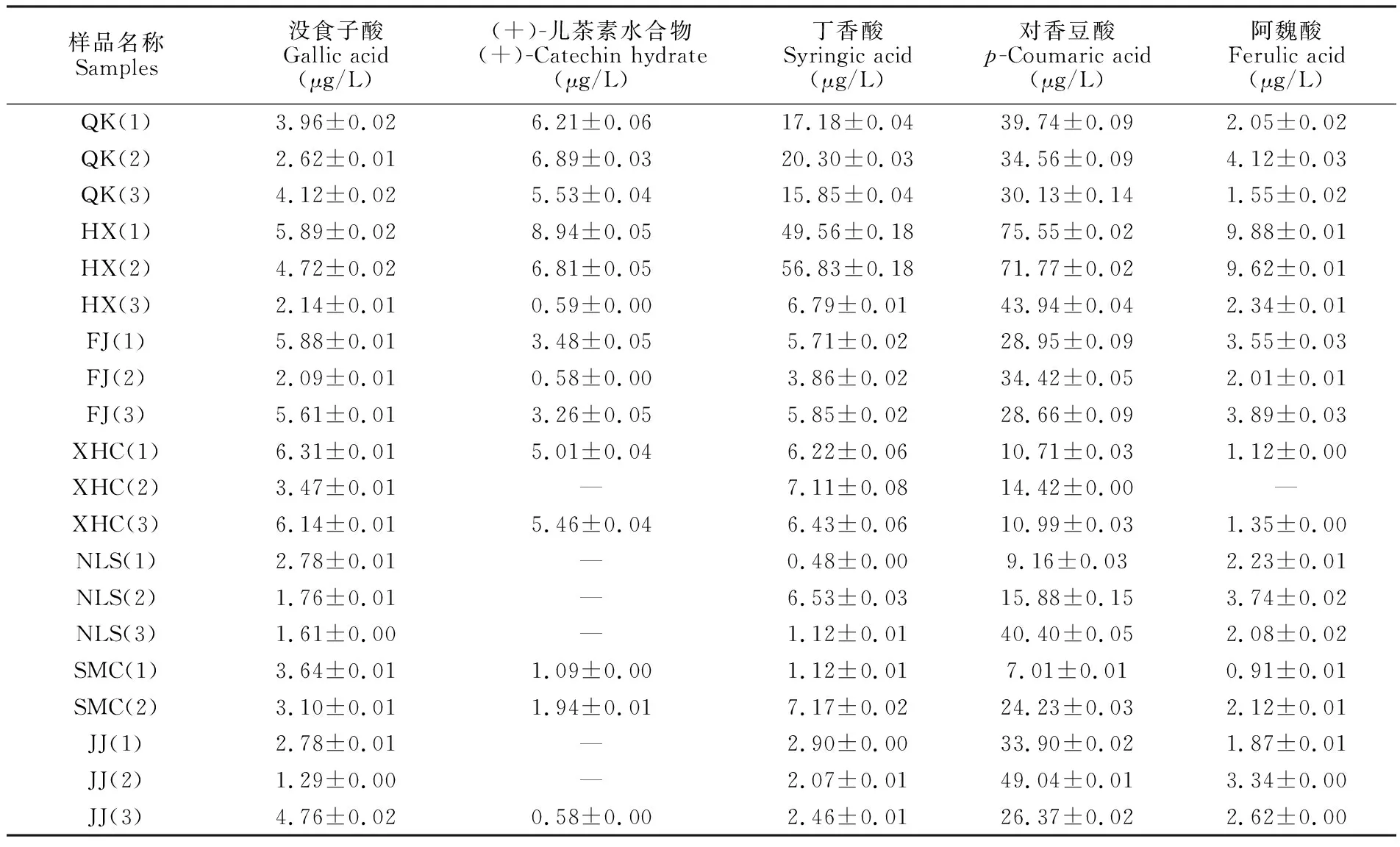
表4 20种清香型白酒中5种酚类活性化合物含量
3.7 不同香型白酒中酚类活性化合物含量对比
分别选取清香型(以青稞酒为代表)、浓香型、酱香型和芝麻香型白酒各3个样品进行分析,由表5可知,在12个不同香型白酒中,5种酚类活性化合物中,对香豆酸的平均含量最高,阿魏酸的平均含量最低,除(+)-儿茶素水合物外,其余4种酚类活性化合物均在4种不同香型的商品白酒中检出。5种酚类活性化合物的总量排序为:酱香型(141.01 μg/L)>清香型(64.94 μg/L)>芝麻香型(36.99 μg/L)>浓香型(27.73 μg/L)。在图5中,不同颜色代表不同含量, 从蓝色、绿色、黄色至红色代表酚类活性化合物的含量从低到高。从颜色变化趋势可以直观看出,酱香型白酒中的对香豆酸和(+)-儿茶素水合物含量高于其它香型白酒,清香型白酒中(+)-儿茶素水合物、丁香酸和对香豆酸的含量高于浓香型白酒和芝麻香型白酒,芝麻香型白酒中阿魏酸的含量较高。
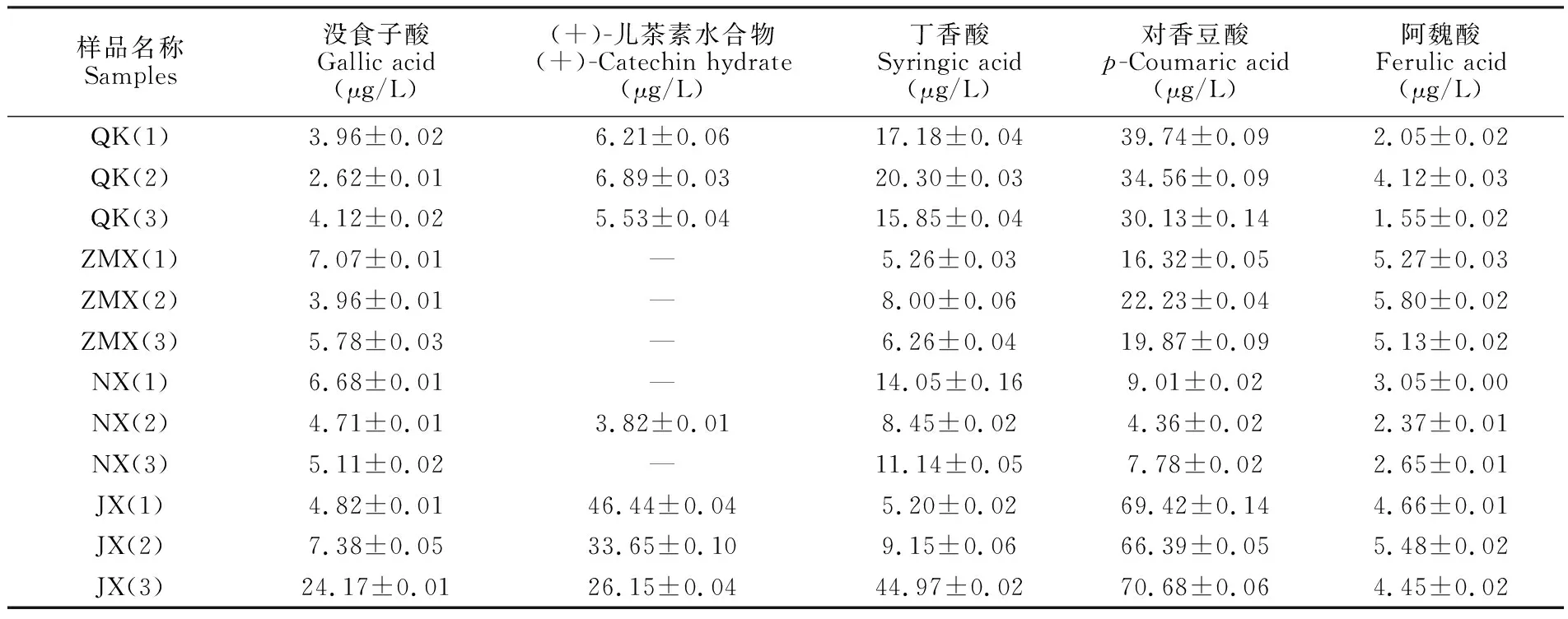
表5 清香型、浓香型、酱香型和芝麻香型白酒中5种酚类活性化合物含量
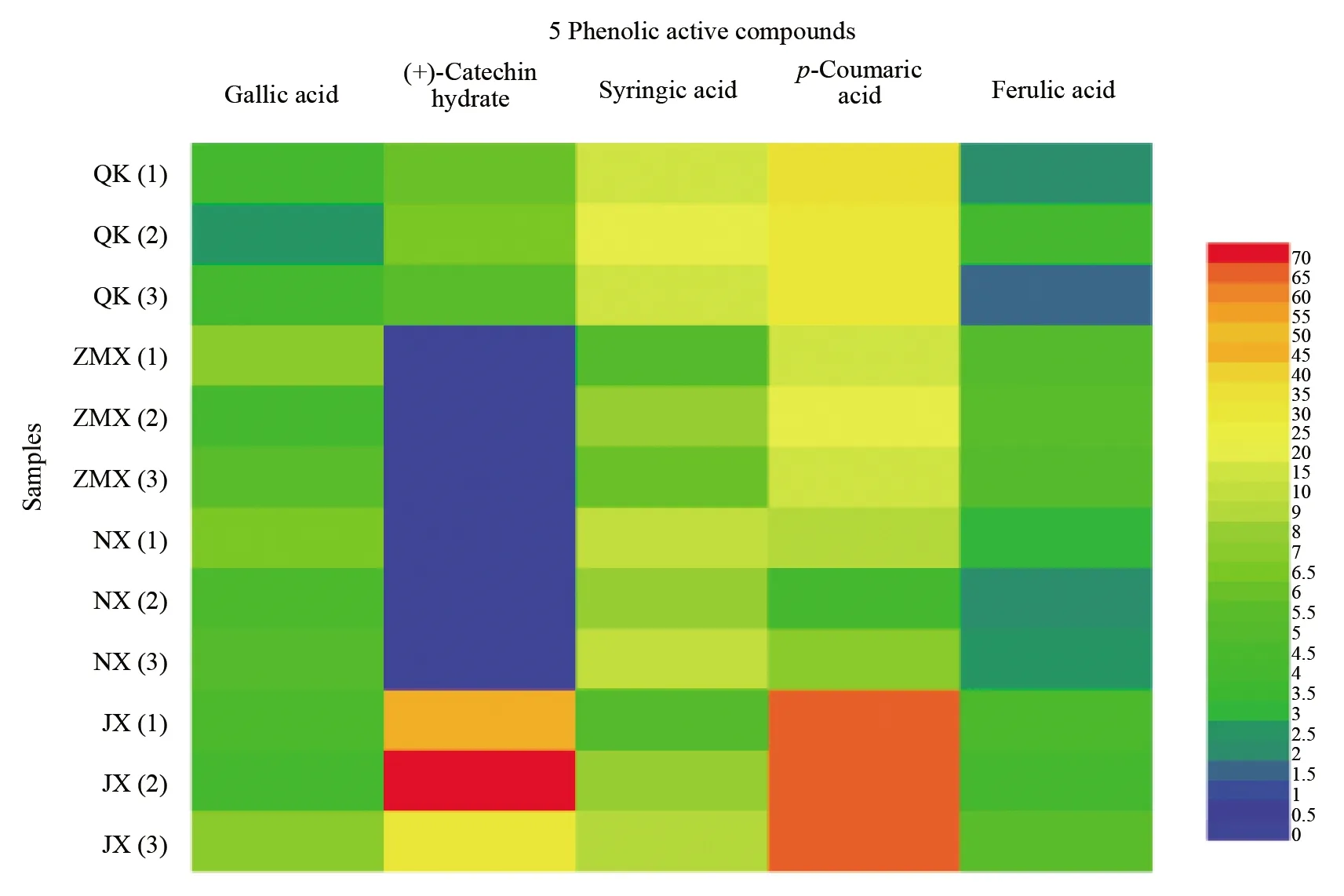
图5 4种不同香型商品白酒酚类活性化合物含量热图Fig.5 Heatmap of phenolic active compounds in 4 different types of commercial baijiu
4 结 论
建立了一种快速准确测定白酒中5种酚类活性化合物的方法, 优化了萃取条件。本方法的检出限为0.98~12.2 μg/L,加标回收率为84.1%~100.7%。不同贮酒容器青稞原酒中酚类活性化合物平均总量排序为:老陶坛>不锈钢大罐>新陶坛。贮存在新陶坛中的青稞酒原酒中的没食子酸和丁香酸含量较高,贮藏在不锈钢大罐中的青稞酒原酒中的(+)-儿茶素水合物和阿魏酸含量较高。通过聚类分析发现,贮酒容器不同导致青稞酒原酒中5种酚类活性化合物不同,可以为白酒的老熟后续的研究提供理论依据。不同品牌的清香型白酒中酚类活性化合物含量不同, 青稞酒中酚类活性化合物的平均含量高于多数清香型白酒, 不同香型白酒中酚类活性化合物含量不同。4种香型白酒中5种酚类活性化合物的总量排序为:酱香型>清香型>芝麻香型>浓香型, 其中,酱香型白酒中的对香豆酸和(+)-儿茶素水合物含量最高,芝麻香型白酒中阿魏酸的含量最高。
