固相萃取-同位素内标-气相色谱-质谱法测定纸质食品接触材料中4种氯丙醇的迁移量
2020-10-22胡启立左二伟吴海平
胡启立 左二伟 吴海平
(普研(上海)标准技术服务股份有限公司, 上海, 201318)
1 引 言
氯丙醇是丙三醇结构上的羟基被氯原子取代而成的一类化合物,主要包括3-氯-1,2-丙二醇(3-MCPD)、2-氯-1,3-丙二醇 (2-MCPD)、1,3-二氯-2-丙醇 (1,3-DCP)和2,3-二氯-1-丙醇(2,3-DCP),具有急、慢性毒性作用,易引起某些实验动物肿瘤,造成肾脏和生殖系统损伤, 是国际公认的食品污染物。纸质材料可以制成杯、碟 、碗等,被广泛用作食品容器和包装材料餐具等。纸制品生产过程中,常添加环氧氯丙烷以增强抗湿性。当纸制品接触到水、果汁和食物汤汁等时,其中含有的环氧氯丙烷可分解成氯丙醇,迁移到食品中,造成污染。目前,食品中氯丙醇含量监测主要是对食品加工贮藏过程中产生的氯丙醇污染的测定,而纸质食品接触材料中的氯丙醇污染的检测尚未引起足够重视。
目前,食品中氯丙醇含量的测定技术相对成熟,美国分析化学家协会标准AOAC2001.01《气相色谱-质谱联用法测定食品及食品添加剂中3-氯-1,2-丙二醇》和我国国家标准GB 5009.191-2016《食品中氯丙醇及其脂肪酸酯含量的测定》中,均是先经衍生化处理后,采用气相色谱-质谱联用法(GC-MS)进行测定。而食品接触材料中氯丙醇迁移量的测定尚无国家标准。2019年, 国家卫健委首次对纸制品中氯丙醇迁移量测定操作流程(以下称标准操作流程)进行了规定: 迁移试验结束后,用硅藻土小柱进行净化,经衍生后用GC-MS进行测定。按照标准操作流程进行实验时,发现衍生前未进行脱水处理,会导致测定结果的准确性和重复性差。本研究在标准操作流程基础上进行了改进,即采用内标法定量,在衍生化处理前, 正己烷复溶阶段加入无水Na2SO4脱水,方法定量准确、快速、稳定、灵敏度高,实现了4种氯丙醇(3-MCPD、2-MCPD、1,3-DCP和2,3-DCP)迁移量的同时测定,为食品接触材料中氯丙醇污染情况监测以及纸质餐具生产的质量控制提供了技术手段。
2 实验部分
2.1 仪器与试剂
TRACE1300/ISQ7000型气相色谱-质谱联用仪(美国赛默飞公司); 24位氮吹仪(上海安谱科学仪器有限公司); 旋转蒸发仪(上海爱朗仪器有限公司); VISIIPREP 24TMDL固相萃取仪(美国色谱科公司); TG-5MS毛细管色谱柱(30 m ×0.25 mm,0.25 μm,美国赛默飞公司); 大孔硅藻土SPE小柱(5 g/60 mL, 上海安谱实验科技股份有限公司)。
内标: 五氘代3-氯-1,2-丙二醇(D5-3-MCPD, 98.3%,美国o2si公司)。3-MCPD、2-MCPD(98.0%,德国Dr.Ehrenstorfer公司); 1,3-DCP(99.4%)、2,3-DCP( 99.6%)(北京曼哈格生物科技有限公司); 七氟丁酰基咪唑(97%,上海阿拉丁生化科技股份有限公司); 乙酸乙酯和正己烷(色谱纯 ,德国Merck公司)。
混合标准溶液: 以甲醇为溶剂,配制10 mg/L的3-MCPD、2-MCPD、1,3-DCP和2,3-DCP的混合标准溶液; 以正己烷为溶剂,配制10 mg/L的3-MCPD、2-MCPD、1,3-DCP和2,3-DCP的混合标准溶液。
2.2 前处理方法
迁移: 取圆形纸碗、方形纸碟、椭圆形纸碟以及圆形纸碟作为样品, 按照样品表面积和食品模拟液体积比为60 cm2/(100 mL)的比例分别加入10%乙醇, 在40℃水浴中浸泡2 h; 加入4%乙酸, 在40℃浸泡2 h; 加入异辛烷, 40℃浸泡0.5 h。
净化: 取迁移液5 mL, 加入内标D5-3MCPD, 混合后加入硅藻土固相萃取柱中, 静置10 min, 以10 mL正己烷淋洗, 弃去流出液, 以15 mL乙酸乙酯洗脱, 收集洗脱液, 氮吹浓缩至约0.5 mL。以2 mL 正己烷溶解残渣, 并转移至10 mL的具塞玻璃管中, 加入1 g无水Na2SO4混匀, 脱水。
衍生: 取净化液, 加入50 μL七氟丁酰基咪唑, 涡旋混合30 s, 于70℃保温30 min, 取出, 冷却至室温。加入2 mL 2 mol/L NaCl溶液, 涡旋混合1 min, 静置分层。移取正己烷相, 加入约0.3 g无水Na2SO4进行干燥, 后用0.22 μm滤膜过滤至进样小瓶中,供气相色谱-质谱仪测定。
2.3 气相色谱条件
色谱柱: TG-5MS(30 m×0.25 mm×0.25 μm), 程序升温: 初始温度50℃, 保持2 min, 以3℃/min升至90℃, 保持5 min, 再以20℃/min升至260℃。进样口温度: 230℃; 载气: 氦气, 纯度99.999%; 流速: 1.0 mL/min; 进样方式: 分流进样; 分流比: 10∶1。
2.4 质谱条件
离子源: 电子轰击(EI)源; 离子源温度: 280℃; 电离能量: 70 eV; 溶剂延迟: 6.0 min; 选择离子监测(SIM)模式, 4种氯丙醇及内标衍生物的定性离子及定量离子见表1。
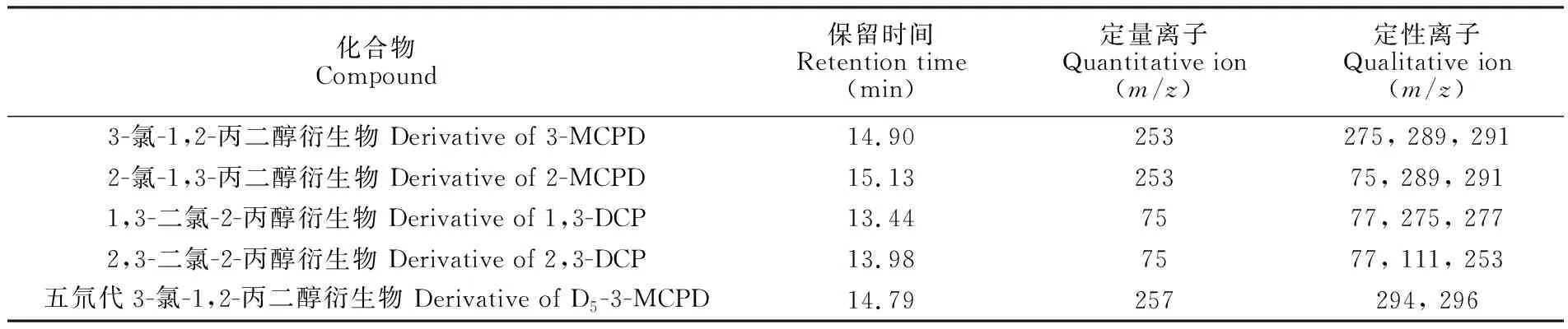
表1 4种氯丙醇及内标衍生物的质谱参数
3 结果与讨论
3.1 质谱参数的确定
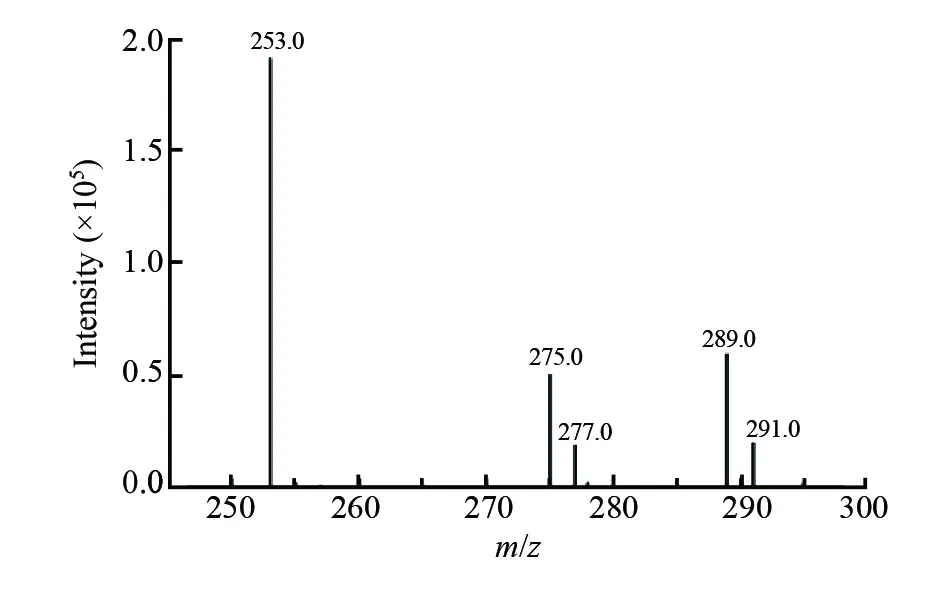
图1 3-氯-1,2-丙二醇衍生物的质谱图Fig.1 Mass spectrum of 3-chloro-1,2-propanediol derivative (3-MCPD)

3.2 迁移条件的选择
食品接触材料与食品接触时,由于材料本身残留或者用以改善其物理性能的化学物质会通过扩散或其它方式进入到食品中,该过程受多种因素的影响,例如温度和接触时间等 。由于不同食品的成分比较复杂,国际上普遍采用一定的化学试剂模拟食品, 即食品模拟物。根据国标GB31604.1-2015《食品接触材料及制品迁移试验通则》(以下简称迁移试验通则)对食品模拟物选择的规定,结合本实验样品纸碗和纸碟易接触食品的种类,选择10%乙醇和4%乙酸分别模拟水基和酸性食品。对于油基食品,迁移试验通则要求用橄榄油进行模拟迁移,但橄榄油迁移平衡所需时间较长,故采用国际上常用的异辛烷进行模拟迁移实验。根据迁移试验通则,对于一次性使用的食品接触材料及其制品,根据预期最极端接触时间,分别选择迁移时间为0.5 h和2 h; 根据预期最极端接触温度,选择迁移温度为40℃。
3.3 净化柱的选择
硅藻土具有天然“分子筛”状孔隙结构,具有很好的吸水性,可降低氯丙醇在水相的溶解度,被广泛用于氯丙醇分析。国标GB 5009.191-2016中即采用自填装的硅藻土柱进行净化。本实验分别采用硅藻土基质分散固相萃取柱 (1500 mg/50 mL,福州勤鹏公司)、氯丙醇专用固相萃取柱 (5 g/30 mL,博纳艾杰尔公司)、ProElutLLE硅藻土小柱(20 g/20 mL,迪马公司)和大孔硅藻土SPE小柱(5 g/60 mL,上海安谱公司)进行氯丙醇的净化处理。结果表明,大孔硅藻土SPE小柱对4种氯丙醇的净化效果最好,能有效去除杂质。
3.4 脱水阶段的选择
由于未经衍生的氯丙醇在气相色谱检测中不稳定,重现性较差,灵敏度较低,不能满足最低检测限的要求,故常用七氟丁酰基咪唑进行衍生后测定。但其对水非常敏感,在衍生化过程中,提取液中即使有微量水分也会导致衍生失效。因此,为了减少衍生时水分的影响,提取液需用无水Na2SO4进行脱水处理。分别考察了在洗脱液阶段用无水Na2SO4脱水和正己烷复溶阶段加入无水Na2SO4脱水对衍生效果的影响,分别做10次平行实验。以质量浓度为100 μg/L的3-氯-1,2-丙二醇标准溶液经衍生后所得衍生物峰面积对平行实验次数作图。正己烷复溶阶段脱水,10次平行实验所得峰面积均在同一水平,衍生效果稳定; 洗脱液阶段脱水,有两次实验所得峰面积很低,效果不稳定。由于洗脱液用无水Na2SO4脱水后,因氮吹过程时间较长,环境当中有微量水分进入,也会造成衍生失败。因此, 选择在正己烷复溶阶段加入无水Na2SO4进行脱水。
3.5 内标法和外标法的选择
按照标准操作流程的定量方法,即用4种氯丙醇衍生物峰面积与4种氯丙醇的质量浓度作图, 得到4条标准线性曲线,其线性相关系数R2均小于0.98,主要因为氯丙醇在净化时未能完全从硅藻土柱上洗脱,以及每个硅藻土固相萃取柱洗脱的差异性导致。为了消除前处理过程对实验结果的影响,采用加入D5-3-MCPD的内标法,降低这种系统差异性。结果表明,用内标法定量,4种氯丙醇的线性相关系数R2可达0.999。
3.6 线性范围和检出限
准确吸取4种氯丙醇混合标准甲醇溶液,分别用空白水基和酸性食品模拟液,得到浓度分别为 10 、 50、 100、 200和500μg/L 的系列标准工作液,并加入内标; 准确吸取4种氯丙醇混合标准正己烷溶液,用空白油基食品模拟物稀释定容,得到浓度分别为 10 、 50、 100、 200和500μg/L 的系列标准工作液,并加入内标。4种氯丙醇标准工作溶液经衍生化后,采用GC-MS测定。结果表明,4种氯丙醇的质量浓度在10~500 μg/L范围内与其衍生物峰面积呈线性关系,以3倍标准偏差(SD)计算方法的检出限,结果见表2。
3.7 回收率和精密度
选取圆形纸碗迁移实验后所得3种食品模拟液,在低、中、高3个浓度进行4种氯丙醇的加标回收实验,每个浓度平行测定6次,同时做空白实验,结果见表3。4种氯丙醇回收率在84.6%~112.0%之间,精密度(相对标准偏差, RSD)在1.0%~9.5%之间。

表2 食品模拟液中检测4种氯丙醇的分析参数
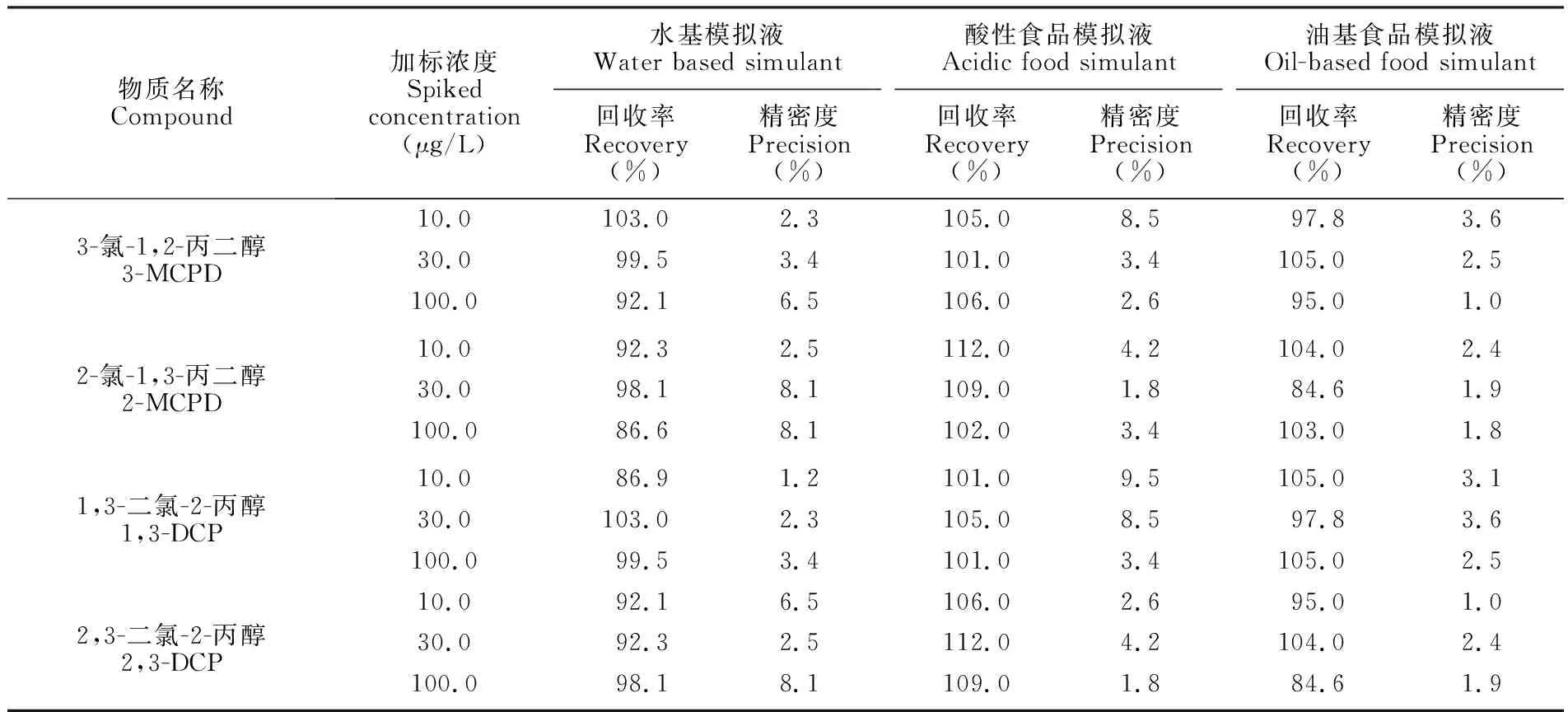
表3 3种食品模拟液中氯丙醇的回收率和精密度(n=6)
