去氢木香内酯抑制人肝癌细胞系HepG2增殖及促凋亡
2020-10-22苗加伟邓雪松李国利
苗加伟,陈 洁,邓雪松,2,熊 书,2,李国利,2,马 强,2*
(1.重庆三峡医药高等专科学校 基础医学部, 重庆 404120;2.重庆市抗肿瘤天然药物工程技术研究中心, 重庆 404120)
肝细胞癌(hepatocellular carcinoma, HCC)是全世界复发率高且预后不良的恶性肿瘤之一[1]。尽管手术治疗是目前治疗肝癌最为有效的手段,但病死率仍较高,5年生存期仅60%[2]。肝脏移植价格昂贵,但供体来源缺少,难以推广。因此,寻找有效且耐药性小的治疗药物一直是研究的热点。
木香为国内外常用药材,应用历史悠久[3]。去氢木香内酯(dehydrocostus-lactone,Dehy)为木香挥发油中含量较高的倍半萜内酯,亦是木香的主要生物活性成分[3]。Dehy具有广泛的生物学效应,如抗感染、抗菌、改善胃肠功能以及抗肿瘤作用,如白血病、肺癌、乳腺癌和卵巢癌等[4-7]。因此,推测Dehy可能是一种潜在的治疗癌的药物。但目前Dehy是否对肝癌细胞具有一定的抗癌活性尚不清楚。基于此,本研究旨在探讨Dehy对人肝癌HepG2细胞增殖和凋亡的作用及其机制,为肝癌的药物治疗提供更多的理论依据。
1 材料与方法
1.1 材料
人肝癌 HepG2细胞系(中国科学院上海细胞库);去氢木香内酯(纯度≥98%,成都曼思特生物科技有限公司,用DMSO配成100 mmol/L的储备液,临用前用完全培养基稀释到所需浓度);DMEM培养基(Hyclone公司);胰蛋白酶和胎牛血清(Gibco公司);DMSO和MTT试剂(Sigma-Aldrich公司);总蛋白提取试剂盒(武汉艾美捷科技有限公司);核蛋白提取试剂盒、Hoechst 33258染色液和4%多聚甲醛(北京索莱宝科技有限公司);BCA蛋白检测试剂盒(上海碧云天生物技术有限公司);彩色预染蛋白Maker(Biosharp公司);超敏ECL化学发光显色液(苏州新赛美生物科技有限公司);兔抗p-IκBα、IκBα、p-p65、p65、β-actin及PCNA一抗(Santa Cruz公司);山羊抗兔IgG H&L(HRP)二抗(Abcam公司)。
1.2 方法
1.2.1 细胞的培养及分组:将HepG2细胞置于DEME培养基中(含10%胎牛血清、100 U/mL青霉素及100 μg/mL链霉素),在37 ℃、5% CO2及饱和湿度下的恒温培养箱中培养。当贴壁细胞铺满底部90%左右时,加0.25%胰蛋白酶消化传代。取对数增殖期细胞进行实验。分为对照组(未加药,含0.1% DMSO)及Dehy各剂量组(终浓度分别为10、20、30、40和50 μmol/L)。
1.2.2 MTT法检测细胞增殖率:1×105个/mL的单细胞悬液接种到96孔板中,每孔100 μL,培养至细胞单层铺满孔底,弃去培养基。按上述分组加药处理细胞(对照组用完全培养基代替药物),100 μL/孔。24、48及72 h后,加入0.5% MTT溶液20 μL,继续培养4 h后小心吸除培养基,加入150 μL DMSO溶液,置摇床上低速振荡至结晶物充分溶解。用酶标仪测定各孔在490 nm波长处的吸光度(A值)。计算细胞抑制率=(对照组A值-各药物组A值)/对照组A值×100%。
1.2.3 Hoechst 33258荧光染色检测细胞凋亡:于6孔板中(孔底预置无菌盖玻片)加入浓度为1×105个/孔的对数增殖期单细胞悬液2.5 mL,过夜培养贴壁后,加药培养48 h后,弃去培养基,加入4%多聚甲醛溶液固定20 min,用PBS洗净固定液,加入0.5 mL Hoechst 33258工作液(5 mg/L),室温避光染色10 min,去除染色液,置于倒置荧光显微镜下观察细胞核的变化,拍照。细胞凋亡以细胞核呈蓝色致密浓染作为阳性标准,镜下每孔随机选择5个视野拍照,利用专业图像分析软件Image-Pro Plus 6.0计数凋亡细胞数(阳性细胞)和细胞总数,计算细胞凋亡率=阳性细胞数/细胞总数×100%。
1.2.4 Western blot检测NF-κB通路相关蛋白:将HepG2细胞以1×106个/瓶的浓度接种于细胞培养瓶中,待细胞贴壁后,实验组分别加入终浓度为10、20、30 μmol/L的Dehy,对照组加入3 mL含0.1% DMSO的完全培养基,培养48 h后,分别收集各组细胞,加入预先配置的RIPA细胞裂解液(内含1%蛋白酶抑制剂PMSF及1%磷酸酶抑制剂)100 μL,提取总蛋白。按核蛋白提取试剂盒说明书的步骤提取核蛋白。按BCA蛋白检测试剂盒操作流程测定蛋白浓度。每组取上样总蛋白50 μg,按Wesetern blot 实验步骤进行SDS-PAGE分离,电转到PVDF膜,5%脱脂奶粉4 ℃封闭12 h后,TBST缓冲液清洗PDVF膜,然后加入人抗兔p-IκBα、IκBα、p-p65、p65、β-actin、PCNA一抗(1∶1 000),于4 ℃下孵育过夜,TBST缓冲液漂洗,加入HRP标记的二抗(1∶2 000),室温孵育3 h,TBST缓冲液漂洗后用ECL显色剂显色,曝光,扫膜拍照。以β-actin作为内参蛋白,PCNA作为核内参蛋白,通过吸光度分析软件分析条带吸光度值,比较各组间差异。
1.3 统计学分析
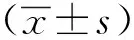
2 结果
2.1 Dehy对HepG2细胞增殖的影响
与对照组比较,各浓度Dehy分别作用于HepG2细胞24、48和72 h后,细胞增殖抑制率均显著升高(P<0.05或P<0.01),且呈浓度和时间依赖性(表1)。因药物在10、20和30 μmol/L的浓度时作用48 h后对细胞的增殖抑制率已经非常明显,故下面的实验均选取此浓度范围及作用时间点。

表1 不同浓度和时间Dehy对HepG2细胞增殖的抑制作用Table 1 Effect of dehydrocostuslactone on proliferation inhibition of HepG2
2.2 Dehy对HepG2细胞凋亡的影响
与对照组相比,各药物浓度组细胞的细胞核出现不同程度的致密浓染和固缩等凋亡现象(图1)。随着Dehy浓度的增加,凋亡细胞的数量也显著增加(P<0.05或P<0.01)(表2)。

图1 Dehy对HepG2细胞凋亡形态学的影响Fig 1 Effect of dehydrocostuslactone on apoptosis morphology of HepG2 cells (Hoechst 33258 staining,×200,n=5)

表2 各组HepG2细胞凋亡率比较Table 2 Comparison of apoptosis rates of HepG2 cells
2.3 Dehy对HepG2细胞NF-κB相关蛋白表达水平的影响
与对照组相比,随着Dehy浓度增加,细胞内p-IκBα和nuclear-p65(核内p65)蛋白表达水平明显下调(P<0.05或P<0.01),IκBα蛋白水平增高(P<0.05或P<0.01),而total-p65(胞内总p65)蛋白表达未见明显变化(图2A~C)。

A.Western blot analysis of the p-IκBα, IκBα, nuclear p65 and total p65 protein levels at 48 hours in HepG2 cells, β-actin and PCNA was used as control; B.effects of dehydrocostuslactone on nuclear p65 and total p65 protein expressions in HepG2 cells; C.effect of dehydrocostuslactone on IκBα and p-IκBα proteins expression in HepG2 cells; *P<0.05, **P<0.01 compared with control group图2 Dehy对HepG2细胞NF-κB相关蛋白表达的影响Fig 2 Effect of dehydrocostuslactone on the expression of NF-κB related proteins in HepG2
3 讨论
肿瘤形成是一个十分复杂的生物学过程,其生长取决于细胞增殖和凋亡之间的平衡[8],而抗肿瘤药物主要通过抑制肿瘤细胞增殖和促进凋亡发挥抗肿瘤作用[9]。Dehy含有的倍半萜类化合物结构能与含巯基的酶及其功能性蛋白酶发生反应,进而干扰细胞的代谢过程,具有多种药理活性的化合物[5]。Dehy在10~50 μmol/L浓度范围内对多种肿瘤细胞的增殖有较强的抑制作用[10]。本研究的细胞毒性结果表明,以上浓度的Dehy可明显抑制HepG2细胞的增殖,并呈剂量和时间依赖性。
细胞凋亡是一种程序性细胞死亡,表现为细胞皱缩、核染色质边集、凋亡小体形成等,也可出现核固缩、核碎裂等坏死表现[11]。Dehy可诱导多种肿瘤细胞凋亡[6]。在本研究中,不同浓度Dehy作用于肝癌细胞后,均出现明显的凋亡现象,且随着药物浓度增加,HepG2细胞的凋亡率显著增加,提示Dehy诱导人肝癌细胞凋亡。细胞凋亡由多种细胞信号传导通路相互“对话”(crosstalk)所介导[12]。NF-κB(nuclear factor-kappa B)是细胞内重要的核转录因子,参与调控细胞分化、增殖及凋亡等多种生理病理过程[12]。研究表明,NF-κB异常高表达与肝癌细胞的分化及患者的预后关系密切[13]。
抑制IκBα的磷酸化过程(减少p-IκBα生成),可以影响p65的磷酸化,使NF-κB异源二聚体p65-p50不易进入细胞核,因而可抑制NF-κB通路的活化,明显逆转肿瘤细胞的多药耐药[14];抑制NF-κB信号通路的激活能够促进肝癌细胞的凋亡[15]。本实验中,不同浓度Dehy处理后的HepG2细胞,p-IκBα和nuclear-p65蛋白水平明显下调,表明去氢木香内酯可下调HepG2细胞NF-κB通路,影响其下游基因转录,从而抑制细胞增殖,促进细胞凋亡。
综上所述,去氢木香内酯可抑制人肝癌HepG2细胞增殖和诱导凋亡,其可能的机制是下调NF-κB通路。在后续研究中,将对去氢木香内酯的药理作用及分子机制进一步深入挖掘,以期为去氢木香内酯的临床应用提供初步资料。
