miR-17-5p靶向乙醛脱氢酶2减少肺炎链球菌诱导的人肺腺癌肺泡基底上皮细胞系A549损伤
2020-10-22李维维唐建军骆财元冯圣芳
李维维,葛 斌,邓 涛*,唐建军,骆财元,冯圣芳,毛 羽
(成都市郫都区人民医院 1.儿科; 2.检验科, 四川 成都 611730)
肺炎链球菌(Streptococcuspneumoniae,S.pneumoniae)在自然界中广泛存在,严重威胁人类健康。感染S.pneumoniae易引起肺炎的发生[1]。肺泡上皮细胞是一种覆盖在肺组织肺泡上的一层细胞,肺泡上皮细胞凋亡是肺炎发生的主要病理变化[2]。研究表明,机体的炎性反应参与肺炎的发展过程[3]。微小RNA(microRNA,miRNA)是一类长度约为18~25个核苷酸的小分子单链非编码RNA,可在转录后抑制或降解mRNA,进而调控细胞的增殖、凋亡等生物学过程,与疾病的发生和发展密切相关。过表达miR-17-5p可通过调控Bax和Bcl-2蛋白,损伤大鼠肾上腺髓质嗜铬细胞瘤细胞系PC12,促进其凋亡[4]。H2O2诱导心肌细胞损伤后,miR-17-5p表达水平显著升高,高表达的miR-17-5p可加重H2O2诱导的心肌细胞的损伤[5]。但miR-17-5p在S.pneumoniae诱导的肺泡上皮细胞损伤中的表达及其对S.pneumoniae诱导的肺泡上皮细胞损伤的影响及其作用机制还未知。生物信息学软件预测显示,乙醛脱氢酶2(acetaldehyde dehydrogenase 2,ALDH2)是miR-17-5p的靶基因。ALDH2是NAD(P)+依赖性酶,参与调控细胞的增殖、凋亡等生命过程。研究显示,过表达ALDH2可通过清除脂质过氧化产物,保护高氧诱导的肺泡上皮细胞损伤[6]。但目前,miR-17-5p能否通过调控ALDH2表达影响肺泡上皮细胞损伤还未知。本研究主要探讨miR-17-5p对S.pneumoniae诱导的肺泡上皮细胞A549炎性因子IL-6和IL-10及凋亡的影响及其能否通过调控ALDH2表达发挥作用,以期为肺炎的靶向治疗提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞: 人肺腺癌肺泡基底上皮细胞系A549(human lung adenocarcinoma alveolar basal epithelial cell line A549)和肺炎链球菌BAA-255(S.pneumoniae)(ATCC公司)。
1.1.2 试剂及试剂盒: 胎牛血清(FBS)(浙江天杭生物科技股份有限公司);RPMI 1640培养基(北京索莱宝科技有限公司);Lipofectamine 2000转染试剂盒(Invitrogen公司);Trizol试剂、反转录试剂盒和PCR试剂盒(大连宝生物有限公司);PCR引物序列、miR-17-5p抑制剂和模拟物(mimics)及各自的阴性对照(上海生工生物工程有限公司);CXCL16表达质粒和空质粒(Addgene公司);抗-ALDH2抗体(艾美捷生物科技有限公司);Bcl-2和Bax抗体(Santa Cruz公司);白介素-6(IL-6)和白介素-10(IL-10)酶联免疫检测试剂盒(南京建成生物工程研究所);双荧光素酶报告基因检测试剂盒(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞的培养和分组处理:复苏A549细胞,加入含10% FBS的RPMI 1640培养基,置于37 ℃、5% CO2、97%湿度的培养箱中培养。待细胞汇合至80%左右时,用0.25%胰蛋白酶溶液消化,更换新鲜培养基,进行传代培养或用于后续实验。取对数增殖期的A549细胞分为对照组、感染组(1×108CFU/mL 的S.pneumoniae干预24 h[7])、anti-miR-17-5p干预组(S.pneumoniae感染前转染anti-miR-17-5p)、anti-miR-NC干预组(S.pneumoniae感染前转染anti-miR-NC)、pcDNA-ALDH2干预组(S.pneumoniae感染前转染pcDNA-ALDH2)、pcDNA干预组(S.pneumoniae感染前转染pcDNA)、anti-miR-17-5p与si-NC共同干预组(S.pneumoniae感染前共转染anti-miR-17-5p和si-NC),anti-miR-17-5p与si-ALDH2共同干预组(S.pneumoniae感染前共转染anti-miR-17-5p和ALDH2小干扰RNA)。转染具体步骤按照Lipofectamine 2000转染试剂盒说明书进行操作。
1.2.2 RT-qPCR检测miR-17-5p与ALDH2 mRNA水平:各组处理后的细胞,预冷PBS清洗后,Trizol试剂提取总RNA,微量核酸仪检测RNA纯度和浓度。用反转录试剂盒将RNA反转录为cDNA,然后以cDNA为模板进行PCR扩增。引物序列:miR-17-5p上游5′-CAAAGTGCTTACAGTGCAGGAAG-3′,下游5′-CGGCGAATGCGTGCGCCTGC-3′;U6上游5′-CC GGTGAAAGTCGACAGCTGAC-3′,下游5′-GTGTCC GCGCGGATAAAGTCG-3′;ALDH2上游5′-CCGAA AGTGCTGCTGACACGCGC-3′,下游5′-GTCCGAAA CGCCGTGTCCC-3′;GAPDH上游5′-GGTCACCAGG GCTGCTTT-3′,下游5′-GGATCTCGCTCCTGGAA GATG-3′。扩增条件为95 ℃ 10 min;95 ℃ 5 s,60 ℃ 30 s,共进行45个循环。miR-17-5p以U6为内参,ALDH2以GAPDH为内参,2-△△Ct法计算miR-17-5p与ALDH2 mRNA的相对表达水平。
1.2.3 Western blot检测ALDH2、Bcl-2和Bax蛋白表达:处理后的细胞,预冷的PBS清洗后,加入细胞裂解液提取总蛋白。BCA法测定蛋白含量。取30 μg蛋白,加入适量上样缓冲液,100 ℃煮沸5 min,行SDS-PAGE。电泳结束后,电转移至PVEF膜,5%脱脂牛奶室温封闭2 h。然后分别加入兔抗人ALDH2(稀释度1∶400)、兔抗人Bcl-2(稀释度1∶200)和兔抗人Bax(稀释度1∶200)抗体,4 ℃孵育过夜。次日,TBST洗膜后,加入羊抗鼠HRP标记的二抗(稀释度1∶500),室温孵育1 h。TBST洗膜后,加入ECL化学发光试剂,避光显影,凝胶成像系统曝光拍照。以GAPDH为内参,Image J软件分析蛋白条带吸光度值。
1.2.4 双荧光素酶报告基因实验验证miR-17-5p与ALDH2之间的关系:生物信息预测结果显示,ALDH2的3′UTR与miR-30b-3p的核苷酸序列存在结合序列,推测miR-17-5p可能调控ALDH2表达。构建ALDH2野生型质粒(WT-ALDH2)和ALDH2突变型质粒(MUT-ALDH2)。利用LipofectamineTM2000试剂盒将WT-ALDH2、MUT-ALDH2质粒分别与miR-17-5p mimics及阴性对照共转染至A549细胞,5 h后,更换新鲜培养基,继续培养至48 h。参照双荧光素酶报告基因检测试剂盒说明书,检测各组细胞的荧光素酶活性。
1.2.5 酶联免疫吸附剂(ELISA)检测酶IL-6和IL-10水平:处理细胞后,收集细胞培养上清液,3 500 r/min离心10 min,上清液-20 ℃保存备用。参照IL-6和IL-10 ELISA试剂盒操作说明书,检测各组细胞培养上清液中IL-6和IL-10水平。
1.2.6 流式细胞计量术检测细胞凋亡率:分别取106个处理后的细胞,预冷的PBS清洗,吸弃上清液,加入500 μL结合缓冲液,轻轻吹打混合均匀,制成单细胞悬液。然后依次加入5 μL annexin V和5 μL的PI,室温避光染色15 min,流式细胞仪检测细胞凋亡。
1.3 统计学分析
2 结果
2.1 miR-17-5p和ALDH2在S.pneumoniae诱导的A549细胞中的表达
与对照组比,感染组miR-17-5p水平显著升高(P<0.05),ALDH2 mRNA和蛋白水平显著降低(P<0.05)(图1,表1)。
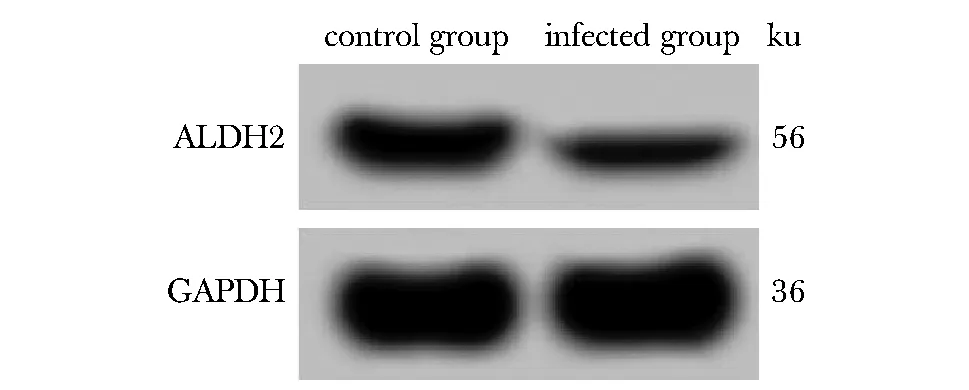
图1 Western blot检测ALDH2蛋白表达Fig 1 Western blot detected expression of ALDH2 protein

表1 miR-17-5p和ALDH2在S.pneumoniae诱导的A549细胞中的表达Table 1 Expression of miR-17-5p and ALDH2 in S.pneumoniae-induced A549 cells
2.2 miR-17-5p靶向调控ALDH2的表达
ALDH2的3′UTR中含有与miR-17-5p互补的核苷酸序列(图2)。miR-17-5p mimics可降低WT-ALDH2质粒的荧光素酶活性(P<0.05),而对MUT-ALDH2质粒的荧光素酶活性无显著影响(表2)。miR-17-5p组ALDH2蛋白表达显著低于miR-NC组(P<0.05),anti-miR-17-5p组ALDH2蛋白表达显著高于anti-miR-NC组(P<0.05)(图3,表3)。

图2 ALDH2的3′UTR中含有与miR-17-5p互补的核苷酸序列Fig 2 The 3′UTR of ALDH2 contains a nucleotide sequence complementary to miR-17-5p

表2 双荧光素酶报告实验Table 2 Dual luciferase reporter
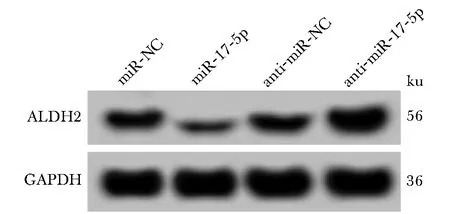
图3 Western blot检测ALDH2蛋白表达Fig 3 Western blot detected expression of ALDH2 protein
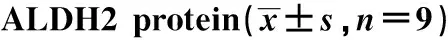
表3 miR-17-5p调控ALDH2蛋白的表达Table 3 miR-17-5p regulated the expression of
2.3 抑制miR-17-5p表达对S.pneumoniae诱导的A549细胞损伤的影响
与对照组比,感染组IL-10和Bcl-2水平显著降低(P<0.05),凋亡率、IL-6和Bax水平显著升高(P<0.05)。与anti-miR-NC干预组比,anti-miR-17-5p干预组IL-10和Bcl-2水平显著升高(P<0.05),miR-17-5p、凋亡率、IL-6和Bax水平显著降低(P<0.05)(图4,表4)。

A.Western blot analysis of apoptosis-related protein expression; B.apoptosis flow pattern图4 抑制miR-17-5p表达对S.pneumoniae诱导的A549细胞凋亡的影响Fig 4 Effect of inhibition of miR-17-5p expression on apoptosis of A549 cells induced by S.pneumoniae

表4 抑制miR-17-5p表达对S.pneumoniae诱导的A549细胞损伤的影响Table 4 Effect of inhibition of miR-17-5p expression on S.pneumoniae-induced A549 cell
2.4 ALDH2过表达对S.pneumoniae诱导的A549细胞损伤的影响
与pcDNA干预组比,pcDNA-ALDH2干预组ALDH2蛋白水平、IL-10和Bcl-2水平显著升高(P<0.05),凋亡率、IL-6和Bax水平显著降低(P<0.05)(图5,表5)。

图5 Western blot检测ALDH2和凋亡相关蛋白表达Fig 5 Western blot detected expression of ALDH2 and apoptosis-related protein

表5 ALDH2过表达对S.pneumoniae诱导的A549细胞损伤的影响Table 5 Effect of ALDH2 over-expression on S.pneumoniae-induced A549 cell
2.5 抑制ALDH2表达逆转了抑制miR-17-5p表达对S.pneumoniae诱导的A549细胞的损伤作用
与anti-miR-17-5p和si-NC共同干预组比,anti-miR-17-5p与si-ALDH2共同干预组ALDH2蛋白水平、IL-10和Bcl-2水平显著降低(P<0.05),凋亡率、IL-6和Bax水平显著升高(P<0.05)(图6,表6)。

图6 Western blot检测ALDH2和凋亡相关蛋白表达Fig 6 Western blot detected expression of ALDH2 and apoptosis-related protein

表6 干扰ALDH2表达逆转了抑制miR-17-5p表达对S.pneumoniae诱导的A549细胞损伤Table 6 Interfering with ALDH2 expression reversed the inhibitory effect of miR-17-5p expression on S.pneumoniae-induced A549 cells
3 讨论
miRNA在真核生物中广泛存在,参与调控肺炎、心血管疾病、肿瘤等各种疾病的发生和发展[8-10]。Ⅱ型肺泡上皮细胞在肺功能的维持、组织修复及免疫调节中发挥重要作用,由于A549细胞系具有Ⅱ型肺泡上皮细胞的结构和生化特征,被广泛应用于Ⅱ型肺泡上皮细胞模型[11]。本研究显示,S.pneumoniae诱导A549细胞后,miR-17-5p表达水平显示升高,提示miR-17-5p参与肺炎的发生过程。肺炎发生过程中,肺组织或细胞炎性因子的合成和释放增加[12]。促炎因子IL-6及抗炎因子IL-10参与肺炎的发展过程。如重症肺炎患者血清中IL-6表达水平升高,IL-10表达水平降低[13]。本研究显示,S.pneumoniae诱导A549细胞后,细胞培养上清液中IL-6水平升高,IL-10水平降低;而抑制miR-17-5p表达,降低了A549细胞IL-6的分泌,促进了IL-10分泌;表明抑制miR-17-5p表达可能通过抑制炎性反应降低肺炎发展进程。肺泡上皮细胞的凋亡与肺炎的发生密切相关[14]。Bcl-2表达的增加可抑制细胞凋亡;而Bax表达的增加则促进细胞凋亡。本研究显示,S.pneumoniae诱导A549细胞后,细胞凋亡率升高;而抑制miR-17-5p表达,S.pneumoniae诱导的A549细胞凋亡率降低,Bcl-2蛋白表达增加,Bax蛋白表达减少,提示抑制miR-17-5p表达可能通过促进Bcl-2蛋白表达,抑制Bax蛋白表达,从而降低S.pneumoniae诱导的A549细胞凋亡。
为了进一步探讨miR-17-5p保护S.pneumoniae诱导的A549细胞损伤的分子机制,本研究利用生物信息学软件预测显示ALDH2的3′UTR中含有与miR-17-5p互补的核苷酸序列,双荧光素酶报告实验结果证实,miR-17-5p可与ALDH2的3′UTR靶向结合。此外,上调细胞中miR-17-5p表达后,ALDH2蛋白表达降低;而下调miR-17-5p表达后,ALDH2蛋白表达升高。表明miR-17-5p负调控ALDH2表达。ALDH2属于乙醛脱氢酶家,主要参与乙醛的代谢。研究显示,ALDH2可能通过降低JNK信号通路的活性抑制心肌细胞凋亡,保护心肌缺血/再灌注损伤大鼠心肌损伤[15]。本研究显示,过表达ALDH2降低了S.pneumoniae诱导的A549细胞凋亡、Bax蛋白表达以及IL-6分泌,促进了Bcl-2蛋白表达和IL-10分泌,表明ALDH2参与肺炎炎性反应,其过表达抑制S.pneumoniae诱导A549细胞凋亡。本研究还显示,抑制ALDH2表达降低了抑制miR-17-5p表达对S.pneumoniae诱导的A549细胞炎性因子IL-6和IL-10表达及细胞凋亡,提示miR-17-5p通过调控ALDH2表达,降低S.pneumoniae诱导的A549细胞炎性反应和凋亡。
综上所述,抑制miR-17-5p表达,可降低S.pneumoniae诱导的肺泡上皮细胞A549炎性因子的表达及细胞凋亡,其作用机制可能与上调ALDH2表达有关,为肺炎的靶向治疗提供了新思路。
