乙型肝炎病毒X蛋白抑制肝癌细胞系中DKK2的表达
2020-10-22王晓艳权会琴
王晓艳,杜 虹,王 伟,权会琴
(空军军医大学唐都医院 传染科, 陕西 西安 710038)
原发性肝癌目前位于全球肿瘤相关死亡原因的第4位。肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的90%,主要归因于慢性乙型肝炎病毒(hepatitis B virus, HBV)感染、丙型肝炎病毒(hepatitis C virus, HCV)感染、酗酒和代谢综合征[1-2]。其中,HBV引起的慢性乙型肝炎是肝癌发生的最常见病因。乙型肝炎病毒X蛋白(hepatitis B virus X protein, HBx)是一种多功能调节因子,可促进肝细胞的致癌转化[3]。虽然HBx在HCC致病中的作用已有广泛研究,但HBx调控HCC进展的分子机制仍未完全阐明。
Wnt/β-catenin信号通路广泛参与到胚胎发育、稳态维持和肿瘤发生等多种过程,包括肝癌在内的多种癌中均已观察到Wnt/β-catenin信号通路的异常活化[4]。研究提示DKK2基因及其表观遗传沉默在Wnt/β-catenin信号通路的活化和HCC中发挥关键作用,但HBx是否通过表观遗传调控影响DKK2的表达尚不明确。本研究主要探讨肝癌细胞系中HBV X蛋白对DKK2表达的影响及其机制,为阐明HBV相关HCC的发生机制及干预治疗靶点的探索提供理论依据。
1 材料与方法
1.1 材料
人肝癌细胞系SMMC7721和HepG2均为本实验室保存。Ad-HBx由重庆医科大学感染性疾病分子生物学教育部重点实验室提供,构建方法见参考文献[5]。GFP腺病毒(Ad-GFP)由汉恒生物公司合成;siDnmt1腺病毒(Ad-siDnmt1)由上海生工生物公司制备;小干扰RNA siDnmt3a(西安擎科泽西生物科技有限公司);PCR引物由上海生工生物公司合成;反转录试剂盒使用罗氏Transcriptor First Strand cDNA Synthesis Kit;DKK2抗体(Abcam公司);Dnmt1、Dnmt3a和Dnmt3b抗体(CST公司);羊抗兔HRP(西安壮志生物公司)。
1.2 方法
1.2.1 细胞的培养及分组处理:将SMMC7721细胞和HepG2细胞用含有10%胎牛血清的DMEM培养,培养条件为37 ℃ 5% CO2,随后以1×105个/mL的浓度铺于6孔板的细胞培养皿中,贴壁后加入 Ad-GFP(MOI=10)和Ad-HBx(MOI=30)进行感染,24 h后在显微镜下观察其荧光强度,48 h后弃去培养基并收集细胞,用于后续实验。同时用1 μmol/L DAC处理细胞,或用Ad-siDnmt1(MOI=10)感染细胞,利用X-TremeGENE siRNA试剂转染小干扰RNA siDnmt3a,48 h后收样。
1.2.2 实时定量PCR检测HBx基因RNA:利用1 mL Trizol试剂裂解细胞,每管中加入200 μL三氯甲烷,4 ℃ 12 000 r/min离心1 h,吸上清于新的Ep管中;每管中加入等量的异丙醇,-20 ℃沉淀过夜;4 ℃ 12 000 r/min离心1 h,弃上清;每管中加入1 mL的75%无水乙醇,4 ℃ 12 000 r/min离心1 h,弃上清;晾干后加入20 μL的DEPC水溶解RNA;用ScanDrop定量仪测定RNA浓度。随后利用罗氏反转录试剂盒将1 μg总RNA反转录为cDNA,按照说明书中各组份的使用量在冰上配制20 μL RT反应混合液,反应条件为:50 ℃ 60 min,85 ℃ 5 min。靶基因的mRNA水平使用MIX试剂在罗氏Cobas 480上进行检测。GAPDH作为内部参照,最后使用2-△△Ct法计算各基因相对表达量。
1.2.3 Western blot检测DKK2及甲基化转移酶蛋白:采用BCA蛋白定量试剂盒进行蛋白定量。随后用12% SDS-PAGE胶分离蛋白,每孔上样量20 μg;250 mA恒流将蛋白转到PVDF膜;5%脱脂牛奶室温封闭2 h;一抗(1∶800)孵育4 ℃过夜;TBST清洗PVDF膜3次;加入羊抗兔HRP二抗(1∶5 000)室温孵育2 h;TBST洗涤后,加入底物发光剂 ECL 1 mL,在暗室用单层透明薄膜包裹后曝光胶片;拍照,利用Image J软件进行蛋白定量分析。
1.3 统计学分析
2 结果
2.1 Ad-HBx在肝癌细胞中感染效率
Ad-HBx感染肝癌细胞后,其中HepG2细胞感染效率达95%以上,SMMC7721细胞感染效率达90%以上。RT-qPCR检测发现,Ad-HBx感染肝癌细胞24 h后,与对照组相比,在HepG2和SMMC7721细胞中,HBx mRNA相对表达倍数分别上调61.12倍和50.24倍(P<0.05)(图1)。
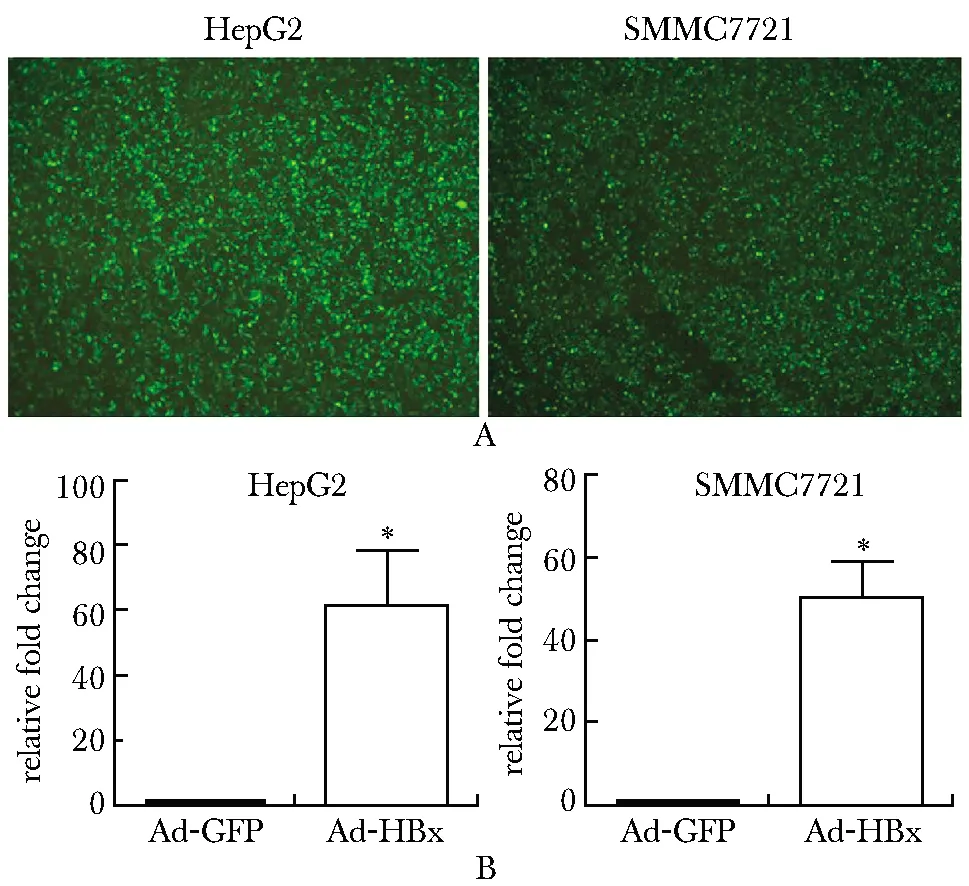
A.efficiency of infection as detected by GFP expression using fluorescence microscopy in HepG2 and SMMC7721; B.the mRNA expression levels of HBx was detected by quantitative real-time PCR; *P<0.05 compared with Ad-GFP图1 Ad-HBx在肝癌细胞中的感染效率Fig 1 Infective efficiency of Ad-HBx in hepatocellular
2.2 HBx下调DKK2的表达
Western blot结果显示,与Ad-GFP感染组相比,在HepG2和SMMC7721细胞中,Ad-HBx感染组中DKK2的表达均下降。通过软件量化分析条带发现,HepG2和SMMC7721细胞Ad-HBx感染组中DKK2蛋白表达分别下调1.61倍(P<0.05)和3.33倍(P<0.05)(图2)。

A.DKK2 expression at protein level was tested by Western blot; B.protein bands and quantitative analysis of DKK2 expression; *P<0.05 compared with Ad-GFP图2 HepG2和SMMC7721细胞中HBx对DKK2的表达影响Fig 2 Effect of HBx on DKK2 expression in HepG2
2.3 HBx上调甲基化转移酶Dnmt1和Dnmt3a的表达
相较于Ad-GFP感染组,Ad-HBx感染细胞系后,DKK2的蛋白表达水平下调2.65倍(P<0.05),Dnmt1上调3.15倍(P<0.05);Dnmt3a上调1.96倍(P<0.05),相较于Ad-HBx感染组,DAC处理后DKK2蛋白表达水平上调2.27倍(P<0.05);Dnmt1下调1.34倍, Dnmt3a下调1.78倍(P<0.05)(图3)。

A.after 1 μmol/L DAC treatment, the expression of DKK2,Dnmt1,Dnmt3a and Dnmt3b protein level was detected by Western blot; B.protein bands and quantitative analysis of DKK2,Dnmt1,Dnmt3a and Dnmt3b expression; *P<0.05 compared with Ad-GFP图3 SMMC7721细胞中HBx对DKK2、Dnmts的表达影响及DAC处理细胞后各蛋白的变化情况Fig 3 Influence of HBx on the expression of DKK2 and Dnmts and the changes of each protein after DAC treatment
2.4 沉默Dnmts后DKK2的表达水平部分恢复
相较于Ad-HBx处理组,Ad-siDnmt1组中DKK2蛋白表达水平上调5.21倍(P<0.05),si-Dnmt3a组中DKK2蛋白表达水平上调1.98倍(P<0.05)(图4)。

A.the protein expression of DKK2 after treatment with siDnmt1; B.the protein expression of DKK2 after treatment with siDnmt3a; *P<0.05 compared with Ad-GFP图4 SMMC7721细胞中Dnmt1和Dnmt3a对DKK2表达的影响Fig 4 Effect of Dnmt1 and Dnmt3a on DKK2 expression in SMMC7721
3 讨论
HBV病毒感染引起的慢性乙型肝炎是肝癌发生的常见致病因素,其编码的蛋白众多,其中以X蛋白的研究最为广泛深入。既往研究发现HBx的反式激活功能可以对体内的细胞内信号传导发挥重要作用,影响基因转录、表达和细胞分裂或增殖,从而在肝癌的发生进展中发挥关键作用[6]。DKK2是Wnt/β-catenin信号通路的负性调节因子, 已发现其在包括肝癌、肾癌、皮肤癌、不同星形肠癌等多种肿瘤中可出现异常表达[7-8]。然而,HBx是否通过影响DKK2的表达而导致肝癌的发生,目前仍不清楚。
本研究首次发现HBx引起DKK2在肝癌细胞系中表达下降,应用甲基化酶抑制剂处理肝癌细胞后DKK2表达有所上调,表明DKK2可能由于表观遗传修饰而被抑制。肝癌的发生是一个复杂的过程,涉及多种表观遗传异常。其中,启动子DNA甲基化是一种主要的表观遗传事件,导致肝癌中众多抑癌基因的沉默。抑癌基因甲基化水平升高是肝癌的一个重要标志,并与肝癌的发生、发展密切相关。有研究认为,相较于人正常肝组织,在肝癌组织中DKK3 mRNA表达水平降低,甲基化发生率、甲基化水平更高,提示DKK3启动子高甲基化可能是肝硬化向肝癌转变的一个重要事件[9]。HBx通过甲基化沉默肿瘤组织中的SFRP1和SFRP5的表达,激活Wnt/β-catenin信号通路,促进肝癌进展的发生[10]。
DNA甲基化是主要由DNA甲基转移酶(Dnmts)家族产生和维持的可逆化过程,抑制Dnmts可以作为治疗肿瘤的靶标[11]。DNA甲基转移酶家族包括Dnmt1、Dnmt3a和Dnmt3b,其中Dnmt1负责维持甲基化,可作用于几乎所有体细胞中存在的半甲基化底物上。研究显示,肿瘤组织中Dnmt1的表达相比于非肿瘤组织有所升高[12]。本研究观察到HepG2细胞系中DKK2的下调和甲基化转移酶Dnmt1的过表达呈正相关,这与既往研究结果一致。Dnmt1或Dnmt3a的沉默几乎完全消除了HBx诱导肿瘤抑制基因的DNA甲基化的潜力[13],表明HBx对肿瘤抑制基因的启动子过度甲基化需要这两种酶的调控。其原因可能为HBx通过E2F位点上调启动子活性来激活Dnmt 1的表达[14]。此外,Dnmt抑制剂通常通过上调肿瘤抑制因子如p14、p16和p21来抑制细胞增殖[15]。由于抑制Dnmt可导致高甲基化基因的去甲基化,因此推测Wnt通路负调节因子的高甲基化所致的基因下调可能是Wnt/β-catenin活化的原因之一。Wnt/β-catenin下游通路分子(如β-catenin、c-Myc、cyclin-D1等)的变化有待于进一步研究验证。
本研究表明HBx可通过调控DNA甲基转移酶1,3a来下调DKK2的表达,进而从表观遗传学的角度初步阐明了HBV相关肝癌的可能发生机制,为干预治疗靶点的探索提供了新的理论依据。
