GPRC5A促进人骨肉瘤细胞系143B迁移和侵袭
2020-10-22程安源
宋 奇,程安源,余 铃,徐 立*
(武汉市第一医院 骨科, 湖北 武汉 430022; 2.武汉大学人民医院 骨科, 湖北 武汉 430060)
骨肉瘤(osteosarcoma, OS)是一种好发于儿童和青少年长管状骨干骺端的恶性肿瘤,早期容易出现远处转移,肺脏是最常见的转移部位。由于缺乏早期诊断手段,据估计,有15%~20%的骨肉瘤患者在确诊时已经出现远处转移。对于局限性骨肉瘤患者,经过规范诊疗后,患者5年生存率可达65%~70%,而对于发生转移的骨肉瘤患者,缺乏有效的治疗手段,患者预后较差,5年生存率仅20%左右[1-2]。因此,寻找骨肉瘤早期转移的分子标记、探究骨肉瘤早期转移的分子机制、寻找新的药物作用靶点,对于骨肉瘤患者的早期诊断和个体化治疗具有重要意义。
本研究利用GEO(Gene Expression Omnibus)数据库中数据集GSE32981及TCGA数据库(The Cancer Genome Atlas)中骨肉瘤患者的临床数据,利用生物信息学手段进行联合分析,筛选出感兴趣基因,并通过后续的实验进行验证,以期为阐明骨肉瘤转移的分子机制及相关药物的开发提供研究基础。
1 材料与方法
1.1 材料
人骨肉瘤143B细胞系(中国科学院上海细胞库);α-MEM培养基和胎牛血清(Gibco公司);1%双抗(青霉素100U/mL, 链霉素100μg/mL)、胰蛋白酶(武汉谷歌生物科技公司);Cell Counting Kit-8 (CCK-8)(上海碧云天生物科技有限公司);抗E-Cad、N-Cad、Vim和GAPDH一抗(CST公司);抗GPRC5A一抗(SCBT公司);PC3.1-EGFP-Flag和PC3.1-GPRC5A-Flag过表达载体及GPRC5A特异性siRNA序列(siGPRC5A)及对照组序列(siNeg)(武汉生工生物工程公司)。
1.2 方法
1.2.1 生物信息学分析:使用R软件对原始数据集GSE32981进行差异基因的筛选和数据的可视化,设置筛选条件为:|log2(Fold Change)|>1且P<0.05,结合TCGA数据库中骨肉瘤转录组数据以及患者临床特征对差异基因进行生存分析。数据集GSE126209用来分析骨肉瘤肿瘤组织和相应正常组织中GPRC5A表达水平。
1.2.2 细胞的培养及转染:用含有10%胎牛血清和1%双抗的α-MEM培养基培养人骨肉瘤143B细胞,隔天换液,取对数期细胞进行实验。细胞转染时,将143B细胞接种在6孔板中,待细胞汇合度为60%~70%后,弃掉培养基,PBS洗涤2次后,加入1 mL培养基,根据转染试剂说明书,将质粒(PC3.1-EGFP-Flag或PC3.1-GPRC5A-Flag)或者siRNA(siNeg或siGRPC5A)转染至HepG2细胞中,共包括4组:siNeg组、siGPRC5A组、EGFP组和GPRC5A组。
1.2.3 CCK-8法检测细胞增殖:将转染48 h后的143B细胞重悬,调整细胞浓度为5×104个/mL,取100 μL接种在96孔板中,待接种8、24、48和72 h后,每孔加入10 μL CCK-8试剂,培养箱中避光孵育1 h后,用全自动多功能酶标仪检测每孔细胞在450 nm波长下的吸光度值(A)。
1.2.4 划痕实验:将143B细胞接种在6孔板中,待细胞汇合度达60%~70%后,转染GRPC5A过表达质粒和特异性siRNA及各自对照组,转染后8 h换液,待6孔板底细胞汇合度达100%,在各组细胞6孔板底划出“十”字线,用无血清的α-MEM培养基继续培养24 h后,用倒置显微镜观察划痕愈合度,拍照记录。
1.2.5 Transwell小室法侵袭实验:用α-MEM不完全培养基重悬转染48 h后的143B细胞,调整细胞浓度为5×105个/mL,在Transwell小室上室中加入200 μL细胞悬液,下室中加入500 μL完全培养基。继续培养48 h后,用PBS清洗Transwell小室,4%多聚甲醛室温固定30 min后,用结晶紫染液染色20 min,使用倒置显微镜拍照,计数,每组重复3次。
1.2.6 RT-qPCR检测GPRC5A和EMT相关基因的表达:收集各组细胞,Trizol法提取总RNA,取1 μg总RNA反转录成为cDNA后,进行实时荧光定量PCR检测,条件设置为:预变性94 ℃, 2 min;变性94 ℃ 30 s, 退火60 ℃ 30 s, 延伸 72 ℃ 30 s,共计45个循环,采用2-ΔΔCt法计算各基因表达水平。RT-qPCR引物(表1)。

表1 RT-qPCR实验的引物序列Table 1 Primer Sequence of RT-qPCR
1.2.7 Western blot检测GPRC5A和EMT相关蛋白的表达:收集各组细胞,提取总蛋白,用BCA法蛋白定量后取10 μg总蛋白,进行10%或12% SDA-PAGE蛋白胶电泳分离,转膜后室温封闭1 h,TBST洗涤3次将条带置入相应的一抗中孵育过夜。TBST溶液振摇洗涤3次,将条带置于辣根过氧化物酶标记的二抗(1∶3 000稀释)中室温摇床孵育1 h。用TBST洗涤3次后,将条带置于ECL试剂盒A液和B液混合液(1∶1混合)中,然后进行曝光分析。蛋白表达水平=目的蛋白吸光度值/GAPDH的吸光度值。
1.3 统计学分析
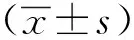
2 结果
2.1 骨肉瘤转移瘤生物信息学分析
数据集GSE32981含有23个人骨肉瘤组织样本,其中原发瘤12个,转移瘤11个。与原发瘤相比,转移瘤中有299个基因表达水平发生改变(图1A,B)。

A.volcano map of differentially expressed genes in GSE32981 data set; B.heatmap of differentially expressed genes in GSE32981 data set图1 骨肉瘤原位瘤和转移瘤差异基因分析Fig 1 Differential expression genes analysis in primary and metastatic osteosarcoma
2.2 差异基因生存分析
分析TCGA数据库中骨肉瘤患者的临床信息,发现有2 310个基因的表达水平与骨肉瘤患者生存相关(P<0.05),有37个基因在骨肉瘤转移瘤中差异表达(图2A)。其中,GPRC5A在转移瘤中上调明显(P<0.01)(图2B)并且高表达与骨肉瘤患者生存差相关(P<0.05)(图2C)。此外,与正常组织相比,骨肉瘤组织中GPRC5A表达明显增高(P<0.01)(图2D)。

A.Venn diagram of differentially expressed genes in GSE32981 data set and genes related to survival in TCGA data set; B.heatmap of the 37 genes in primary and metastasis osteosarcoma; C.survival analysis of osteosarcoma patients with different expression level of GPRC5A; D.the expression of GPRC5A in osteosarcoma sample and adjacent normal图2 骨肉瘤转移瘤差异基因生存分析Fig 2 Survival analysis of differential expression genes in primary and metastatic n=3)
2.3 骨肉瘤143B细胞中GPRC5A敲低或过表达效率验证
siGPRC5A组细胞中GPRC5A的mRNA和蛋白表达水平低于siNeg组(P<0.01,P<0.05)(图3A~C);GPRC5A组细胞中GPRC5A的mRNA和蛋白表达水平显著高于EGFP组(P<0.01)(图3D~F)。

A.after transfection with siGPRC5A, the expression of GPRC5A were detected by RT-qPCR; B.Western blot; C.quantitative analysis of Western blot; D.after transfection with GPRC5A over-expression plasmid, the expression of GPRC5A were detected by RT-qPCR; E: Western blot; F: quantitative analysis of Western blot; *P<0.05,**P<0.01 compared with siNeg or EGFP图3 RT-qPCR和Western blot检测各组细胞中GPRC5A表达水平Fig 3 RT-qPCR and Western blot detected the expression levels of GPRC5A in different n=3)
2.4 GPRC5A对骨肉瘤细胞增殖的影响
与siNeg组相比,siGPRC5A组细胞增殖能力无显著改变(图4A)。与EGFP组相比,GPRC5A组细胞增殖能力无显著改变(图4B)。
2.5 GPRC5A对骨肉瘤细胞迁移和侵袭的影响
GPRC5A组24 h后划痕愈合明显,而siGPRC5A组24 h后未见明显愈合(图5A,B)。GPRC5A组24 h后侵袭穿过Transwell小室和基质胶的细胞数目明显增多,而siGPRC5A组24 h后穿过Transwell小室和基质胶的细胞数目显著减少(图5C)。
2.6 GPRC5A对骨肉瘤细胞EMT相关基因表达的影响
敲低143B细胞中GPRC5A的水平,可引起E-Cad的mRNA和蛋白水平显著升高, Vim的mRNA和蛋白水平显著降低(图6A~C),而GPRC5A过表达143B细胞中E-Cad的mRNA和蛋白水平显著降低,N-Cad和Vim的mRNA和蛋白水平显著升高(图6D~F)。

A.after transfection with siGPRC5A, the expression of EMT associated genes were detected by RT-qPCR; B.Western blot; C.quantitative analysis of Western blot; D.after transfection with GPRC5A over-expression plasmid, the expression of EMT associated genes was detected by RT-qPCR; E.Western blot; F.quantitative analysis of Western blot; *P<0.05,**P<0.01 compared with siNeg or EGFP group图6 GPRC5A对骨肉瘤细胞EMT相关基因mRNA和蛋白表达的影响Fig 6 Effect of GPRC5A on the mRNA and protein levels EMT associated markers of osteosarcoma n=3)
3 讨论
GPRC5A(G protein-coupled receptor family C, member 5, group A)是G蛋白偶联受体C型家族5A基因的简称,位于人12号染色体上,其编码的蛋白质含有7个跨膜结构域,广泛参与细胞内信号传导,并参与调控细胞增殖、分化、凋亡等生物学过程,与肿瘤的发生、发展、转移密切相关[3-4]。目前关于GPRC5A与肿瘤的研究集中在肺癌、胃癌和乳腺癌中, 研究表明[5],GPRC5A是肺癌特异的抑癌基因,但在胃癌和乳腺癌中,高表达的GPRC5A能起到癌基因的作用,而GPRC5A在骨肉瘤中的作用目前还未见报道。
本研究通过分析公共数据库发现GPRC5A在骨肉瘤转移瘤中高表达并与患者的生存密切相关,并且在肿瘤组织中的表达也高于相应的正常组织,提示GPRC5A在骨肉瘤的发生和转移中可能发挥重要作用。为进一步探究GPRC5A在骨肉瘤中的作用,本研究检测GPRC5A敲低或过表达对骨肉瘤细胞增殖、迁移和侵袭的影响,结果表明,GPRC5A不影响骨肉瘤细胞增殖,GPRC5A过表达的骨肉瘤细胞迁移和侵袭能力显著提高,敲低骨肉瘤细胞中GPRC5A表达水平能显著抑制骨肉瘤细胞的迁移和侵袭,这些结果表明GPRC5A能促进骨肉瘤的转移。
上皮-间充质转化(epithelial-mesenehymal transition, EMT)是具有黏附性的上皮细胞失去极性,向无极性的具有高度迁移和侵袭能力的间质细胞转化的过程[6],伴随着上皮表型蛋白如E-cad的减少,间充质表型蛋白如N-cad, Vim的增多[7]。本研究表明,GPRC5A过表达能引起间充质表型蛋白N-Cad和Vim的水平显著升高,敲低骨肉瘤细胞中GPRC5A可引起上皮表型蛋白E-Cad显著升高,说明GPRC5A过表达可能是通过促进骨肉瘤细胞发生EMT进而促进其迁移和侵袭。不过,本研究仅从细胞水平探究GPRC5A对骨肉瘤细胞迁移和侵袭的影响,而骨肉瘤的转移是一个在体发生的多阶段、多因素参与的复杂过程[8],因此,在动物水平上验证GPRC5A对骨肉瘤转移的影响有待后续进一步研究。
综上所述,本研究表明,GPRC5A能通过诱导EMT促进骨肉瘤细胞迁移和侵袭,并与骨肉瘤患者生存密切相关,可作为抗骨肉瘤转移药物潜在作用靶点。
