藏药短管兔耳草血中移行成分及其与XOD 分子对接研究*
2020-10-22谢雄雄谢晶曾金祥张晨辉李敏梁健朱继孝钟国跃罗光明姚鹏程桂雅琪江西中医药大学中药资源与民族药研究中心南昌330004
★ 谢雄雄 谢晶 曾金祥* 张晨辉 李敏 梁健 朱继孝 钟国跃 罗光明 姚鹏程 桂雅琪(江西中医药大学中药资源与民族药研究中心 南昌 330004)
痛风严重影响人们的身体健康,而高尿酸血症是痛风最重要的生化基础。基于黄嘌呤氧化酶(XOD)抑制剂降低体内尿酸浓度是痛风治疗的重要方法之一。临床应用的XOD 抑制剂如别嘌呤醇,奥西嘌呤和非布索坦(Febuxostat)等虽可降低体内尿酸水平,但具有严重的毒副作用。因此,亟待开发新型XOD 抑制剂以开发安全有效的降尿酸新药。
短管兔耳草又名红林,为玄参科兔耳草属植物LagotisbrevitubaMaxim 的全草,是藏药“洪连”的主要基原植物[1-3]。短管兔耳草具有多种药理活性,是二十五味余甘子汤,智托洁白丸,二十味沉香丸等一百余个藏药成方制剂的主要成分。虽然短管兔耳草在临床上被广泛使用,但其药效物质基础研究尚少。本课题组前期研究[4]表明,短管兔耳草具有很好的降尿酸效果,抑制XOD 活性是其重要的降尿酸途径,且具有很高的安全性。这说明筛选短管兔耳草中XOD 抑制剂对于开发安全有效的降尿酸新药具有重要意义。
当前传统药用植物中的XOD 抑制剂多采用先提取得到提取物,进行分离纯化得到单体化合物,然后再运用体外活性测试方法进行筛选。这种方法往往周期长、盲性大,因此有必要开发新的策略快速筛选短管兔耳草中的XOD 抑制剂以促进降尿酸新药开发。血清药理学认为对血中移行成分进行分析可快速发现药用植物中的潜在的活性成分[5],UPLC-Q-TOF/MS 技术因具有高灵敏度、高分辨率等优势已成为天然产物成分鉴定的有力工具[6],分子对接技术可以模拟化合物与XOD 的作用方式,并通过结合能与打分函数评价化合物潜在的活性,已成为药物筛选研究的重要方法[7-8]。基于这三方面的优越性,本研究采用UPLC-Q-TOF/MS 技术鉴定藏药短管兔耳草血中移行成分,应用分子对接技术评价血中移行成分潜在的XOD 抑制活性并进行体外活性验证,以为后续基于短管兔耳草的降尿酸新药开发奠定物质与理论基础,并为其它天然产物中XOD 抑制剂研究提供新策略。
1 材料
1.1 仪器 Triple-TOF®5600+高分辨质谱仪(AB SCIEX 公司);岛津LC-30A-SPD-M20A 超高效液相色谱仪(SHIMADZU 公司);YMC-Triart C18分析柱YMC 公司,100×2.1 mm I.D,1.9μm);5 mL 固相萃取小柱(Sepax Technologies,Inc);AL204 型电子分析天平(Mettler Toledo 上海有限公司);Millipore-Simplicity 超纯水处理系统(Merck millipore 公司);BUCHI 电动旋蒸蒸发仪(BUCHI Labortechnik AG 公司);AllegraTM64R 型高速离心机(Beckmancoulter公司);DFY-400 型摇摆式中药粉碎机(温岭市林大机械有限公司);全波长酶标仪(Theromo Fisher Scientitific Oy Ratastie2,FI-1620 Vabtaa,Finland)。
1.2 试剂和药品 甲醇(天津恒星化学试剂制造有限公司),乙腈(色谱纯,德国 Merck 公司)。短管兔耳草购于成都荷花池药材市场,经江西中医药大学钟国跃教授鉴定为短管兔耳草LagotisbrevitubaMaxim.的干燥全草。大车前苷(成都曼思特生物科技公司,纯度≥98%,批号MUST-16041508)。黄嘌呤(批号:B16L83O5514)、木犀草素-3,7-O-葡萄糖醛酸苷(批号:P23S7F21843)、citric acid(批号:SM0425GA14)、loganic acid(批号:P01A9L67130)、Apocynin(批号:AJ0708FA14)、p-Coumaric acid(批号:Y16O8C45561)、壬二酸(批号:Y25J7C16724)、大车前苷(批号:W22A7M13372)均购于上海源叶生物科技有限公司。Chrysoeriol-7-O-glucuronide(实验室自制),黄嘌呤氧化酶(XOD)试剂盒(南京建成研究所,批号:20180318),别嘌呤醇(美国Sigma 公司,AP,081M1112V)PBS 缓冲液(北京Solarbio 公司,批号:20171008),其余试剂均为分析纯。
1.3 实验动物 SD 雄性大鼠4 只,体重180~220 g,由湖南斯莱克景达实验动物有限公司提供,SPF 级,合格证号SCXK(湘)2013-0004,实验期间室温(24±2)℃,相对湿度40 %~75 %,实验开始前适应性饲养1 周。实验经江西中医药大学实验动物伦理委员会审查批准(编号JZLLSC2017016)。
2 方法与结果
2.1 方法
2.1.1 短管兔耳草总提取物溶液制备 短管兔耳草粉碎,过4 号筛。取10 g 粉末用100 mL 的65%乙醇溶液浸泡过夜,然后回流提取1 h。冷却后过滤,残渣再加入100 mL 65%乙醇溶液重复提取一次。两次所得滤液合并,减压回收溶剂至无醇味。加水配置得生药浓度为0.2 g/mL 短管兔耳草提取物溶液。
2.1.2 血清样品的制备及代谢产物的收集 SD 大鼠随机分为空白组与给药组,每组2 只。给药组给予短管兔耳草提取物,剂量为2 g/kg,每日2 次,给药3天,末次灌胃前12 h 禁食不禁水。末次灌胃后,给药组大鼠分别于0.5 h,1 h,1.5 h,2 h,2.5 h 眼眶取血。空白组大鼠则给予生理盐水,其余操作与给药组相同。所得样品在4 ℃以5000 r/min 离心10 min,取上清液为血清样品,于-80 ℃保存备用。
2.1.3 血清样品处理 取血清0.5 mL,加入10 μL磷酸,涡旋30 s,然后用固相萃取柱进一步处理。固相萃取柱预先依次以2 mL 甲醇、2 mL 水活化。上样后先用1 mL 水淋洗,再以2 mL 甲醇洗脱,收集甲醇洗脱液,40 ℃下氮气吹干,加200 μL 甲醇复溶,在4 ℃条件下以13 000 r/min 离心10 min,取上清液进UPLC-Q-TOF/MS 分析,进样量为7 μL。
2.1.4 UPLC-Q-TOF/MS 方法 液相方法:梯度洗脱,流动相A 为0.2%甲酸水溶液,B 为乙腈。梯度条件:0~5 min,7 %~19 % B;5~21 min,19 %~23 % B;21~24 min,23 %~52 % B;流速为0.4 mL/min,色谱柱温为40 ℃。
质谱方法:电喷雾离子化源(ESI),负离子模式,扫描范围为 m/z 50~1200。雾化气温度550 ℃,气帘气30 psi,辅助气50 psi。去簇电压(DP)-100 eV,碰撞能量CE 为45 eV,CES 碰撞能量叠加为±10 eV。MS 一级预扫描和触发的二级扫描离子累积时间分别为250 ms 和150 ms。
2.1.5 化合物的分子对接 采用ChemBioDraw ultra14.0 得出化合物的3D 结构,并保存为PDB 格式文件。之后应用分子对接软件Autodock 对其加氢加电荷,并进行柔性设置,最后以PDBQT 格式储存。黄嘌呤氧化酶(XOD)晶体结构从Protein data bank(RCSB PDB,https://www.rcsb.org)下载,使用编号为3ETR。使用Autodock 软件去掉XOD结合的水分子和配体之后,进行加氢加电荷,最后存贮为PDBQT 格式,运用遗传算法评价化合物与XOD 的结合能与打分。
2.1.6 体外黄嘌呤氧化酶XOD抑制率测定方法 参照文献方法[9-10]验证成分活性,但方法稍有不同:40 μL 供试品溶液,加入黄嘌呤氧化酶XOD 溶液浓度80 μL,温度20 ℃、孵育时间35 min,加入底物黄嘌呤溶液,40 ℃下继续孵育15 min,测量在295 nm处OD 值,做为供试品组,每组样品平行3 次。同时,以等体积pH=7.4 的PBS 溶液取代黄嘌呤氧化酶XOD 溶液测定的OD 值作为空白组,以等体积pH=7.4 的PBS 溶液取代供试品溶液测定的OD 值为正常组。供试品溶液、黄嘌呤氧化酶XOD 溶液、黄嘌呤溶液分别以适量的PBS 缓冲溶液(pH=7.4)配制成浓度500 μmol/L、20 U/L、125 μmol/L。按如下公式计算化合物对XOD 的抑制剂:
黄嘌呤氧化酶XOD 抑制率=1-(供试品组-空白组)/(正常组-空白组)
2.1.7 数据处理 采用AB Sciex 公司Peakview 1.6数据处理软件对UPLC-Q-TOF-MS/MS 采集的数据进行处理。
2.2 结果
2.2.1 成分鉴定结果 研究发现0.5 h 为短管兔耳草提取物成分吸收高峰区,故采用灌胃后0.5 h 血清样品鉴定血中移行成分,结果见图1A、B。其中图1A 为空白组采集的血清总离子流图,图1B 为0.5 h 时间段所采集的血清总离子流图。结合图1A、B,对比分析血中移行成分与藏药短管兔耳草总提取物总离子流图研究结果[11]及对照品总离子流图碎片信息,一共发现14 个血中移行成分,通过文献及对照品对照鉴定8 个,分别为Chrysoeriol-7-Oglucuronide、木犀草素-3,7-O-葡萄糖醛酸苷、citric acid、loganic acid、Apocynin、p-Coumaric acid、壬二酸、大车前苷;通过文献推测3 个,分别为p-Coumaric acid-O-sulfate、3,4-dimethoxy-cinnamic acid、9,12,13-三羟基-10-十八碳烯酸,共鉴定出11 个,其中8 个为原形成分,3 个为代谢成分,其余3 个未能鉴定,结果见表1。仅选取其中具有代表性化合物的二级裂解路径说明血中移行成分的鉴定过程。

表1 短管兔耳草血中移行成分分析结果
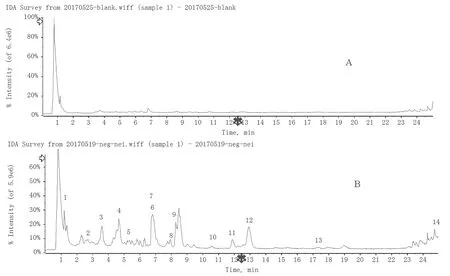
图1 短管兔耳草血中移行成分总离子流图。
化合物2C16H24O10母离子[M-H]-为 375.1314,分子量为376。二级碎片m/z213 表明分子碎裂脱去一分子吡喃葡萄糖形成环烯醚萜母核,之后该碎片离子继续裂解,脱去一分子CO2,产生m/z169 的碎片离子。m/z 151 的碎片离子表示m/z213 的环烯醚萜母核继续脱去一分子H2O。根据文献[11,13]及对照品比对,推断出化合物2 为loganic acid,其裂解过程见图2。
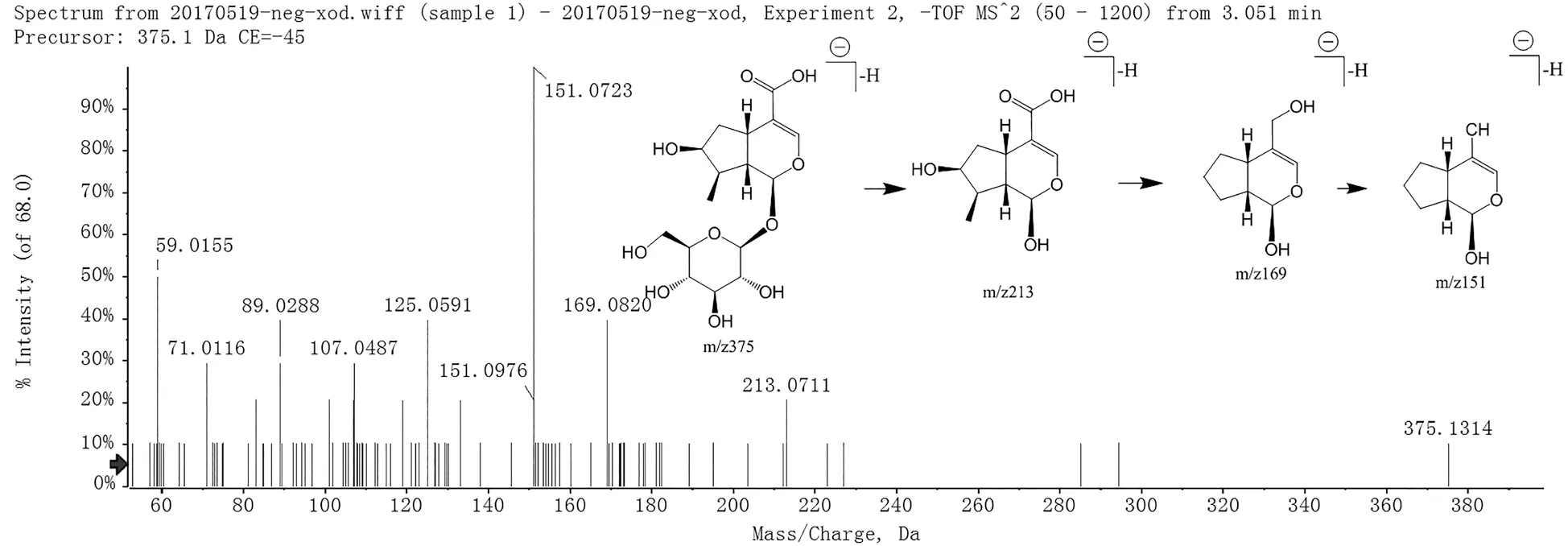
图2 loganic acid的二级质谱图
化合物9C27H26O18母离子[M-H]-为 637.0921,分子量为638。二级碎片离子m/z461 为化合物脱去了一分子葡萄糖醛酸,碎片离子m/z285 的丰度远大于m/z284,这表明该化合物可能含有木犀草素苷元[11,16]。根据peakview 匹配结果以及文献[11,16]及对照品比对,确定化合物9 为木犀草素-3,7-O-葡萄糖醛酸苷,其裂解过程见图3。
化合物7C9H8O3母离子为[M-H]-163.0402,分子量为164。该化合物裂解失去一分子CO2,生成m/z 119 的碎片离子。之后该碎片离子继续失去2 个CH,产生m/z 93 的碎片离子。根据文献[11.14]对照品比对,以及peakview 软件给出数据进行结合推测化合物7 为p-Coumaric acid。
化合物12 C11H12O4,母离子[M-H]-为207.0661,分子量为208。该化合物失去CH3和CHO 碎片,产生m/z162 的碎片离子。之后该碎片离子继续失去一分子CO2,产生m/z119的碎片离子,根据文献[11,17]以及peakview 匹配结果,推测化合物12 为3,4-dimethoxy-cinnamicacid,其裂解方式见图4。
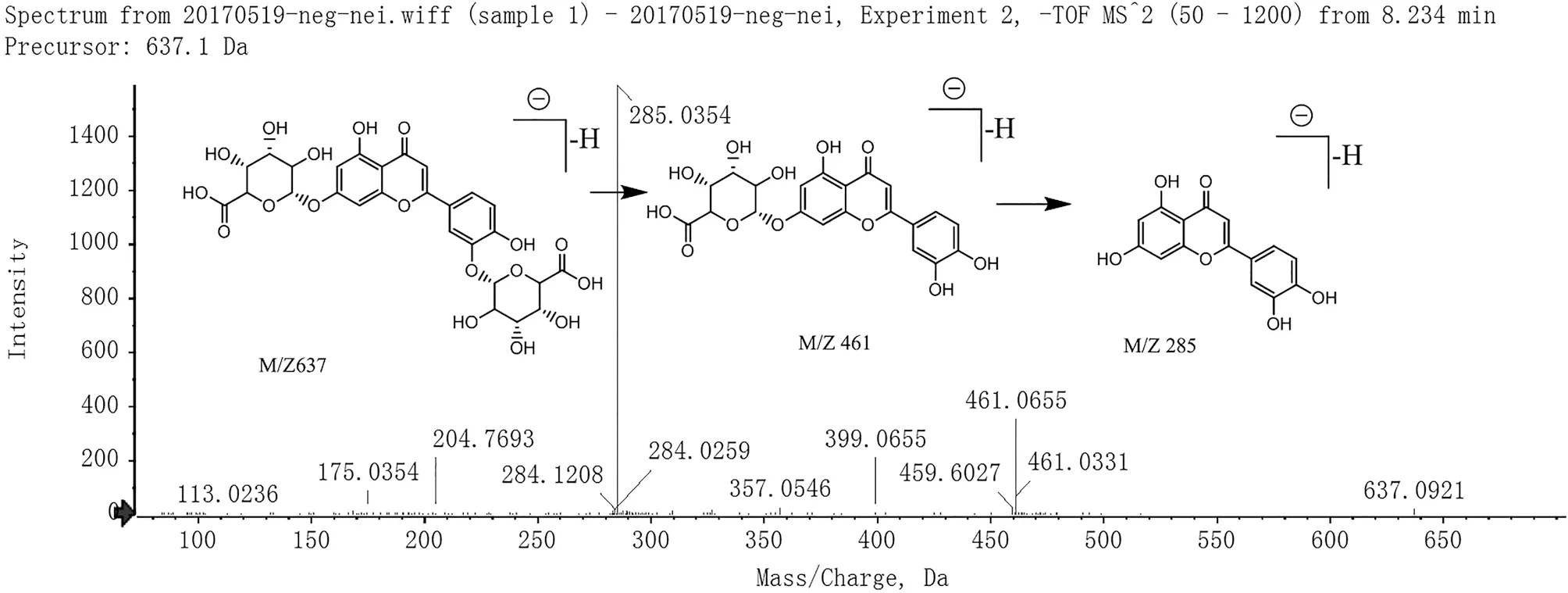
图3 木犀草素-3,7-O-葡萄糖醛酸苷的二级质谱图
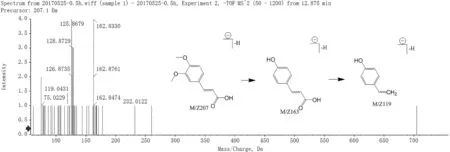
图4 3,4-dimethoxy-cinnamic acid的二级质谱图
2.2.2 血中移行成分与XOD 的分子对接研究 使用Autodock4.0 软件模拟化合物与XOD 的结合方式,使用遗传算法得出化合物与XOD 的结合能与结合打分,具体结果见表2。由结合能与打分结果可知,这些成分与XOD 的结合均为自发过程,说明这些化合物与XOD可以很好的进行结合,具有潜在的XOD抑制活性。
2.2.3 体外黄嘌呤氧化酶XOD 抑制率测定结果 别嘌呤醇在该条件下对XOD 的抑制率分别为95.88%±8.21%,血中移行成分Chrysoeriol-7-Oglucuronide、木犀草素-3,7-O-葡萄糖醛酸苷、citric acid、loganic acid、Apocynin、p-Coumaric acid、壬二酸、大车前苷对XOD 的抑制率见表2。

表2 血中移形成分与XOD的分子对接
3 讨论
藏药短管兔耳草是最为重要的藏草药之一,可通过抑制XOD 活性显著降低高尿酸血症小鼠体内尿酸水平,其XOD 抑制剂成分具有很好的研究与开发前景[11]。传统经先提取再分离纯化得到单体成分然后进行活性筛选的方法具有研究周期过长盲目性过大的不足。对血中移行成分进行研究可大大缩小天然产物中成分的研究范围[19-21],液-质联用技术已成为分离鉴定各种化合物的重要手段[22,23],分子对接技术已成为评价成分潜在活性与作用机制的重要方法与有力工具[8,11]。因此,将UPLC-Q-TOF/MS 技术及分子对接联用无疑为目标成分的快速筛选提供了新的策略。
本实验共发现14 个藏药短管兔耳草血中移形成分。通过文献及对照品比对,共鉴定出8 个原形血中移形成分,3 个代谢血中移行成分。这些成分有黄酮、酚酸及苯丙素类等多种化合物类型,说明藏药短管兔耳草的化学成分不仅具有多样性,同时也具有很好的吸收性能。这些特性可能是藏药短管兔耳草能发挥独特疗效的重要原因之一。另外,由本实验对接结果可知,血中移行成分与XOD 的结合能均为负值且具有较高的分值,说明这些成分与XOD 的结合均为自发过程,且具有潜在的XOD抑制活性[24-27]。据文献报导,许多黄酮、酚酸类及苯丙素化合物均具有XOD 抑制活性[22]。其中,黄酮类化合物Chrysoeriol-7-O-glucuronide 和木犀草素-3,7-O-葡萄糖醛酸苷等黄酮类化合物[23],酚酸类化合物p-Coumaric acid[26]已有相关文献报道为XOD 抑制剂,苯丙素类化合物大车前苷是降低高尿酸血症的主要有效成分之一[27]。因此,这些结果充分说明分子对接评价方法与实验结果具有很高的一致性,完全可用于筛选短管兔耳草血中移形成分中的XOD 抑制剂。此外,酚酸类化合物3,4-dimethoxy-cinnamic acid 分数优于其他化合物,说明其可能具有更好的XOD 抑制活性。文献报导酚酸类化合物甲酯化后的活性明显优于未酯化化合物[24],故其脂溶性的增加可使3,4-dimethoxycinnamic acid 更容易与XOD 的疏水活性中心结合,从而表现出更好的酶抑制活性[25]。另外,本研究的体外活性测试结果与文献基本一致,这进一步验证了分子对接结果的可靠性。
应该指出,UPLC-Q-TOF/MS 虽然具有强大的结构解析能力,但仍需要基于文献报导或对照品才能确证化合物的结构。藏药短管兔耳草本身研究基础薄弱,且其成分复杂,这是本文未能对其血中移行成分全部鉴定的重要原因之一。另外,研究结果同样发现化合物与XOD 的对接打分值的高低与化合物对XOD 抑制率的大小存在不一致性,说明分子对接的结果最终仍需要进行活性验证。这说明后续工作需要加强藏药短管兔耳草化学成分的系统研究,以为后续的成分鉴定、活性验证及新药开发提供物质基础。但总体而言,将UPLC-QTOF/MS 与分子对接技术联用可快速鉴定了藏药短管兔耳草血中移行成分,评价移行成分潜在的XOD 抑制活性,为藏药短管兔耳草的降尿酸药用开发奠定一定的物质与理论基础。
