新疆酿酒葡萄中赭曲霉毒素A来源菌的筛选及其产毒条件研究
2020-10-22赵昊全莉于佳俊张晓蒙马文瑞武运薛洁
赵昊,全莉,于佳俊,张晓蒙,马文瑞,武运*,薛洁*
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830052)2(中国食品发酵工业研究院,北京,100015) 3(天津科技大学 生物工程学院,天津,300457)
新疆地区自古以来就是我国主要葡萄及葡萄酒产地,具备得天独厚的资源优势。近年来,随着新疆葡萄种植面积和葡萄酒企业数量的不断增多,新疆葡萄酒产业得到了极大的发展,并逐渐成为新疆地区的经济支柱产业[1-2]。随着国民经济水平的提升,食品质量安全问题愈发严峻,这也制约着葡萄酒产业的发展[3-4]。
众多真菌毒素中,赭曲霉毒素因其强烈的生物毒性和潜在的致病性而备受关注,其毒性仅次于黄曲霉毒素[5-6]。赭曲霉毒素是霉菌中某些曲霉属和青霉属菌种产生的有毒代谢产物,包括具有相似化学结构的A,B,C,D(α)4种化合物。同时具有基因毒性、神经毒性、致畸性、免疫毒性和胚胎毒性等[7-9]。赭曲霉毒素A具有热稳定性,即使在250 ℃高温加工下,也只能去除一小部分赭曲霉毒素A(ochratoxin A,OTA),无法完全降解[10]。OTA对葡萄酒的污染会影响整个葡萄酒市场,对OTA的控制是一个亟待解决的问题。
经过大量研究证实,OTA广泛存在于谷物、水果、咖啡和葡萄酒中[11-14]。葡萄是易受OTA来源菌污染的农产品之一[15],OTA来源菌的污染、生长、产毒是葡萄酒中存在OTA残留的根本原因。目前,国内外关于新疆酿酒葡萄OTA来源菌分离筛选的相关文献不多。本研究以新疆四大产区(焉耆盆地、吐哈盆地、天山北麓、伊犁河谷)酿酒葡萄和根系土壤为样品,进行OTA来源菌的筛选及分离,并对其产毒条件进行探究,为构建葡萄酒OTA污染的预警机制提供理论依据。
1 材料与方法
1.1 材料、试剂与培养基
葡萄样品:赤霞珠和霞多丽,采自新疆四大产区(焉耆盆地、吐哈盆地、伊犁河谷、天山北麓)的健康和损伤葡萄。
土壤样品:葡萄园区根系土壤,采集新疆四大产区酒庄葡萄种植园区的葡萄根系土壤。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基、马铃薯葡萄糖琼脂(potato dextrase agar,PDA)培养基、孟加拉红培养基、察氏培养基。
霉菌DNA提取试剂盒,北京索莱宝科技有限公司;霉菌通用引物(ITS 1和ITS 4),上海生工生物工程技术服务有限公司;琼脂糖,Biowest Agarose;Gold View,Sigma;改良式血球计数板,上海化科实验器材有限公司。
1.2 仪器与设备
BX51荧光显微镜,OLYMPUS中国有限公司;电泳仪,北京六一仪器厂;LRH-250生化培养箱,上海恒科仪器有限公司;Multiskan FC酶标仪,上海天能科技有限公司;PHS-3CpH计,上海精密科学仪器有限公司;高压灭菌锅,上海申安医疗器械厂;SW-CJ-2FD超净工作台,苏州净化设备有限公司;DHZ-B全温振荡器,太仓市豪威实验仪器制造有限公司;BioSpec-nano核酸蛋白检测仪,德国Eppendorf公司;紫外成像系统、PCR仪,Bio-Rad。
1.3 实验方法
1.3.1 样品采集
葡萄样品:用体积分数为75%的酒精擦拭手套后,均匀、随机地于该品种种植区东、南、西、北、中5点取样,每点取正常酿酒葡萄和落败酿酒葡萄各1.0 kg,放置于无菌的密封袋中,制作标签记录样品采集时间、地点、葡萄品种。
土壤样品:用体积分数为75%的酒精擦拭铁钎,均匀、随机地挖取葡萄园区葡萄藤根部20 cm土壤,放置于无菌密封袋,制作采样标签记录样品采集时间、地点。
1.3.2 霉菌的分离纯化
土壤样品:称取1 g土壤加入99 mL无菌生理盐水中,以180 r/min在28 ℃下振荡24 h,后续步骤参考雷纪峰[16]的方法。
1.3.3 荧光紫外法初步筛选疑似产OTA霉菌
将分离纯化好的霉菌转接到察氏培养基上,倒置于28 ℃恒温培养箱培养72 h,在460 nm紫外灯照射下,以不接种的相应平板作对照,观察平板上是否能够产荧光。
1.3.4 ELISA法确定OTA来源菌
挑选出能产绿色或者黄绿色荧光的霉菌接种到察氏培养基上28 ℃培养7 d,加15 mL甲醇并用封口膜封住平皿,来回晃动平皿5 min,放置于遮光环境下浸提3 h。用0.22 μm滤膜过滤提取液,提取整个平板的毒素,用酶联免疫(enzyme-linked immunoassay,ELISA)试剂盒法测霉菌浸提液OTA含量,确定OTA来源菌株,具体步骤参照全莉等[17]的方法。
1.3.5 OTA来源菌的形态观察
将分离纯化的菌株滴落于载玻片上,在显微镜下观察菌体形态,进行初步鉴定。
1.3.6 OTA来源菌ITS rDNA序列鉴定
1.3.6.1 DNA提取
用霉菌DNA提取试剂盒对分离纯化的霉菌DNA进行提取,提取步骤按试剂盒说明书进行。
1.3.6.2 ITS rDNA PCR扩增
具体步骤参照耿晓杰等[18]的方法,并通过DNA浓度检测和琼脂糖凝胶电泳确定DNA浓度及ITS区域(400~800 bp)是否获得了目的片段。
1.3.6.3 序列分析
将PCR引物送生工生物工程(上海)股份有限公司进行测序,测序结果在美国国家生物信息中心(National Center for Biotechnology Information,NCBI)中进行BLAST对比分析,通过与Genbank数据库中已知序列进行同源性比对确定待测菌株种属。
1.3.7 OTA来源菌接种至酿酒葡萄方法
1.3.7.1 OTA来源菌悬液的制备
具体步骤参照彭娅萍[19]的方法,最终稀释菌悬液孢子至106、107、108个/mL备用,每个试验处理做3个重复。
1.3.7.2 OTA来源菌的接种
取200 g无损伤、大小均匀的整串酿酒葡萄置于体积分数为75%的乙醇中1 min,浸泡后用无菌水清洗2~3次,待葡萄表面干燥后接种。
将干燥后的酿酒葡萄,用一次性注射器在每个洗净、干燥的酿酒葡萄表面穿刺2~3个针孔,刺入深度2 mm,针孔直径约0.5 mm,为损伤酿酒葡萄。
分别将200 g洗净、干燥酿酒葡萄和损伤酿酒葡萄浸泡浓度为106、107、108个/mL的炭黑曲霉菌悬浮液中,浸泡5 min后移出至250 mL的烧杯中,用封口膜密封,每天取样观察葡萄感染情况,检测炭黑曲霉产OTA情况。
1.3.8 OTA来源菌产OTA条件的研究
选取产OTA量较高的菌株进行单因素试验。
1.3.8.1 温度对OTA来源菌产OTA的影响
将接种量为107个/mL的无损酿酒葡萄放置于恒温恒湿培养箱中,控制相对湿度为75%,光照条件为光暗交替,温度设为18、28、38 ℃。每隔24 h,连续7 d 测OTA含量。
1.3.8.2 相对湿度对OTA来源菌产OTA的影响
将接种量为107个/mL的无损酿酒葡萄放置于恒温恒湿培养箱中,控制温度为28 ℃,光照条件为光暗交替,相对湿度设为65%、75%、85%。在培养后每隔24 h,连续7 d测OTA含量。
1.3.8.3 接种量对OTA来源菌产OTA的影响
分别将接种量为106、107、108个/mL的无损酿酒葡萄置放于恒温恒湿培养箱中,控制温度为28 ℃,光照条件为光暗交替,相对湿度设为75%。在培养后每隔24 h,连续7 d 测OTA含量。
1.3.8.4 光照条件对OTA来源菌产OTA的影响
将接种量为107个/mL的无损酿酒葡萄放置于恒温恒湿培养箱中,控制温度28 ℃,相对湿度设为75%,光照条件设为光照、光暗交替、避光。在培养后每隔24 h,连续7 d 测OTA含量。
1.3.8.5 葡萄有无损伤对OTA来源菌产OTA的影响
分别将接种量为107个/mL的无损酿酒葡萄和损伤酿酒葡萄放置于恒温恒湿培养箱中,控制温度为28 ℃,光照条件为光暗交替,相对湿度设为75%。在培养后每隔24 h,连续7 d 测OTA含量。
1.3.8.6 样品OTA测量方法
每次取酿酒葡萄10 g于10 mL离心管中,用灭菌过的玻璃棒进行破碎处理,离心后采用ELISA试剂盒法参照1.3.4小节的方法测OTA含量。
1.4数据分析
试验数据处理运用Excel 2018、Origin 8.5及SPSS 19.0软件。
2 结果与分析
2.1 霉菌分离情况
采用PDA 培养基和孟加拉红培养基对葡萄及根系土壤中的真菌进行分离。在葡萄果实中分离到25个单个菌落真菌,在葡萄根系土壤中分离到5个单个菌落,说明葡萄果实更易被有害菌污染。将分离出霉菌接种至PDA培养基进行二次分离纯化,通过镜检排除酵母菌,最终收集12株不同形态的霉菌,图1为部分霉菌分离纯化后的形态。
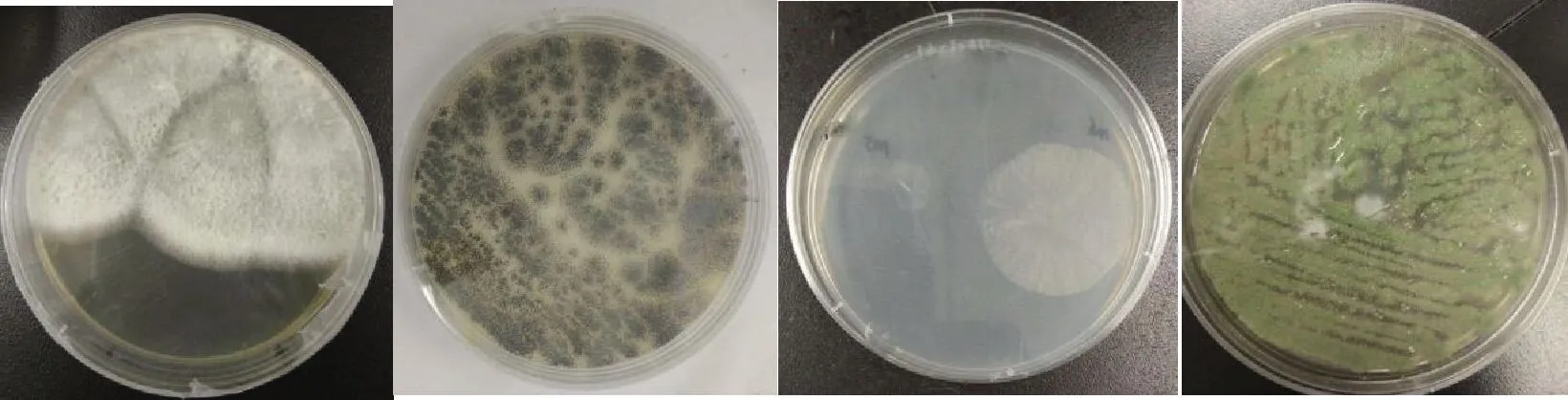
图1 部分霉菌的菌落形态图Fig.1 Colony morphology of partial molds
2.2 OTA来源菌的筛选及形态观察
通过荧光紫外法初筛,12株霉菌中有3株产荧光,占25.0%。将3株产荧光的霉菌单点接种至胡萝卜琼脂培养基上28 ℃培养7 d,提取整个培养基毒素,用ELISA试剂盒检测提取液OTA含量,1株确定为假阳性,其余2株产OTA,标号为M2和M7,OTA产量如表1所示。
图2为M2和M7在显微镜下细胞形态,2株霉菌的细胞形态有典型的帚状分支,分生孢子梗做二三次分支,分生孢子链呈分散柱状,具有典型的曲霉细胞形态,呈黄褐色、黑色,中心呈青黄色或红褐色,边缘白色,质地丝状、絮状较紧实,菌株边缘有较多气生菌丝,反面土黄色,菌落大小约40 mm。这与OTA来源菌主要以青霉和曲霉属为主的相关文献报道一致,雷纪锋等[6]从宁波地区的农庄葡萄中筛选出了8株OTA来源菌,包括5株青霉和3株曲霉;彭娅萍等[9]从江苏镇江市句容葡萄园的葡萄、土壤及枝叶中筛选出3株OTA来源菌,为青霉和曲霉。

表1 产荧光菌株生成OTA的含量Table 1 OTA concent produced by fluoresce strains
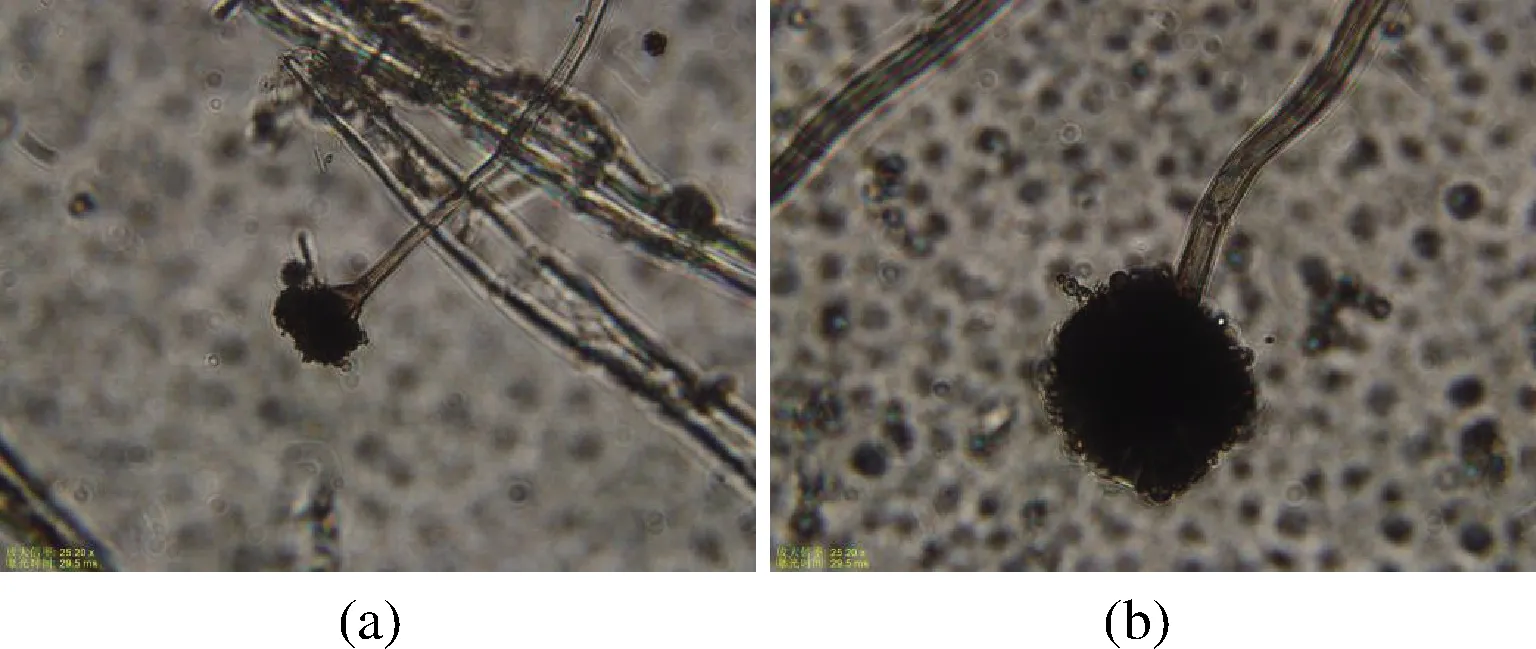
a-菌株M2;b-菌株M7图2 两株OTA来源菌细胞形态图Fig.2 Cell morphology of two OTA-derived strains
2.3 霉菌ITS rDNA序列鉴定
2.3.1 霉菌ITS rDNA区域扩增结果
以OTA来源菌DNA为模板,对ITS区域特异性扩增后的产物进行电泳后在凝胶成像系统下进行观察,结果如图3所示。2株OTA来源菌特异性片段扩增结果良好,条带清晰且唯一,分子量约为600 bp,符合DNA测序要求,可以送至生物公司测序。
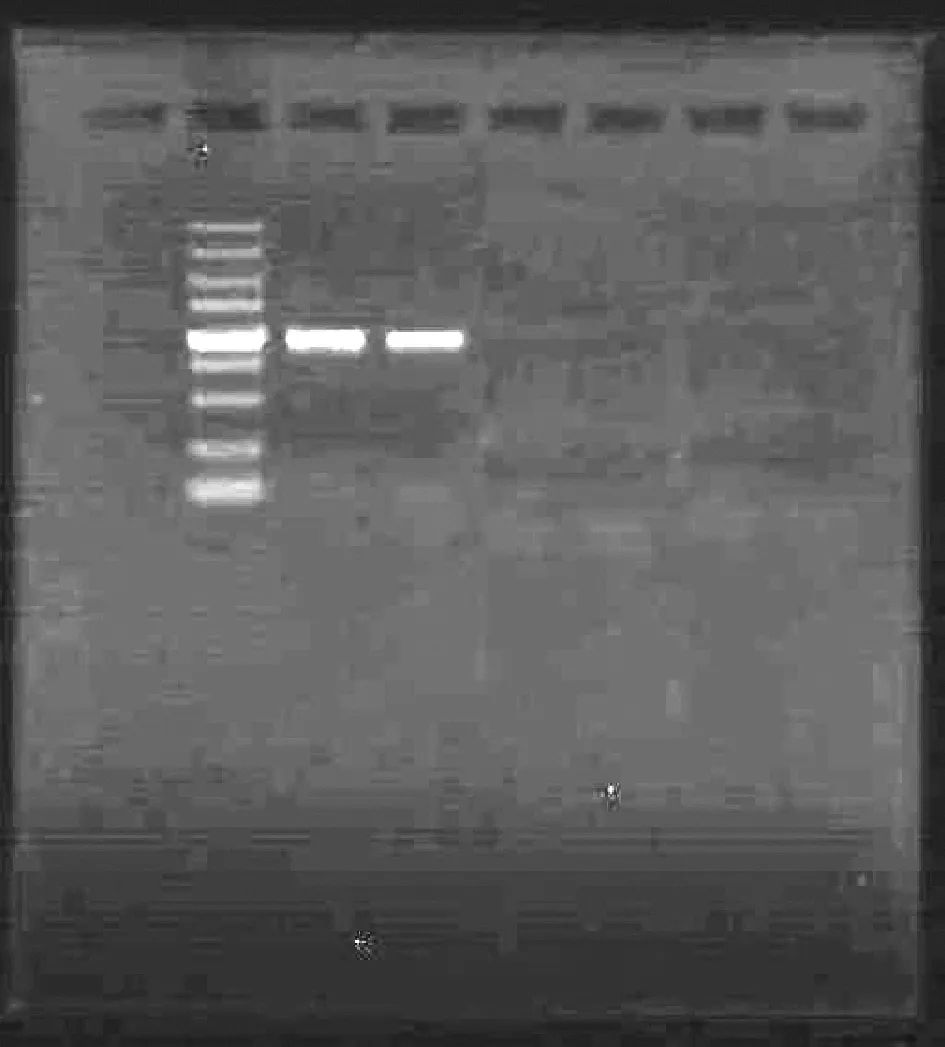
1-对照;2-Marker图3 两株OTA来源菌ITS rDNA扩增琼脂糖 凝胶电泳图Fig.3 Agarose gel electrophoresis of two strains of OTA ITS rDNA amplified by agarose gel electrophoresis
2.3.2 BLAST比对结果
OTA来源菌测序结果经BLAST比对,结果如表2所示。霉菌M2和M7分别为黑曲霉Aspergillusniger和炭黑曲霉Aspergilluscarbonarius,与菌株形态观察结果基本一致。

表2 OTA来源菌测序结果比对Table 2 Comparison of sequencing results of OTA- derived bacteria
2.4 不同温度条件下炭黑曲霉感染酿酒葡萄产OTA情况
不同温度条件下,炭黑曲霉感染赤霞珠、霞多丽葡萄产OTA情况如图4所示。

a-赤霞珠葡萄;b-霞多丽葡萄图4 不同温度炭黑曲霉感染赤霞珠葡萄和 霞多丽葡萄OTA含量的变化Fig.4 Changes of OTA content in Cabernet Sauvignon and Chardonnay grape infected by A.carbonarius at different temperatures
由图4-a可知,不同温度条件下,感染炭黑曲霉的赤霞珠葡萄OTA含量明显高于未感染的对照组;28、38 ℃条件下,感染炭黑曲霉的赤霞珠葡萄在第3~6天产OTA能力较强,在第4天产OTA量达到峰值,分别为1.82和1.64 μg/L,产OTA能力呈先上升后快速降低的趋势;18 ℃条件下,感染炭黑曲霉的赤霞珠葡萄产OTA能力较为均衡,平均含量为0.78 μg/L,说明18 ℃时炭黑曲霉菌株的产OTA能力低于28和38 ℃;18 ℃时,被感染的赤霞珠OTA产量明显较低,这可能与低温条件不适宜霉菌生长代谢有关;由图4-b可知,不同温度条件下,感染炭黑曲霉的霞多丽葡萄OTA含量明显高于未感染的对照组;18、28、38 ℃条件下,感染炭黑曲霉的霞多丽葡萄在第2~5天产OTA能力较强,第3天达到峰值,产OTA能力均呈逐渐上升后降低的趋势;温度为18 ℃时,被感染的霞多丽OTA产量略低于温度28、38 ℃,但差异不大。
以上结果表明,不同温度条件下,炭黑曲霉感染酿酒葡萄产OTA能力存在明显差异且显著高于对照组。炭黑曲霉在赤霞珠葡萄上的产OTA量略低于在霞多丽葡萄上的产OTA量;接种第3天,霞多丽葡萄OTA含量出现峰值且平均含量为1.75 μg/L,接种第4天,赤霞珠葡萄OTA含量出现峰值且平均含量为1.46 μg/L,说明成熟的霞多丽葡萄比赤霞珠葡萄更易感染炭黑曲霉,并且霞多丽葡萄产OTA量高于赤霞珠葡萄的产OTA量;温度为18 ℃时,炭黑曲霉在赤霞珠、霞多丽葡萄上的产OTA量均较低,说明低温一定程度抑制了炭黑曲霉的产OTA能力;观察葡萄表面感染情况时,发现温度为38 ℃时,酿酒葡萄易明显发生感染杂菌的情况,可能与细菌在38 ℃时存活能力较强有关。
2.5 不同湿度条件下炭黑曲霉感染酿酒葡萄产OTA情况
不同湿度条件下,炭黑曲霉感染赤霞珠、霞多丽葡萄产OTA情况如图5所示。由图5-a可知,不同湿度条件下,感染炭黑曲霉的赤霞珠葡萄OTA含量明显高于未感染对照组;感染炭黑曲霉的赤霞珠葡萄OTA含量由高到低为相对湿度85%>相对湿度75%>相对湿度65%,但总体差异不大;赤霞珠葡萄被感染的第4天产OTA量达到峰值,产OTA量呈先迅速上升后快速降低的趋势;由图5-b可知,不同湿度条件下,感染炭黑曲霉的霞多丽葡萄明显高于未感染的对照组;感染炭黑曲霉的霞多丽葡萄OTA含量由高至低为相对湿度85%>相对湿度75%>相对湿度65%,但差异不明显;霞多丽葡萄被感染的第3天产OTA量达到峰值,产OTA量同样呈先迅速上升后快速降低的趋势。
总的来说,不同湿度条件下,炭黑曲霉感染酿酒葡萄产OTA能力存在的差异不明显,但显著高于;炭黑曲霉在赤霞珠葡萄上的产OTA量略低于在霞多丽葡萄上的产OTA量;感染第3天,霞多丽葡萄产OTA量出现峰值,感染第4天,赤霞珠葡萄产OTA量出现峰值,说明成熟的霞多丽比赤霞珠葡萄更易感染炭黑曲霉并产OTA;随着相对湿度逐渐增加,炭黑曲霉在赤霞珠、霞多丽葡萄上的产OTA量也逐渐增加,但增加差异不明显,说明较高的湿度环境中,炭黑曲霉更易感染酿酒葡萄并产OTA;观察葡萄表面感染情况时,发现各湿度条件下,酿酒葡萄陆续出现感染杂菌的情况,说明高湿度时成熟葡萄容易被微生物感染,但组间差异不明显,可能与相对湿度设置均较高有关。
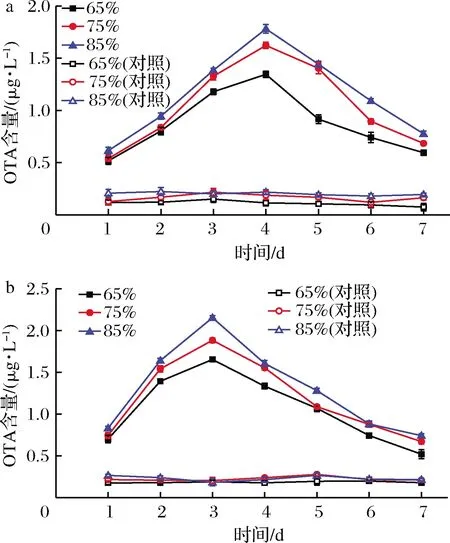
a-赤霞珠葡萄;b-霞多丽葡萄图5 不同湿度炭黑曲霉感染赤霞珠葡萄和 霞多丽葡萄OTA含量的变化Fig.5 Changes of OTA content in Cabernet Sauvignon and Chardonnay grape infected by A.carbonarius with different humidity
2.6 不同接种量条件下炭黑曲霉感染酿酒葡萄产OTA情况
不同接种量条件下,炭黑曲霉感染赤霞珠、霞多丽葡萄产OTA情况如图6所示。由图6-a可知,不同接种量条件下,被感染的赤霞珠葡萄OTA含量明显高于对照组;炭黑曲霉菌悬液孢子数越高,被感染的赤霞珠葡萄OTA含量就越高;赤霞珠葡萄被感染的第4~5天产OTA量最高;被感染的赤霞珠葡萄产OTA量总体呈先上升后降低的趋势,炭黑曲霉菌悬液孢子数为108个/mL时,被感染赤霞珠葡萄OTA含量降低不明显;由图6-b可知,不同接种量条件下,被感染的霞多丽葡萄OTA含量明显高于对照组;炭黑曲霉菌悬液孢子数越高,被感染的霞多丽葡萄OTA含量就越高;赤霞珠葡萄被感染的第2~4天产OTA量较高,炭黑曲霉菌悬液孢子数为108个/mL时,被感染的霞多丽葡萄OTA含量显著高于菌悬液孢子数为106个/mL;被感染的霞多丽葡萄产OTA量总体呈先上升后降低的趋势,但炭黑曲霉菌悬液孢子数为108个/mL时,被感染霞多丽葡萄OTA含量降低不明显。

a-赤霞珠葡萄;b-霞多丽葡萄图6 不同接种量下炭黑曲霉感染赤霞珠葡萄和 霞多丽葡萄OTA含量的变化情况Fig.6 Changes of OTA content in Cabernet Sauvignon and Chardonnay grape infected by A.carbonarius at different inoculation amounts
总的来说,不同接种量条件下,炭黑曲霉感染酿酒葡萄产OTA能力存在明显差异,且被感染的酿酒葡萄OTA含量显著高于对照组;炭黑曲霉菌悬液孢子数与被感染的酿酒葡萄OTA含量呈正相关;被感染的酿酒葡萄OTA含量随感染时间增加呈先上升后下降趋势,但炭黑曲霉菌悬液孢子数为108个/mL时,被感染霞多丽葡萄OTA含量降低不明显;观察葡萄表面感染情况时,发现黑曲霉菌悬液孢子数为108个/mL时,酿酒葡萄几乎没有感染杂菌。
2.7 不同光照条件下炭黑曲霉感染酿酒葡萄产OTA情况
不同光照条件下,炭黑曲霉感染赤霞珠、霞多丽葡萄产OTA情况如图7所示,由图7-a可知,不同光照条件下,感染炭黑曲霉的赤霞珠葡萄OTA含量明显高于未感染的对照组;黑暗条件下的赤霞珠葡萄感染炭黑曲霉后OTA含量明显高于光照条件下的赤霞珠葡萄,而光暗交替条件下赤霞珠葡萄感染炭黑曲霉后OTA含量居中;赤霞珠葡萄被感染的第3~5天产OTA量较高,最高为黑暗条件下第4天,OTA含量为1.72 μg/L;另外,赤霞珠葡萄被感染后OTA含量均呈先上升后降低的趋势,感染组和对照组感染杂菌情况较少;由图7-b可知,不同光照条件下,感染炭黑曲霉的霞多丽葡萄OTA含量明显高于未感染的对照组;被感染的霞多丽葡萄OTA含量由高到低为黑暗环境>黑暗交替环境>光照环境;霞多丽葡萄被感染的第2~4天产OTA量较高,最高为黑暗条件下第3天,OTA含量为2.35 μg/L;另外,被感染的霞多丽葡萄OTA含量也呈先上升后降低的趋势。

a-赤霞珠葡萄;b-霞多丽葡萄图7 不同光照下炭黑曲霉感染赤霞珠葡萄和 霞多丽葡萄OTA含量的变化情况Fig.7 Changes of OTA content in Cabernet Sauvignon and Chardonnay grape infected by A.carbonarius under different illumination
以上结果表明,不同光照条件下的酿酒葡萄感染炭黑曲霉产OTA能力存在明显差异,且显著高于对照组;炭黑曲霉感染赤霞珠葡萄的OTA含量略低于霞多丽;黑暗条件下,炭黑曲霉感染酿酒葡萄的OTA含量明显高于光照条件下被感染的酿酒葡萄OTA含量,说明炭黑曲霉在光照条件下产OTA能力较弱;观察葡萄表面感染情况时,发现部分霞多丽葡萄感染杂菌。
2.8 炭黑曲霉接种至有无损伤酿酒葡萄上产OTA情况
炭黑曲霉感染有无损伤的赤霞珠、霞多丽葡萄产OTA情况如图8所示,由图8-a可知,感染了炭黑曲霉的赤霞珠葡萄OTA含量明显高于未感染的对照组;有损伤的赤霞珠葡萄感染炭黑曲霉后OTA含量明显高于无损伤的赤霞珠葡萄;有损伤赤霞珠葡萄被感染的第3天产OTA量达到峰值,无损伤赤霞珠葡萄被感染的第4天产OTA量达到峰值,产OTA量均呈先上升后降低的趋势;另外,对照组有损伤的赤霞珠葡萄OTA含量逐渐上升,可能与葡萄损伤后在接种过程中感染产OTA霉菌有关;由图8-b可知,感染了炭黑曲霉的霞多丽葡萄OTA含量明显高于未感染的对照组;有损伤的霞多丽葡萄感染炭黑曲霉后OTA含量明显高于无损伤的赤霞珠葡萄,说明成熟酿酒葡萄损伤后更易感染炭黑曲霉菌;有损伤霞多丽葡萄被感染的第2天产OTA量达到峰值,无损伤赤霞珠葡萄被感染的第3天产OTA量达到峰值,产OTA量呈先上升后降低的趋势;同样,对照组有损伤的霞多丽葡萄OTA含量逐渐上升,可能与取样过程感染OTA来源霉菌有关。
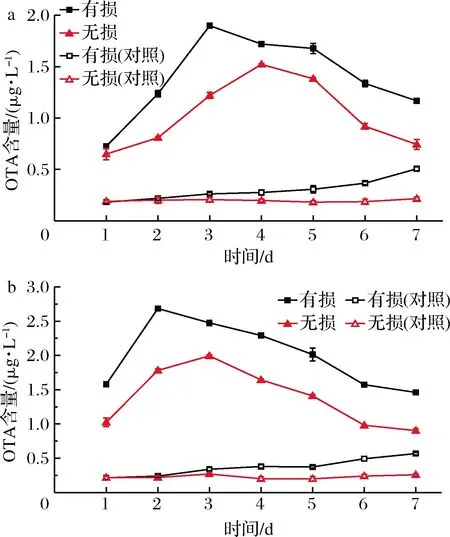
a-赤霞珠葡萄;b-霞多丽葡萄图8 炭黑曲霉感染有无损伤赤霞珠葡萄和 霞多丽葡萄OTA含量的变化情况Fig.8 Changes of OTA content in Cabernet Sauvignon and Chardonnay grape infected by A.carbonarius without damage
以上结果表明,有无损伤的酿酒葡萄感染炭黑曲霉产OTA能力存在的差异十分明显,且显著高于对照组;炭黑曲霉在赤霞珠葡萄上的产OTA量略低于在霞多丽葡萄上的产OTA量;有损伤赤霞珠、霞多丽葡萄产OTA量比无损伤赤霞珠、霞多丽葡萄产OTA量出现峰值的日期提前了一天,且有损伤的酿酒葡萄OTA含量呈逐渐上升趋势,说明有损伤的酿酒葡萄比无损伤的酿酒葡萄更易感染炭黑曲霉并产OTA;观察葡萄表面感染情况时,发现有损伤的酿酒葡萄明显感染杂菌。
3 结论
通过对新疆地区不同产区葡萄品种和根系土壤中霉菌的分离,共分离出霉菌12株,这其中有3株产黄绿色荧光,经检测有2株为OTA来源菌,分别A.niger和A.carbonarius,且炭黑曲霉产OTA含量较高;单因素试验结果表明,接种量、温度、酿酒葡萄有无损伤这几个条件对炭黑曲霉产OTA能力的影响较为明显,各条件下,炭黑曲霉感染成熟霞多丽葡萄的OTA含量高于炭黑曲霉感染赤霞珠葡萄的OTA含量且OTA含量基本呈现先上升后降低的趋势,这与霉菌更易感染果皮较薄且酸度较低、含糖量较高的酿酒葡萄有关[20]。因此,对于酒庄来说,本研究可为构建葡萄酒OTA污染的预警机制提供理论依据。
