低氧预适应小鼠对免疫器官及非特异免疫细胞的调节作用
2020-10-22许文胜崔丽霞刘雄伟刘明吉
许文胜,崔丽霞,刘雄伟,刘明吉,闫 娇,张 涛
(1.内蒙古科技大学包头医学院第一附属医院,内蒙古包头 014010;2.内蒙古科技大学包头医学院图书馆;3.内蒙古科技大学包头医学院研究生学院2018级研究生;4.内蒙古科技大学包头医学院学生处;5.内蒙古科技大学包头医学院基础医学与法医学院)
早期人类对低氧的研究并不多,人们发现缺氧导致呼吸困难,主要集中在暴露于低氧大气中的高原土著人,除了成功地适应大气低氧外,他们的体内平衡能力没有增加[1]。霍尔丹经研究认为与所谓的物理化学的大脑有关,组织细胞对缺氧的获得性耐受被认为是通过进化发展起来的[2]。随后,随着缺氧动物模型建模成功,从行为学、神经生理学、神经化学、神经形态学和分子生物学的角度探讨缺氧。公认为缺血、低氧(Ischemia/Hypoxia Preconditioning,I/HPC)预适应指机体预先受一次或多次短暂、非致死性缺血/低氧刺激,再恢复常态后,从而获得对更严重甚至致死性缺血或缺氧有更强的抵抗能力,是临床常见的基本病理过程和死因[3-4]。HPC能导致细胞基因表达和炎症因子分泌的改变,从而参与炎症反应。这是低氧导致炎症反应和组织损伤的原因之一,也是肿瘤炎症微环境的重要因素,导致机体免疫系统紊乱,诱发一系列问题而出现炎症、损伤、甚至死亡[5-6]。低氧在免疫系统中的作用到目前为止尚不清楚,中枢神经系统曾被定义为组织学上的免疫豁免区,但越来越多的证据表明,居留于中枢神经系统的细胞也可分泌各种炎症介质并表达其受体,启动免疫过程,近年来的研究表明,多种免疫细胞及细胞因子参与了脑损伤的发生发展及修复过程[7]。非特异性免疫是人体的第一道防线,吞噬细胞是非特异免疫中的重要组成部分,本文主要对吞噬细胞基本功能进行初步的研究。
1 对象与方法
1.1对象与试剂 6~8周雄性昆明小鼠,体重18~22 g。药品与试剂主要有:75 %乙醇、1640培养液、胎牛血清、PBS缓冲液ConA、小鼠IL-2试剂盒(南京金益柏生物科技有限公司)。培养皿,光学显微镜,无菌纸,广口瓶,镊子,眼科剪,橡皮塞,注射器,Ep管,50目钢网,细胞计数板,50 mL离心管,离心机,孔板,光学显微镜,电子秤。
1.2方法
1.2.1实验动物分组 60只小鼠随机分为3组,每组20只。对照组小鼠不进行低氧暴露(H0)、实验组低氧暴露1次(H1)和低氧暴露4次(H4),暴露结束后立即进行后续实验。
1.2.2小鼠低氧预适应模型 低氧预适应模型制备是将小鼠置于125 mL广口瓶内,用橡皮塞密闭,观察小鼠情况,如出现喘息式呼吸,立即取出,转移到另一相同体积含有新鲜空气的广口瓶内记录,同时记录低氧耐受时间,即为低氧暴露1次组(H1)。继续进行动物密闭,观察、记录低氧耐受时间,依次类推进行4次,即为低氧暴露4次组(H4)。对照组不进行缺氧暴露,为非低氧暴露组(H0)。低氧结束后,乙醚麻醉小鼠。进行实验之前,对各组小鼠进行称重。
1.2.3免疫器官提取及测量 轻压小鼠,眼科弯镊眼静脉放血处死小鼠,取出置于无菌纸上,腹侧面向上,打开腹腔分离并取出脾脏,放入EP管中,进行称量。胸腺的提取方法同上,分离出胸腺,进行称量。注意不要切断大血管及弄破心脏,记录数据并进行统计分析。小鼠的胸腺指数=(胸腺重量/小鼠体重)×10(mg/kg);脾指数=(脾重量/小鼠体重)×10(mg/kg)。
1.2.4IL-2活性测定 方法同提取脾的方法,手持镊子夹住脾被膜,并用hand,S液反复冲洗,直到脾发白,收集冲洗细胞悬液,1 000 转/min×10 min两次离心,弃去上清,取脾细胞配制成2×106/mL细胞悬液,用 1.0 μg/mL的ConA刺激4 h,接种到24孔20 %小牛血清RPMI1640培养基中,1 mL/孔,置于37 ℃、5 %CO2培养箱中静置孵育24 h,应用ELISA法检测IL-2活性。
1.2.5小鼠腹腔巨噬细胞提取与培养 脱颈处死小鼠后,酒精浸泡小鼠1~2 min,移入超净台中,仰卧固定在解剖板上,碘酒消毒腹部皮肤,用镊子提起下腹皮肤,剪一小口并沿腹中线剪开腹部皮肤,暴露腹部肌层,抽取5 mL预先预冷的不含小牛血清的RPMI1640培养液并注射,注射时不要损伤内脏及血管,用棉球轻柔腹部2-3 min,静置5 min后,用眼科镊稍提起腹腔,并用眼科剪剪开一个小口,用吸管吸取,移入离心管中,并重复灌洗1次。将两次回收的洗液分别1 000 转/min×10 min两次离心,最终弃去上清,调整细胞浓度2×106/mL,接种于24孔培养板中,1 mL/孔,置于37 ℃、5 %CO2培养箱中静置孵育2 h。取上清检测IL-2的含量,取贴壁细胞并用RPMI1640培养基洗1~2次,弃去未粘附细即为单层的巨噬细胞。取少量细胞悬液作台盼蓝染色检测细胞活性、并作瑞氏染色。并用墨汁检测巨噬细胞的吞噬率和吞噬指数。
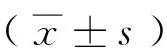
2 结果与讨论
2.1低氧对小鼠免疫器官的影响 低氧实验模型建立后,称取小鼠免疫器官胸腺和脾的重量,计算胸腺指数和脾指数,低氧4次组小鼠脾指数和胸腺指数均低于对照组(P<0.05)。低氧会使免疫器官的相对指数下降,低氧1次组与对照组相比,差异无统计学意义(P>0.05)。
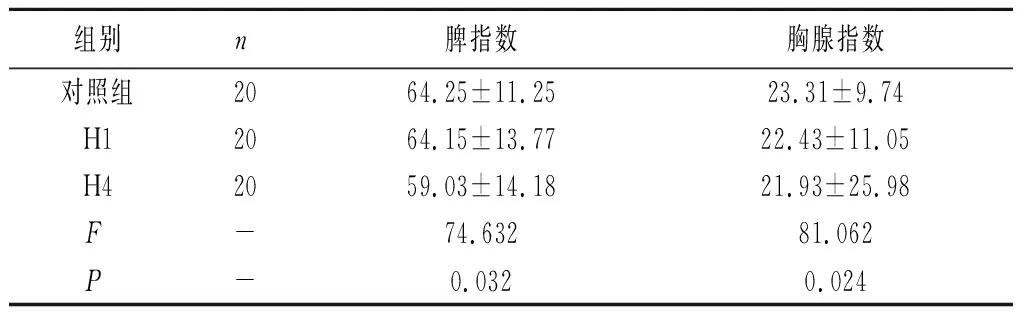
表1 低氧对小鼠对免疫器官的影响
2.2吞噬细胞吞噬百分率、吞噬指数功能的检测 正常成鼠脑缺氧时,吞噬细胞基本功能变化检测,分别检测对照组小鼠、缺氧组1 h和缺氧4 h吞噬百分率及吞噬指数结果见表2。
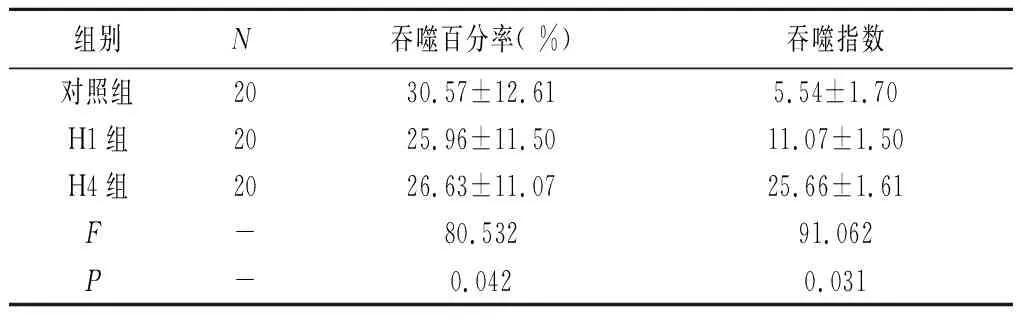
表2 低氧小鼠对吞噬红细胞影响
2.3各组小鼠血液指标变化 结果可见,白细胞在低氧不同时间段时,细胞数目与对照组相比,差异无统计学意义(P>0.05),中性粒细胞在H1、H4与H0相比,中性粒细胞降低(P<0.05)。红细胞则对低氧最为敏感,不同时间低氧组与对照组比较,数目减少(P<0.05)。
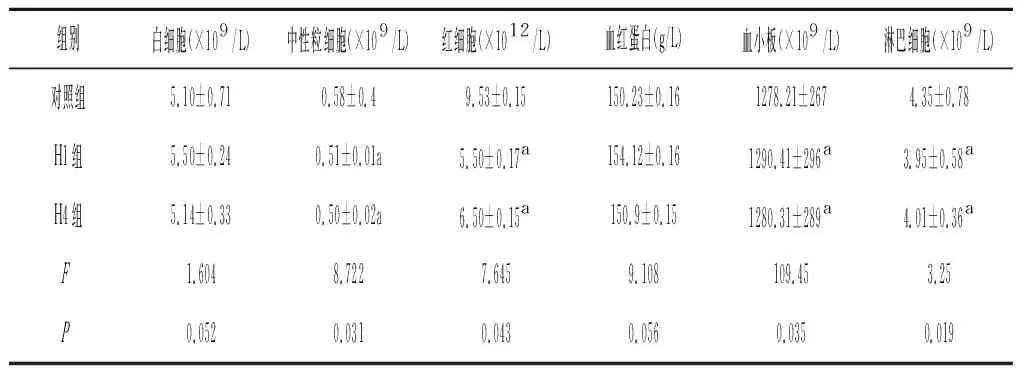
表3 各组小鼠血液主要指标的比较
a为与对照组比较P<0.05
3 讨论
应激反应是机体突然遭受强烈有害刺激,通过下丘脑引起腺垂体分泌增多,从而促使肾上腺皮质系统(Hypothalamus pituitary adrenal,HPA)被激活,糖皮质大量分泌,通过下丘脑释放促肾上腺皮质激素释放激素,垂体释放促肾上腺皮质激素,最终导致糖皮质激素(Glucocorticoids,GCs)大量分泌[8]。产生的反应是局部或全身的应激反应,这种反应与刺激物无关,不具有特异性,通常被认为有适应性意义,但是应激对动物有破坏性一面,比如适应性疾病,下丘脑-脑垂体-肾上腺皮质活动增强,这些器官的激素分泌增加,同时GCs作为HPA系统的终产物,具有免疫抑制作用,可抑制巨噬细胞(macrophages,Mф)对抗原的吞噬和处理,抑制淋巴细胞增殖和细胞毒性及抑制TNF-а、IL-2和IFN-γ的分泌,综上所述,低氧的极端环境不仅对免疫系统有抑制作用,而且对血液循环等其他系统也有相对影响。但数据充分证明低氧对免疫系统的抑制并不是呈正比的。而是在多次的低氧中产生耐受力。说明机体免疫系统的调节是主动的。可以积极面对这种极端环境。在医疗领域,我们可以通过低氧调节,降低人体代谢率,对于一些身患绝症的患者,延长其生存时间。使其治疗时间延长,可以增加患者的治愈机会。
本研究结果显示,低氧严重会对胸腺脾等免疫器官造成负面影响。随着低氧次数的增加脾和胸腺指数分别下降11.12 %、0.5 %。实验中观察发现随低氧次数增加,小鼠在低氧环境的生存时间也越长,说明机体对极限环境的抵抗能力也有所提升。结果可见随低氧次数增加,1次低氧巨噬细胞的吞噬百分率和吞噬指数下降4.61 %、0.2 %。而低氧4次吞噬百分率、吞噬指数略有减少甚至有升高趋势,说明吞噬细胞可能适应了低氧环境的吞噬能反而提升。观察结果可见血红蛋白浓度在第一次低氧中呈上升趋势,而后又恢复到正常值。血小板数目在低氧实验中变化不大。说明低氧对机体凝血功能无影响。实验数据证明淋巴细胞数目在低氧环境中呈下降趋势,但其对低氧有一定抵抗能力。综合本表内容,低氧对于血液营养运输和免疫系统有一定抑制作用,尤其是对于血液营养运输影响最大,但都限制在一定范围内,说明机体对低氧的极端环境有很强的调节和抵抗能力。
