miRNA-1介导的c-Met与宫颈癌进展的相关性研究*
2020-10-22彭景贤岳淑芬赵紫薇杨美霞何金鑫韩晓敏
程 云,彭景贤,岳淑芬,宋 芳,陈 晶,赵紫薇,杨美霞,何金鑫,韩晓敏
(1.包头医学院 组织学与胚胎学教研室,内蒙古包头 014060;2.包头市疾病预防控制中心微生物检验科)
宫颈癌(cervical cancer)发病率位居第二位,仅次于乳腺癌,是女性生殖系统中常见的恶性肿瘤,确诊时多数己属中晚期,且年轻患者的发病率占比逐年增加,对于宫颈癌发生发展机制的探索研究,以及寻找新的治疗靶点成为近年来宫颈癌领域研究的热点与难点[1-2]。近年来,宫颈涂片细胞学检查及HPV检测等早期筛查技术准确率的提升和检查方法的普及,使多数早期宫颈癌患者得到及时有效的治疗;且随着手术、放化疗等治疗方法的不断进步和更新,多种抗肿瘤药物的临床应用,均提高了宫颈癌综合治疗疗效,改善了患者的生存率和生活质量,但肿瘤的复发和转移仍是导致宫颈癌患者死亡的主要因素。
MicroRNA(miRNAs)又称微小RNA,是一类广泛存在于真核细胞中长度约为19~25 nt的非编码单链RNA,在哺乳动物中有高度保守性,通过碱基互补配对与相应靶基因mRNA 3’端非编码区(3’-UTR)结合,导致靶基因mRNA降解或转录后翻译抑制,调控靶基因表达,达到沉默靶基因的效应。miRNA参与多种生物事件及信号转导通路的激活过程,在细胞增殖、分化以及恶性转变过程中发挥调解作用,其生物学功能贯穿整个生命体的发生发展过程[3-4],内源性的miRNA根据生理和病理状态的不同而发挥不同的生物学效应[5]。研究表明,miRNA与肿瘤发生发展,侵袭转移等过程具有相关性,部分miRNA可作为原癌基因,促进肿瘤细胞增殖和迁移;亦有部分miRNA发挥抑癌基因的功能,诱导肿瘤细胞凋亡,抑制肿瘤细胞侵袭转移[6]。随着对miRNA研究的深入,目前在miRNA数据库(miBase,http://www.mirbase.org/)中已经收录了包含动物、植物和病毒miRNA序列,达15 172种,其中人类的miRNA有1 048种。根据预测,哺乳动物约有50 %蛋白质编码基因的激活受miRNA调控,且miRNA的新陈代谢和生物学功能也被精确调节[7]。
miRNA作为抑癌基因而被广泛关注,miRNA在多种肿瘤中均表达下调,如头颈部鳞癌[8]和甲状腺癌[9]等肿瘤中,miRNA在肿瘤组织的表达量低于癌旁组织。miRNA-1与宫颈癌的发生发展具有相关性,miRNA-1主要作用于c-Met基因mRNA的3’UTR和5’UTR区域,引导其mRNA降解或阻止其翻译过程[10]。上皮-间质转化(Epithelial mesenchymal transition, EMT)是肿瘤的迁移浸润及侵袭转移的主要影响因素,肿瘤细胞抑制上皮细胞黏附因子表达,降低细胞间黏附力,降解肿瘤细胞周围的基质,使细胞脱离上皮组织,进而发生侵袭和远处转移。EMT过程中需多条信号传导通路的激活以及多种细胞因子的参与,是一个复杂的由多基因调控的过程。c-Met在多种肿瘤中被证实参与EMT过程,且与肿瘤的发生发展有密切联系[11]。因此,本研究通过分析c-Met、miRNA-1在宫颈癌组织中的表达水平变化,以及其与宫颈癌患者临床病理特征之间的相关性,探究miRNA-1通过调控c-Met介导的EMT参与宫颈癌发生、发展的可能的作用机制,旨在为临床诊断及治疗早期宫颈癌提供新的策略。
1 材料与方法
1.1标本采集 选取内蒙古自治区人民医院2015年3月至2017年3月就诊的50例宫颈癌患者的肿瘤组织及癌旁组织(癌旁组织距离肿瘤组织边缘>5cm)。组织样本取下后立即放于液氮中运输,并于-80 ℃长期保存。根据术中病理检查确诊肿瘤病理类型,50例宫颈癌患者诊断明确,包括25例鳞癌、20例腺癌及其他类型5例。
1.2临床资料 50例宫颈癌患者年龄在35~71岁之间,平均年龄(56.3 ± 8.7)岁,术前均未行放疗、化疗。根据国际妇产科联盟分期标准(FIGO)进行临床分期,包括Ⅰb-Ⅱa期29例、Ⅱb-Ⅲa 期13例、≥Ⅲb期 8例。本研究经医院伦理委员会批准。
入组标准:组织样本均为手术切除标本或是活检组织标本;所有患者均经病理证明为宫颈癌,并经2位病理科医生读片确定分期;收集组织样本的患者不伴有其他慢性疾病或是组织器官的不可控感染;所有入组患者及其家属均签署知情同意书。排除标准:无法取得患者病理组织样本者;不能确诊为宫颈癌患者;不签署知情同意书者。
1.3实时荧光定量PCR检测miRNA-1 取-80 ℃保存的宫颈组织样本约50 mg,在研钵中加入少许液氮及1 mL的Trizol,研磨后,将组织混悬液转移到无RNA酶的EP管中;4 ℃离心机12 000 r/min,离心10 min;取上清液至新的EP管中,加氯仿,震荡15 s,室温静置5 min后,4 ℃离心机12 000r / min,离心10 min;取上清液至新EP管中;加入等体积的异丙醇,上下晃动充分混均后,室温静置10 min后,4 ℃离心机12 000 r/min,离心10 min;去上清,加75 %酒精1 mL,用1 mL无RNA酶的枪头轻轻吹打洗涤,4 ℃离心机12 000 r /min,离心5 min;弃乙醇,室温下静置或60 ℃烤干,加适量DEPC水溶解沉淀,待RNA沉淀完全溶解后,放于-80 ℃冰箱中保存。1 %甲醛变性琼脂糖凝胶电泳鉴定RNA完整性,紫外分光光度计检测RNA浓度及纯度,A260/A280比值在1.8~2.0之间者用于后续逆转录实验。采用microRNA反转录试剂盒(日本,Takara)进行逆转录,反应体系为20 μL,具体操作及试剂用量均严格按照试剂盒说明书推荐的步骤。应用SYBR Premix Ex TaqTMII进行PCR扩增反应,反应体系为20 μL,反应条件为:95 ℃、30 s,95 ℃、3S,60 ℃、30S,共40个循环。具体操作遵循试剂盒说明书推荐步骤。miRNA-1的逆转录引物序列如下:miRNA-1的逆转录引物序列F5’-TGTAGTTTCGGAGTTAGTGTCGCGC-3’。R5’-CCTACGATCGAAAACGACGCGAACG-3’。内参基因U6引物序列F5’-GTTTTGTAGTTTTTGGAGTTAGTGTTGTGT -3’。R5’-CTCAACCTACAATCAAAAACAACACAAACA -3’。根据测得的Ct值采用2-△△Ct法,计算检测基因的相对表达量。△Ct=CtmiRNA-1-CtU6,△△Ct=△Ct实验组-△Ct对照组,最终计算。
1.4免疫组化 将适量宫颈癌组织和癌旁正常组织置于4 %多聚甲醛固定液中固定48 h后进行常规脱水、透明及浸蜡处理;使用莱卡包埋机进行包埋石蜡块,RM2016切片机进行连续石蜡切片,厚度5 μm。石蜡切片置于65 ℃烤箱中过夜,而后梯度脱蜡、水化。水化后的组织切片上滴加3 %过氧化氢溶液以阻断内源性过氧化物酶;而后切片进行酸性修复,采用预先配置好的柠檬酸盐缓冲液,切片置于液体中,采用微波加热法进行。待修复结束后予以1 % BSA室温封闭30 min,加一抗于4 ℃过夜(c-Met:兔抗,abcam,1∶200)。加入辣根过氧化物酶标记的山羊抗兔二抗(1∶200)于组织切片,室温孵育1 h。采用DAB显色后,苏木素染核1 min,而后进行脱水和中性树脂封片。采用正置显微镜观察切片阳性信号,并进行计数统计。
1.5免疫组化结果判读 c-Met在细胞内阳性染色部位为胞膜和胞浆,胞浆内棕黄色颗粒为阳性。采用半定量积分法判定阳性结果,每张切片随机取5个高倍视野(×400),计数100个细胞/视野,首先按染色强度计分:无着色:0分,浅黄色:1分,棕黄色:2分,棕褐色:3分,染色强度根据每张片子的背景着色进行对比。再按显色比例评分:显色细胞占总细胞﹤25 %计1分,显色细胞占总细胞25 %~50 %计2分,显色细胞占总细胞51 %~75 %计3分,显色细胞占总细胞﹥75 %计4分。最后以两者乘积得分值作为判定标准:阴性为0分;+为1-4分;++为5-9分;+++为﹥9分。
1.6术后随访 对纳入研究的50例宫颈癌患者出院后进行随访,每2月随访一次,持续2年。定义生存分析的终止事件为随访期间发生死亡或者达最长随访时间点。50例患者中未见失访病例,所有患者均参与生存分析。
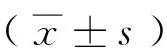
2 结果
2.1宫颈癌组织和癌旁组织中c-Met的表达 原癌基因c-Met是HGF的高度亲和性受体,在正常细胞和肿瘤细胞中均有表达,其持续激活是组织细胞癌变或癌细胞增殖亢进的重要原因。我们通过免疫组织化学检测结果发现,c-Met在癌旁组织中的表达水平明显低于宫颈癌组织,而随着宫颈癌分化程度的加深,c-Met的表达水平呈升高趋势(图1)。这与以往的研究相一致,c-Met表达升高可以促进宫颈癌的发展。
2.2c-Met的表达与宫颈癌病理特征的相关性 对影响宫颈癌预后的因素进行Pearson线性相关性分析,结果提示肿瘤瘤体直径越大、FIGO分期越高以及存在淋巴结转移均提示宫颈癌患者预后呈负相关(P<0.01)(表 1)。我们根据宫颈癌病理特征比较发现,c-Met高表达患者中,多存在肿瘤直径大于4 cm,淋巴结转移和FIGO分期在IIIb以上的病理特征(表2)。这表明肿瘤组织中c-Met表达与宫颈癌病变程度呈正相关, c-Met可促进宫颈癌患者的转移和发展。

表1 宫颈癌患者预后因素分析

表2 c-Met表达与宫颈癌瘤体大小、分期、转移情况
2.3c-Met的表达与宫颈癌患者预后分析 为进一步分析c-Met表达水平与宫颈癌患者总体生存率的关系,我们通过建立Kaplan-Meier和Log-rank分析24个月的随访结果显示,c-Met在肿瘤组织中高表达的宫颈癌患者总体生存率明显低于c-Met低表达患者(图2)。这表明c-Met低表达有利于提高患者总体生存率。
2.4宫颈癌肿瘤组织中miRNA-1的表达 多项研究结果表明,miRNA-1能够通过结合到c-Met的3’-UTR区域抑制c-Met的表达,本研究中我们通过qRT-PCR检测并分析miRNA-1在肿瘤组织和癌旁组织中相对表达量差异发现,miRNA-1在肿瘤组织中表达水平明显低于癌旁组织(图 3),然后我们根据宫颈癌病理特征比较发现,miRNA-1低表达患者中,多存在肿瘤直径大于4 cm,淋巴结转移和FIGO分期在IIIb以上的病理特征, miRNA-1 在肿瘤组织中的表达水平与宫颈癌病变程度呈负相关(表 3)。该实验表明,miRNA-1可能通过抑制c-Met的表达参与了宫颈癌患者的转移和进展。
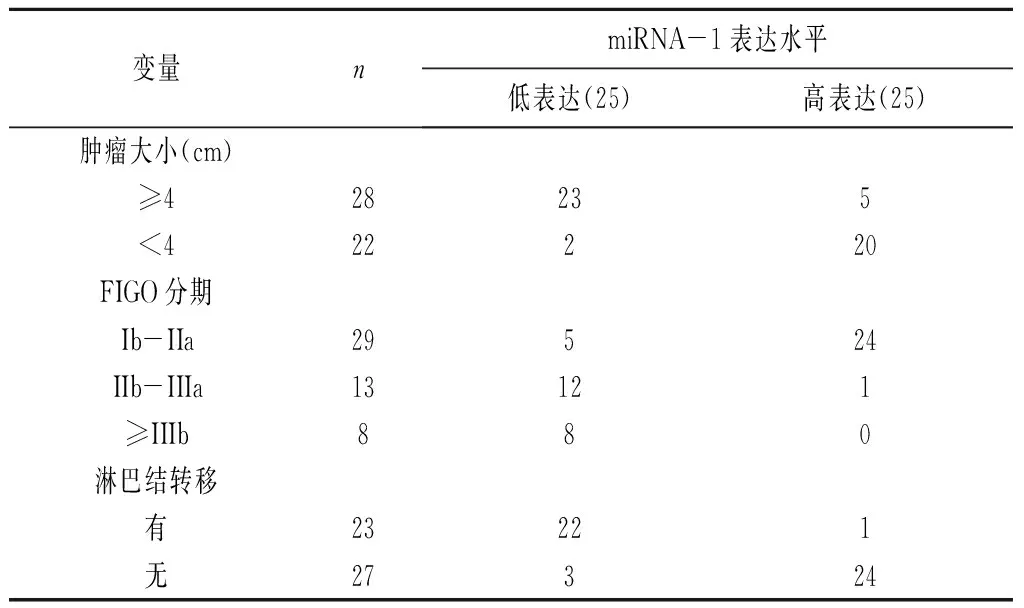
表3 miRNA-1表达与宫颈癌瘤体大小、分期、转移情况
2.5miRNA-1的表达与宫颈癌患者预后分析 我们通过建立Kaplan-Meier和Log-rank分析24个月的随访结果显示,,miRNA-1在肿瘤组织中低表达的宫颈癌患者总体生存率明显低于miRNA-1高表达患者(图4)。这表明肿瘤组织中miRNA-1表达量与宫颈癌患者总生存期密切相关。
3 讨论
本研究检测分析miRNA-1、c-Met在癌旁组织与癌组织中的表达差异,结果显示,c-Met在宫颈癌组织高表达,而miRNA-1在癌组织中低表达;miRNA-1、c-Met与肿瘤直径>4 cm、FIGO≥Ⅲb和有淋巴结转移情况均具有相关性;c-Met低表达,miRNA-1高表达的宫颈癌患者生存率高。根据结果分析得出, miRNA-1在宫颈癌组织中表达和对患者预后具有一致性,并与c-Met相反。
miRNA能与诱导RNA沉默的特异复合体相结合,形成miRNA干扰载体,以碱基互补配对的形式识别目的基因mRNA。当miRNA干扰载体与目的基因mRNA不完全匹配时,抑制该mRNA翻译过程;与目的基因mRNA完全匹配时,特异性降解该目的基因mRNA[12]。miRNA-1在多种肿瘤细胞中表达异常,并参与肿瘤增殖,侵袭,迁移和凋亡过程。研究发现,miRNA-1在鼻咽癌[13],前列腺癌[14],结肠癌[15],肺癌[16]和喉癌[17]中表达均下调,发挥抑癌基因的作用,但在胃癌中表达上调,发挥促癌基因的作用[18],并参与肿瘤细胞的增殖,迁移,侵袭和细胞凋亡的过程。本研究发现miRNA-1在宫颈癌组织中表达低于癌旁组织,说明miRNA-1在宫颈癌中表达下调,且与肿瘤直径>4 cm、FIGO≥Ⅲb和有淋巴结转移情况呈正相关,说明miRNA-1在宫颈癌中发挥抑癌基因的功效,并参与宫颈癌的迁移,侵袭和增殖过程中发挥调控作用。
miRNA-1有多个靶基因,如:HDAC-4,CCND2,LASP-1等,均为细胞的侵袭迁移,增殖分化和凋亡的相关基因,c-Met亦是miRNA-1的靶基因之一,主要参与细胞的增殖和迁移过程[19]。c-Met是肝细胞生长因子(Hepatocyte Growth Factor,HGF)的酪氨酸激酶跨膜蛋白受体,由原癌基c-Met编码,可被单一配体激活,HGF/c-Met信号通路在生理情况下,对于胚胎发育、组织损伤修复起重要作用;异常HGF/c-Met信号转导与恶性肿瘤发生,尤其是肿瘤细胞的侵袭和转移密切相关。c-Met主要表达在上皮细胞中,正常情况下促进胚胎发育、损伤修复、组织再生等重要的生物事件[20]。c-Met在恶性肿瘤细胞中高表达,HGF/c-Met信号通路持续激活,形成不受调控的HGF/c-Met异常自分泌反馈环,诱导并激活黏附因子、降解细胞外基质、促进新生血管形成,促进肿瘤细胞的增殖、分化、浸润和转移[21-22]。研究发现,宫颈麟状上皮内瘤变(CIN)3级者c-Met表达高于CIN1和CIN2级者;HPV阳性者c-Met表达高于HPV阴性者,且c-Met与患者的临床预后存在负相关性,故认为c-Met参与宫颈癌的发生发展过程,其过度表达与正常细胞的转化及肿瘤的发生有关[23]。本研究检测癌组织和癌旁组织中c-Met表达发现,癌组织中c-Met高于癌旁组织,且随着宫颈癌分化程度的加深而升高,与肿瘤直径>4 cm、FIGO≥Ⅲb和有淋巴结转移情况存在正相关(P<0.01),与前人研究一致,证明c-Met参与宫颈癌的侵袭和转移过程。
宫颈癌的发生发展和侵袭转与EMT过程紧密相关,上皮细胞受某些因素调节后失去极性,细胞间紧密连接和黏附能力下降,获得迁移游走的能力,变成具备间质细胞形态和特性的细胞,这种改变即为EMT。研究发现c-Met能够调节肿瘤细胞EMT过程的发生,癌组织中c-Met表达上调,促进EMT进程。本研究通过对收集的宫颈癌组织及癌旁正常组织样本进行分析,结果提示宫颈癌组织中c-Met表达升高,与文献报道结论相符[24-25],c-Met在宫颈癌组织中表达升高,且介导EMT促进宫颈癌发展。
最新研究表明,miRNA-1能够通过结合到c-Met的3’-UTR区域抑制c-Met的表达[26-28]。故此推测,miRNA-1是否通过抑制c-Met的表达参与阻碍癌组织EMT进程,以及其在宫颈癌患者组织中的表达量变化是否也影响患者的生存率。本研究通过对随访结果分析发现,miRNA-1高表达,c-Met低表达时,宫颈癌患者生存率高。综上所述,本研究证实miRNA-1在宫颈癌组织中表达下调,解除c-Met表达抑制,致使c-Met表达明显上调,升高的c-Met介导EMT发生,促进癌细胞上皮-间质转换、迁移与浸润,降低癌症患者生存率。
对于宫颈癌的早诊断、早治疗,除可获得较好治疗效果,还可提高患者生存率,对于某些宫颈癌患者甚至可以治愈。虽然宫颈癌的筛查技术已经广泛应用于临床筛查,但因多种因素影响,仍有部分患者在发现时已处于宫颈癌晚期,出现侵袭转移现象,错过最佳根治治疗的时机,并在后期治疗中无法获得满意疗效。随着对miRNA的深入研究发现,某些miRNA可作为肿瘤标志物,且有较好稳定性。本研究通过检验宫颈癌患者组织与癌旁组织中miRNA-1,确认其在宫颈癌发生发展以及迁移侵袭过程中的作用,为后期研究miRNA-1是否可作为宫颈癌检验的肿瘤标志物提供了基础临床数据。但对于检验宫颈癌患者血液中miRNA-1的表达情况,以及对宫颈癌迁移侵袭作用的分子机制以及调控原理尚需进一步研究分析。
