壳核脑出血应用显微镜辅助微创小骨窗法清除血肿疗效分析
2020-10-22孙季威张少军
张 鹏,孙季威,张少军
(蚌埠医学院第一附属医院 神经外科,安徽蚌埠 233000)
在欧美等西方国家,脑出血占所有脑卒中的8 %~15 %,相比之下,我国则高占21 %~48 %[1]。随着人口老龄化趋势的发展,高血压脑出血(hypertensive intracerebral hemorrhage,HICH)的发病率持续上升[2],它不但严重威胁老年人的生命与健康,更是让家庭与社会肩负沉冗的经济压力[3]。尽管国内外学者在HICH的治疗上付出了巨大的努力,但在治疗策略的择优选取上仍然具有极大的挑战性。目前认为采取手术的方式清除脑内血肿,能有效降低其对脑组织的毒性作用以及占位效应。为探索显微镜辅助微创小骨窗法清除高血压壳核脑出血的医治效果,我院神经外科选择于2018年9月到2019年10月收入治疗尚未出现脑疝的壳核脑出血患者共87例,分为两组,分别采用传统大骨窗开颅血肿清除及微创小骨窗法清除血肿。报告如下。
1 对象与方法
1.1研究对象 选取我院自2018年9月至2019年10月收住的患有壳核高血压脑出血的患者进行回顾性研究。将这些尚未出现脑疝的且具备脑出血手术指征的患者,包括男性40例,女性47例,年龄总体控制在40到70岁之间,血肿量30~80 mL,中线偏移≤1.5 cm,依据随机化原则分为两组。研究组应用微创小骨窗法清除血肿共44例,对照组采取传统的去大骨瓣开颅手术共43例。两组患者的一般资料无统计学差异(P>0.05)。见表1

表1 两组患者一般资料对比
1.2选取标准 (1)纳入标准:年龄在40至70岁之间,确诊为高血压脑出血且术前CT测量血肿体积至少大于30 mL,满足脑出血手术指征,且初始格拉斯哥昏迷评分(GCS)范围在5到13之间的患者被纳入研究。但是必须明确患者未出现脑疝。出血部位必须在壳核以及从血肿到邻近皮质的距离至少应≤2 cm。(2)排除标准:被诊断患有相关合并症的患者,如癌症,长期糖尿病,肾、肝及呼吸功能衰竭等。ICH的根本原因除高血压外,如颅内动脉瘤,脑血管畸形以及凝血功能障碍的患者均予以排除。
1.3手术方案 (1)传统大骨窗开颅(对照组):麻醉满意后,设计翼点扩大切口,自颧弓沿耳屏前绕过耳廓到达顶结节后再向前延长至发际沿帽状腱膜掀起皮瓣,剥离颞肌,颅骨钻孔,铣刀沿皮缘铣开骨瓣(平均大小约12 cm×8 cm),为了避免术后形成硬膜外血肿,悬吊骨窗周围硬脑膜,剪开脑膜后经颞中回入路清除血肿,直视下严格仔细止血后应用人工硬膜覆盖并减张缝合,去除骨瓣,常规在硬脑膜外留置硬一根引流管后缝合肌肉、皮下及皮层并包扎。(2)微创小骨窗法(研究组):麻醉满意后,在颞部耳前1 cm处切开,控制为长约5 cm的直切口,止血后撑开器沿切口两测撑开,颅骨钻孔,经铣刀沿皮缘铣开直径约3 cm的骨窗,并在四周悬吊硬膜,剪开脑膜在显微镜下经外侧裂入路清除血肿严谨止血,无活动性出血后缝合硬脑膜,骨瓣复位,缝合肌肉、帽状腱膜及皮层并包扎。
术后两组患者均予严格监护,调节血压、适度脱水、预防感染、止血护胃等综合性治疗。
1.4统计指标 (1)两组患者术前和术后半月的GCS评分变化;(2)两组患者死亡率及六个月后GOS评分;(3)术后并发症(包括再出血、伤口愈合不良、颅内感染、应激性溃疡、脑梗死、脑外积液、去骨瓣后脑积水)。

2 结果
2.1两组患者术前和术后半月的GCS评分变化 两组患者术前GCS评分均值比较无统计学差异(P=0.075);而手术半个月之后评分差异明显(P<0.05),研究组数据占优势;而两组患者术前术后GCS分别进行对比显示不同手术治疗方案均有成效(P<0.01)。见表2。
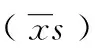
表2 两组术前和术后半月的GCS评分
2.2两组患者死亡率及六个月后GOS评分 在6个月末,将GOS评分达到4~5的患者视为预后良好,研究组中共有40例存活,且GOS评分为4~5的有22人占该组存活总人数的55 %,而对照组中,存活总人数有36人,其中GOS评分为4~5的有19例(53 %),两组患者在死亡率及术后6个月GOS评分上未观察到显著差异(P>0.05)。见表3,表4。

表3 两组死亡率对比[n( %)]

表4 两组术后六个月的GOS评分对比(n)
2.3不同入院GCS评分患者术后6个月GOS评分对比 在术前GCS评分较高的患者中,微创小骨窗组术后6个月预后良好的患者有19例(79 %),与对照组10例(50 %)相比存在统计学差异(P<0.05),可以认为研究组结果较好;而对于术前GCS评分较差的患者,虽然大骨窗开颅组恢复良好共9例(39 %)相对于研究组3例(15 %)高,受病例数量等因素影响,并未观测到统计学学差异。见表5。
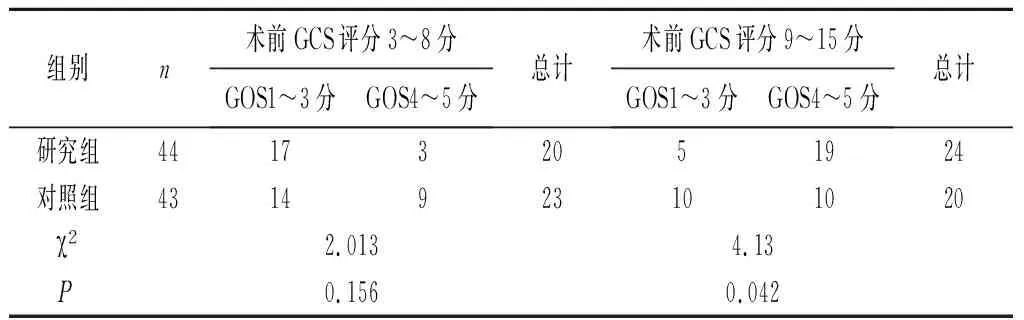
表5 不同入院GCS评分患者术后6个月GOS评分对比(n)
2.4不同手术组术后并发症情况 研究组术后出现近期并发症的患者共8例(18 %),与对照组21例(49 %)相比,差异具有统计学意义(P<0.01),因此可以认为两组术后患者近期并发症发生率不同,且研究组占明显优势。见表6。

表6 两组患者近期并发症情况(n)
3 讨论
据报道,脑内出血患者30 d内死亡率约为44 %,高血压脑出血占所有自发性颅内出血的50~70 %,其发病率和死亡率均在所有类型的中风中居首位,超过30 %的幸存者患有不同程度的残疾,有研究表明血肿量大于50 mL的HICH患者死亡和致残的风险更大[4-7]。HICH通常是因为血压长期维持在高水平,促使血管弹性张力减低,脆性增加,最终引起颅内动、静脉及毛细血管破裂出血。发病后可在短时间内迅速形成血肿,对脑组织产生机械应力及毒性作用引起并进一步加重脑水肿,最终不可避免得引起脑疝。
目前,保守治疗和外科手术清除血肿是HICH的两个主要治疗方向,对于发病后意识清楚,且无意识障碍进行性加重的患者可采用脱水降颅压等保守治疗;若患者有渐进性意识障且并未发生脑疝则提倡手术治疗优先;而已有脑疝的患者无论采用内、外科治疗,其结果均难以改善[8]。手术治疗主要是通过清除血肿,解除其对周围脑组织的机械应力作用,降低颅内压,最大程度的减除危及生命的因素。目前手术方式有传统开颅与微创手术,后者包括经透明鞘神经内镜或经显微镜辅助下清除血肿、血肿穿刺抽吸、脑室钻孔穿刺外引流等。具体患者资料不同,各单位对于手术指征及手术方法的把握也各有差异,但均应根据患者情况选择积极有效的治疗方式。本研究的对象采取有意识障碍进行性加重的满足脑出血手术指征且尚未出现脑疝的壳核脑出血患者,主要针对开颅清除血肿法进行讨论,分别应用传统大骨窗及微创小骨窗法。有研究显示:传统去骨瓣手术视野范围大,可以更加细致的止血,对于血肿的清除也更为完全,且减压效果更加显著[9]。然而,近年来它的缺点也逐渐引起广泛关注,包括手术操作创伤大,脑组织不必要受损多,手术时间过长增加感染风险,水肿反应强,失血量过多等。此外,去除大骨瓣后,脑脊液的搏动性减弱,促使脑脊液循环受阻而形成脑积水[10],且有脑脊液漏向其他脑组织形成脑外积液,部分积聚于皮下引起伤口愈合不良。因此传统开颅清除血肿手术已经不能完全适应目前对HICH的理想治疗效果。随着影像技术及微侵袭神经外科的发展,微创小骨窗手术为HICH患者的治疗打开了另一扇窗,在某些方面,经微创小骨窗清除血肿法已经被证实优于传统去骨瓣开颅手术[11-12]。优点包括手术范围创伤小;减少手术时间,快速解除血肿压迫;降低并发症与死亡率,改善预后,对于出血量较多,且术中脑组织水肿较重,血肿清除后发现不能充分降低脑压的患者,亦可扩大骨窗减压。在显微镜下操作术中既能严密止血,又可避免产生额外脑组织损伤。手术要点在于:分离外侧裂时应注意保护侧裂血管,若分离时存在难度可经皮层造瘘,避免过多损伤,由岛叶进入血肿腔时应避开表面血管,清除血肿过程中如有紧密粘连的质硬血凝块切不可强行牵拉,减少继发损伤。血肿腔内视野受限时需实时调整显微镜角度,尽可能清除残余血肿,术后复位骨瓣,避免因去骨瓣后引起脑脊液动力学障碍[13-14]。分析本次研究结果:在术后6个月GOS评分及死亡率上,两组差异不明显(P>0.05);术前术后GCS评分变化微创小骨窗组更占优势(P=0.017),在术前GCS评分较高的患者中,研究组19例(79 %)预后良好,与对照组10例(50 %)相比,应用小骨窗法术改善比对照组明显(P<0.05);对于术后颅内感染、脑脊液动力学障碍等并发症的总体发生率研究组共8例(18 %)明显低于对照组21例(49 %)(P<0.01)。总体而言,应用微创小骨窗清除颅内血肿对于尚未出现脑疝的且具脑出血手术指征的患者具有良好的适应性。
