GSK-3β抑制剂对类风湿性关节炎小鼠脾脏树突状细胞亚群的影响*
2020-10-21范友羊刘俊周海燕曾家顺李龙
范友羊, 刘俊, 周海燕, 曾家顺, 李龙*
(1.贵州医科大学附属医院 肾病风湿科, 贵州 贵阳 550004; 2.贵州医科大学附属医院 临床医学研究中心, 贵州 贵阳 550004)
类风湿性关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,其临床表现特征是身体周围小关节的受累,病理表现多为关节周围的滑膜炎和血管痉挛,关节软骨和软骨下骨被破坏,最终导致关节残疾[1]。全球RA的发病率为0.5%~1.0%,我国为0.42%左右,患病人群约有500万,男女患病比例约为1 ∶4,病程1~5、5~10、10~15及≥15年的致残率分别为18.6%、43.5%、48.1%及61.3%,这表明随着疾病的进展、残疾及功能受限发生率升高[2]。虽然RA发病机制仍未明确,但多数学者认为CD4+T细胞的分化和功能障碍是其发病的重要原因[3-4]。树突状细胞(dendritic cell,DC)是体内最强大的专职抗原呈递细胞(antigen presenting cell,APC),具有激活免疫应答和诱导免疫耐受的功能,在维持体内免疫调节平衡方面发挥关键作用[5-6]。研究表明,DC的亚群和功能状态能直接影响T细胞的活化和分化,调节DC的功能将对T细胞介导的疾病产生不同的影响[7]。糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)是一种多功能丝氨酸/苏氨酸蛋白激酶,能够平衡促炎或抑炎细胞因子的表达,并影响免疫细胞的分化、成熟及功能,在获得性免疫和先天免疫中均起重要作用[8]。近年来,GSK-3β已成为许多信号通路的重要调节因子,抑制GSK-3β的活性可以抑制促炎细胞因子的产生[9],减少内毒素血症引起的器官损伤[10]。最近的研究表明抑制GSK-3β对RA的发展也有抑制作用[11-12],然而目前抑制GSK-3β的抗炎作用机制尚不完全清楚,因此本研究观察GSK-3β抑制剂对Ⅱ胶原诱导型关节炎(collagen-induced arthritis,CIA)小鼠的治疗作用及其与DC亚群变化的相关性,旨在探讨GSK-3β抑制剂治疗CIA小鼠的作用机制,现将结果汇报如下。
1 材料与方法
1.1 材料
1.1.1实验动物 Specific Pathogen Free(SPF)级近交系DBA/l小鼠19只,雄性,6~8周龄,购于上海斯莱克实验动物有限公司(许可证编号SCXK2017-0005);SPF级环境中饲养,标准饮食,环境温度20±2 ℃,相对湿度30%~70%,适应性喂养1周后开始试验。
1.1.2主要试剂与仪器 鸡Ⅱ型胶原、完全弗氏佐剂购和多聚甲醛均购自美国Sigma 公司,苏木素-伊红(hematoxylin-eosin staining,HE) 试剂盒和RPMI-1640细胞培养液均购自中国索莱宝有限公司,APC-cy7-CD3e、BV421-CD4、PerCP-Cy5.5-CD8a、PE-cy7-CD19、PE-CF594-CD11c及BB515-I-A/I-E购自美国BD Biosciences公司,GSK-3β抑制剂4-苄基-2甲基-1,2,4噻二唑烷-3,5-二酮(Thiadiazolidinones-8,TDZD-8)购自上海阿拉丁公司;Navios流式细胞仪购自美国Backman公司。
1.2 方法
1.2.1小鼠CIA模型的建立、分组及临床评价 19只DBA/l小鼠分为正常组5只、模型组7只及治疗组7只,模型组与治疗组小鼠均参照经典的CIA模型方法制备CIA模型[13-16],造模期间正常组小鼠无特殊处理,治疗组小鼠于造模后第22天开始每天腹腔注射5 mg/kg TDZD-8试剂[17],模型组与正常组均予等量生理盐水腹腔注射,连续注射2周;于腹腔注射药物隔日开始每3 d评估1次模型组与治疗组小鼠足趾肿胀程度及关节炎指数评分(arthritis index,AI),未出现红肿记0分、出现足趾关节红肿记1分、趾关节和足跖均红肿记2分、踝关节以下均出现红肿记3分、包括踝关节全部出现红肿记4分,每只爪子均评分,最高评分为16分[18-20]。第46天脱颈处死全部小鼠,取踝关节及脾脏做进一步检测。
1.2.2组织学观察和GSK-3β表达检测 取1.2.1项下小鼠右后肢踝关节,剔毛发及肌肉后浸泡于4%多聚甲醛溶液,固定3 d,放10%EDTA液,脱钙1~2周,常规石蜡包埋、4 μm切片,HE染色,普通光镜观察;采用免疫组织化学检测小鼠踝关节处GSK-3β表达,显微镜下观察,采用Image-Pro Plus测量各样本的阳性光密度值(integrated optical density,IOD)。
1.2.3脾脏淋巴组织驻留型DC(cDC)及CD8+cDC、CD4+CD8-cDC、CD4-CD8-cDC各亚群 取1.2.1项下小鼠脾脏,去包膜后切成0.2 cm×0.2 cm的脾片,置于含RPMI-1640细胞培养液的平皿中碾磨,200目网筛过滤获细胞悬液;PBS冲洗收集细胞悬液,1 000 r/min常温离心10 min,弃上清;加入红细胞裂解液2 mL,避光孵育8 min,4 000 r/min离心5 min弃上清;将细胞调整为1×106mL(台盼蓝染色活细胞数>95%),分别加入APC-cy7-CD3e、BV421-CD4、PerCP-Cy5.5-CD8a、PE-cy7-CD19、PE-CF594-CD11c及BB515-I-A/I-E各1 μL混匀,4 ℃放置30 min ,PBS洗涤2次,PBS 0.5 mL重悬细胞,流式细胞技术检测,使用FlowJo 10软件分析结果,参照文献[20]方法排除T细胞CD3+和B细胞CD19+后,以CD11c+MHCⅡ+细胞占脾单细胞数量反映脾经典DC(conventional DC,cDC)数量。
1.3 统计学分析

2 结果
2.1 AI评分
与模型组相比,治疗组小鼠AI评分在初次免疫后第33天开始下降,差异有统计学意义(P<0.05或P<0.01)。见表1。

表1 GSK-3β抑制剂对小鼠关节炎指数的影响Tab.1 Effect of GSK-3β inhibitors on
2.2 小鼠体征
正常组小鼠在整个实验期间的精神和饮食水分活动均正常,毛色光滑有光泽。 动作自由,双足无明显红肿,足趾垫无明显肿胀和增厚,活动基本正常; 与正常组小鼠比较,CIA模型组小鼠的进食减少,伴随着毛色失去光泽,有轻微的脱毛,行动迟缓,足部关节发红、出血及有溃疡; 与模型组对比,治疗组小鼠饮食、毛色光泽、脱毛以及关节处红肿、出血点等现象明显好转。见图1。
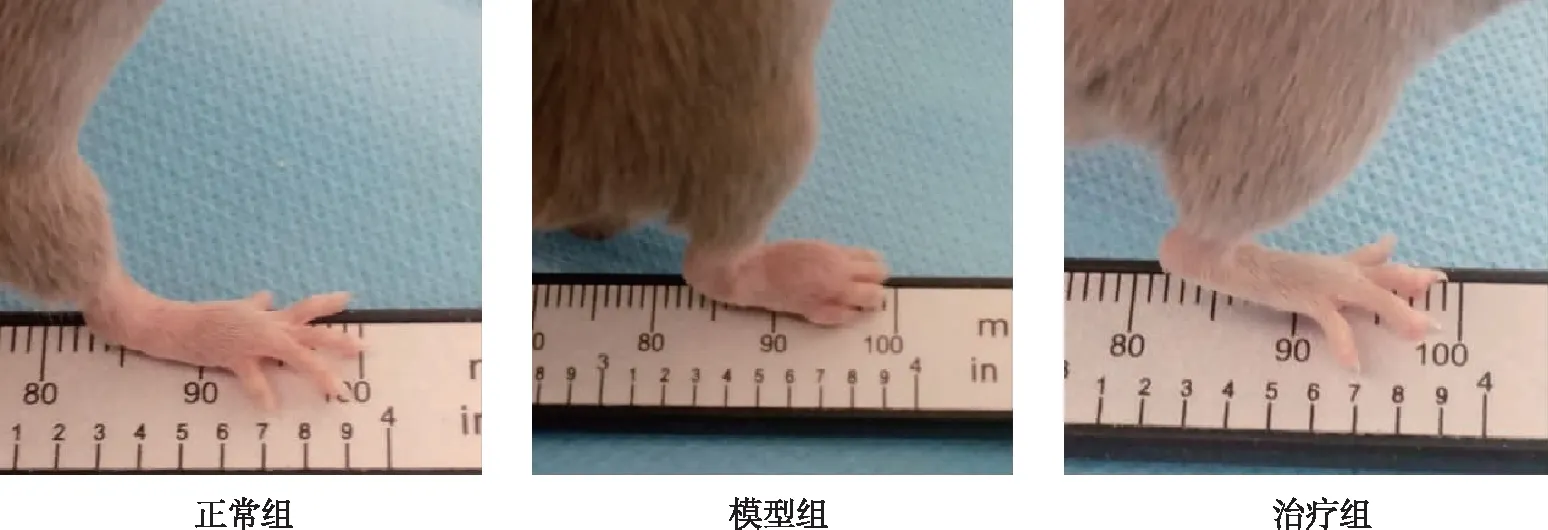
图1 各组小鼠足趾肿胀情况Fig.1 Toe swelling of mice in each group
2.3 踝关节组织学观察
HE染色病理切片镜检结果显示,正常组小鼠踝关节滑膜细胞单层排列,未见炎性细胞浸润及新生血管形成;模型组小鼠踝关节滑膜细胞明显增生,层次增多,排列紊乱,有大量炎性细胞浸润,新生血管增生,滑膜下层纤维组织增生,血管翳形成,可见滑膜向软骨表面侵蚀性生长,破坏软骨组织;治疗组小鼠踝关节滑膜组织轻度增生,少量炎性细胞浸润,可见少许新生血管增生,无明显软骨及骨组织破坏。见图2。

图2 各组小鼠踝关节的组织学(HE,×100)Fig.2 Pathological changes of ankle joint tissues of mice in each group(HE,×100)
2.4 踝关节组织切片GSK-3β蛋白的表达
GSK-3β阳性呈褐色或黄褐色,主要表达在小鼠的踝关节滑膜上皮和上皮下的疏松结缔组织中;治疗组小鼠踝关节GSK-3β蛋白表达低于模型组,高于正常组,差异均有统计学意义(P<0.05)。见图3。

注:A为免疫组织化学检测结果(400×),B为GSK-3β阳性IOD值;(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。图3 GSK-3β抑制剂对各组小鼠踝关节GSK-3β蛋白变化的影响Fig.3 Effect of GSK-3β inhibitor on the changes of GSK-3β protein in the ankle joint of mice
2.5 GSK-3β抑制剂对CIA小鼠脾脏总cDC细胞及其亚群的影响
模型组小鼠脾脏总cDC比例较正常组低,治疗组较模型组高,差异均有统计学意义(P<0.05);模型组小鼠脾脏CD4+cDC比例较正常组低,治疗组较模型组高,差异均有统计学意义(P<0.05);正常组小鼠脾脏CD8+cDC与模型组、治疗组之间差异无统计学意义(P>0.05);模型组小鼠脾脏CD4-CD8c-cDC较正常组高,治疗组较模型组低,差异有统计学意义(P<0.05)。见图4。

注:(1)与正常组相比,P<0.05;(2)与模型组相比,P<0.05。图4 各组小鼠脾脏总cDC及各亚群比例的比较Fig.4 Ratio of total cDC and its subsets in spleen of each group
3 讨论
CIA是一类实验动物自身免疫性关节炎,是由天然Ⅱ型胶原蛋白与完全弗氏佐剂等量乳化后免疫易感动物引起的[21-22]。由于其症状特征,病理变化和免疫指标与人RA非常相似,因此被世界公认为人RA动物模型之一[23]。在该实验中,通过向DBA/IJ小鼠尾根部皮内注射完全弗氏佐剂与鸡Ⅱ型胶原的乳化液诱导CIA模型,模型组小鼠足趾在初次免疫后25 d出现红肿,随后病情进一步加重,累及整个足趾及踝关节,在第1次免疫后33 d病情达到峰值;组织病理学观察显示,滑膜细胞明显增生,大量炎性细胞浸润,新生血管增生,滑膜纤维组织增生,血管翳形成等典型的RA病理改变,表明该模型已成功建立。此结果与相关文献报道一致[24-25]。随后,通过该模型小鼠观察了GSK-3β抑制剂TDZD-8对RA发病的影响。结果发现,腹腔注射TDZD-8能明显缓解CIA小鼠踝关节红肿,活动受限等症状,降低关节病理损伤程度等,说明GSK-3β抑制剂确实能缓解RA的关节病变。亦与近期研究报道相符[11-12]。
一般根据是否有β-catenin蛋白参与,将Wnt信号通路分成经典信号通路和非经典信号通路[26]。大多数关于Wnt 信号通路的研究都关注于β-catenin蛋白介导的经典信号通路[27]。大量研究表明,Wnt信号可以通过调节成骨细胞及破骨细胞的增殖和分化来促进骨形成[28-31]。通过免疫组化结果显示,模型组小鼠滑膜GSK-3β蛋白含量较正常组升高,表明模型组小鼠中Wnt信号通路受到影响,被磷酸化标记的β-catenin被泛素化降解,从而进一步影响成骨细胞的分裂、分化及成熟;使用GSK-3β抑制剂后GSK-3β蛋白降低,表明模型组小鼠中GSK-3β抑制剂通过抑制GSK-3β蛋白的表达,从而使β-catenin去磷酸化,造成β-catenin 在细胞内蓄积,从而介导下游靶基因的表达,保证成骨细胞的分裂、分化及成熟。
DC是一种包含众多功能亚群的异质性群体,常根据表型和功能的不同分为cDC和浆细胞样DC(plasmacytoid DC,pDC)[32-33],DC领域大部分研究工作都围绕cDC展开。在小鼠脾脏中cDC又可以分为CD8+cDC、CD4+CD8-cDC和CD4-CD8-cDC三个亚群。Balanescu等[34]检测RA患者的关节滑膜组织和滑膜液时发现滑膜液中的DC数量增多,且高表达CD80、CD86及HLA-DR等共刺激分子,但在外周血中无明显差异,说明共刺激分子的表达及DC活化状态与RA关节局部组织炎性浸润有关。Jongbloed等[35]进一步证实了滑膜组织中DC数量的大量聚集。脾脏作为机体最大的外周免疫器官,是发挥免疫应答效应的重要场所[36],其DC亚群及比例等是否存在变化目前相关报道甚少。本研究通过流式细胞术检测发现,CIA小鼠脾脏中淋巴组织驻留型cDC明显下降,而经GSK-3β抑制剂治疗后其比例又明显上升,可能是由于脾脏中cDC迁移至滑膜关节组织,参加了炎症反应,GSK-3β抑制剂能抑制cDC迁移至滑膜关节组织,从而缓解RA炎症反应。本研究还发现应用GSK-3β抑制剂TDZD-8后,相较于模型组脾脏总cDC及CD4+cDC比例明显升高,CD4-CD8-cDC比例明显下降,CD8+cDC仍无明显变化,这一结果表明GSK-3β抑制剂能治疗RA的原因还可能是通过调节脾脏cDC各亚群的比例来发挥作用的。
综述所述,GSK-3β抑制剂能明显改善CIA小鼠关节病变情况其及病理表现,可能作用机制是通过调节脾脏cDC数量及各亚群的比例来实现。但本研究聚焦于小鼠脾脏中cDC各亚群的比例,而pDC亚型及滑膜处DC各亚群可能也不同程度的参与疾病进展,有待进一步的研究。
