枯草芽孢杆菌诱变菌mutHS-407产活性物质的纯化及对黄曲霉菌的抑制作用
2020-10-21马艺萌,丛丽娜,胡雅莉,谢定刚
马 艺 萌, 丛 丽 娜, 胡 雅 莉, 谢 定 刚
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
枯草芽孢杆菌作为有效益生菌产生的抗菌物质大多为低分子抗菌脂肽[1]。其独特的化学组成和两亲性的小分子肽结构,因此具有低抗药性、低毒、抗菌谱广、热稳定性高、生物可降解等优点,是一类绿色、安全、高效的抗生素替代品,又称为脂肽类抗生素[2]。近年来,从海洋微生物中不断发现具有生理意义的新次级代谢产物[3],这类物质通常具有陆地微生物所没有的独特结构,在抗病菌、抗肿瘤、抗病毒等方面具有良好表现[4]。
黄曲霉(Aspergillusflavus)属于曲霉属真菌,在自然界分布很广,常存在于土壤和其他物质中[5],依靠产生的分生孢子和菌核在作物中交叉感染,侵染粮食、油料作物的种子、各种食品和饲料等,导致农作物减产,威胁人类和畜禽健康[6]。黄曲霉毒素是由黄曲霉产生的,具有很强的毒性,被认为有致癌性、致突变、致畸性、抑制免疫力等作用,并可引起肝部损伤等危害[7]。因此黄曲霉的生物防治成为国内外研究的热点。
目前利用用物理、化学方法防止黄曲霉的生长及清除毒素的研究比较多,但效果并不理想且成本较高[8]。本实验通过对枯草芽孢杆菌进行抗真菌物质的提取纯化[9],并对纯化后的活性物质进行扩大培养,最终应用于抗黄曲霉实验[10]。
1 材料与方法
1.1 材 料
1.1.1 实验菌株
供诱变筛选的实验菌株为枯草芽孢杆菌HS-301,由本实验室分离筛选并保藏。
供试指示菌为金黄葡萄球菌(Staphylococcusaureus)、副溶血性弧菌(Vibrioparahaemolyticus)、铜绿假单胞菌(Pseudomonasaeruginosa)和黄曲霉菌(Aspergillusflavus),本实验室购买并保存。
1.1.2 培养基
LB培养基:0.5%酵母浸粉,1%胰蛋白胨,1% NaCl,pH 7.2~7.4。固体培养基需另加1.8%琼脂。
发酵培养基:1%葡萄糖,1.5%牛肉膏,0.5%磷酸氢二钾,pH 7.0。
黄曲霉(Czapek’s)培养基:蔗糖30 g/L;NaNO33g/L;MgSO4·7H2O 3 g/L;KCl 3 g/L;FeSO4·4H2O 3 g/L;K2HPO43 g/L;琼脂 15 g/L;蒸馏水1 L;pH 6.0~6.5。
1.2 方 法
1.2.1 诱变菌株的筛选
将枯草芽孢杆菌HS-301进行活化培养并制备108CFU/mL菌悬液,用紫外照射10 s对菌液进行诱变。将菌液涂布培养,挑取形态特征不同的单菌落分离并进行试管发酵培养。通过牛津杯法对诱变菌株进行初筛和复筛。利用黄曲霉真菌作为指示菌进行进一步筛选,筛选出一株对黄曲霉菌抑制效果最为显著的诱变菌株,命名为mutHS-407,并对其进行传代培养和稳定性检测。
1.2.2 抗菌活性提取物的制备及分子量确定
采用酸沉淀分离法,将菌株mutHS-407的发酵上清液pH调至2,得到白色沉淀,放置4 ℃过夜。次日将所得沉淀用甲醇溶解过滤后进行真空抽提,得到含有抗菌活性物质的提取物干品。通过Tricine-SDS-PAGE凝胶电泳检测该提取物中的活性物质的分子质量。
1.2.3 抗菌活性测定
采用滤纸片法对菌株mutHS-407产物的提取物进行抑菌活性测定。提取物用甲醇充分溶解后作为样品组,无添加的甲醇作为对照组,将黄曲霉菌培养液均匀涂布于Czapek’s固体培养基上,待平板干透向滤纸片中加样。分别将实验组及对照组进行3次平行实验,观察并比较抑菌圈大小。
1.2.4 抗菌活性粗提物的组分分离
采用30 mm×300 mm硅胶柱对提取物进行单组分分离。将2 g提取物干品进行上样后,通过氯仿-甲醇混合液梯度洗脱,按照每个梯度洗脱一个柱体积的方式逐级洗脱。对收集到的每管洗脱液进行黄曲霉菌抗菌效果检测。将对黄曲霉菌有抑菌作用的洗脱液合并蒸干,命名为OP-1。
采用Amberlite XAD l600型大孔吸附树脂(20 g)对蒸干后的组分进一步分离纯化[11]。用甲醇和水分别冲洗树脂一个柱体积后进行梯度洗脱,分管收集。对洗脱液进行抑菌活性分析,合并具有抑霉菌活性的洗脱液后再次蒸干,即获得纯度较高的抗菌活性化合物,命名为OP-2。
1.2.5 高效液相色谱及质谱分析活性物质
采用Unitary C18柱,进行流动相为乙腈和超纯水的梯度洗脱。收集纯化后的单组峰团并浓缩,作为下一步质谱鉴定的样品。进一步应用MALDI-TOF-MS技术及DataExplorer软件准确分析其分子质量[12]。
1.2.6 抗菌活性提取物在花生防霉中的应用
称取不同浓度的由菌株mutHS-407发酵液所产的抗菌提取物,用无菌蒸馏水溶解。每100 mL 三角瓶中加入相同质量灭菌后的花生,并加入10 mL各浓度的抗菌提取物,充分混匀后接入相同浓度黄曲霉孢子悬浮液,放入培养箱后观察并记录花生上黄曲霉菌的生长情况。
2 结果与讨论
2.1 抗菌粗提物的制备及抑菌活性分析
利用枯草芽孢杆菌HS-301原始菌进行紫外化学复合诱变,采用牛津杯法进行初筛,得到了5株对常见食物细菌有明显抗菌作用的诱变菌株,如表1所示。为了获得对真菌也具有强烈抗菌作用的菌株,接着对筛选出的5株诱变菌进行二次筛选,由于在已知的真菌毒素中,黄曲霉毒素的毒性较大且致癌性最强,因此复筛以黄曲霉菌作为主要指示菌。结果发现,诱变菌株mutHS-407比原始菌HS-301对于黄曲霉菌的抑制作用有显著增加。并对其进行传代培养,结果如表2所示。可以看出该诱变菌株性质稳定,可长久保存。
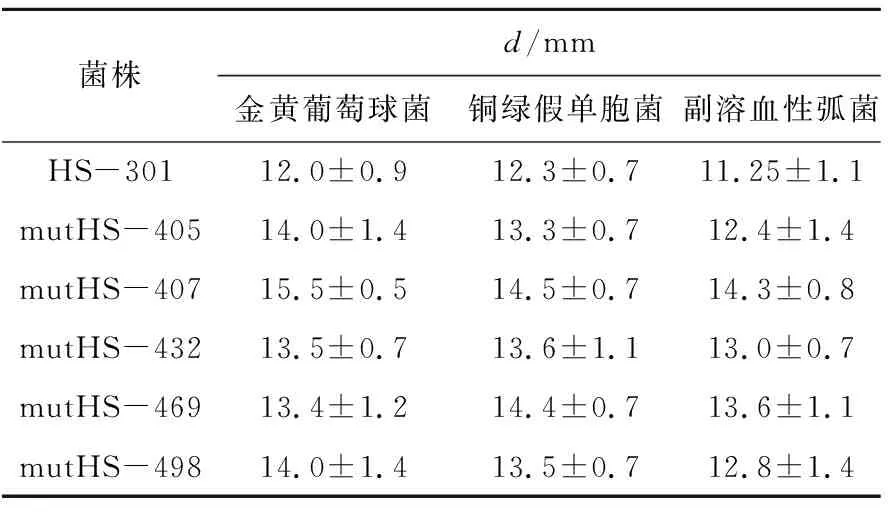
表1 诱变菌和原始菌的抑菌活性比较Tab.1 Comparison of antibacterial activities between mutagenic and original strains
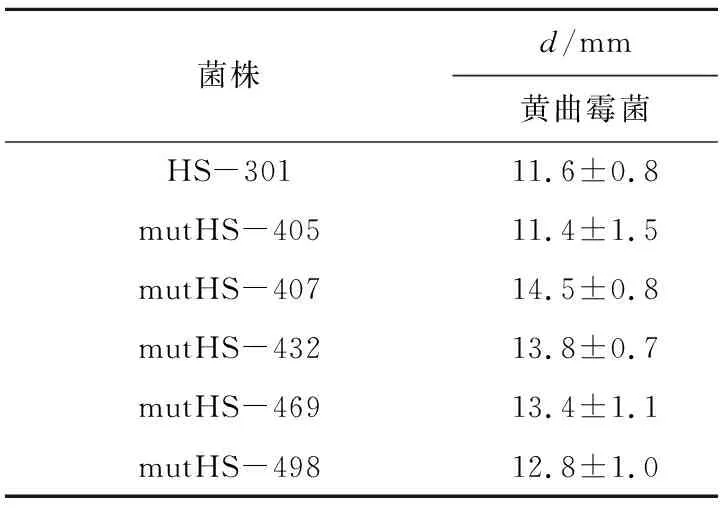
表2 诱变菌和原始菌的抗霉菌活性比较Tab.2 Comparison of antibacterial activities between mutagenic and original strains
由图1可以看出,原始菌株所形成的透明抑菌圈在培养4 d后被黄曲霉菌丝完全覆盖,而诱变菌株mutHS-407的透明圈依旧清晰,由此可见该诱变菌株中的活性物质对黄曲霉菌具有很强的抑制作用,且性质稳定。因此筛选得到的菌株mutHS-407对常见食用细菌和真菌均具有比原始菌株更强的抗菌效果,其中对霉菌的抑制作用效果更加明显。

(a) HS-301

(b) mutHS-407图1 诱变菌和原始菌对黄曲霉菌的抑制作用Fig.1 Inhibition of A. flavus by mutagenic and original strains
2.2 活性物粗提及分子质量测定
对诱变菌株mutHS-407进行发酵培养,通过酸沉和有机试剂抽提法对该发酵液进行抗菌活性物质的提取,得到抗菌活性提取物OP,呈黄棕色粉末状。对该提取物干品质量及原始菌体湿重进行称量,菌体湿重为38.956 g/L,产率为2.305 g/L。
如图2所示,Tricine-SDS-PAGE凝胶电泳检测到OP中的活性物质分子质量在3.3 ku以下,即提取物中包含的是小分子质量活性物质。
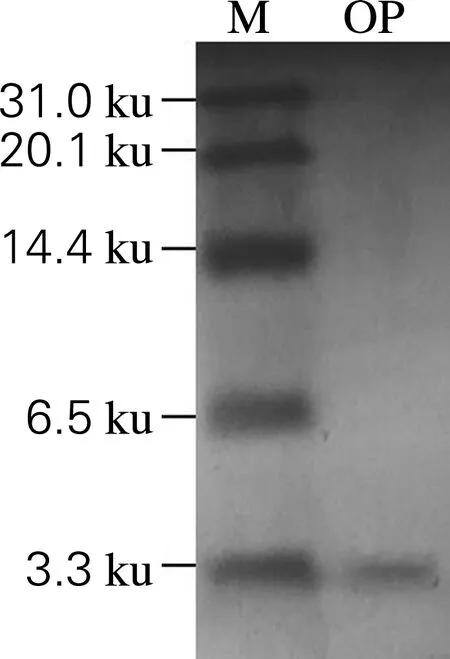
M,标准Marker; OP,抗菌提取物图2 Tricine-SDS-PAGE电泳分析图Fig.2 Result of Tricine-SDS-PAGE electrophoresis analysis
2.3 组分活性检测及液相色谱和质谱分析
如图3所示,粗提物OP经TLC板分析并经254 nm紫外光显色后,分离出4种活性成分,通过抑菌实验证明了其中a和b两种活性成分对4株细菌具有一定的抑制作用,而对真菌无作用;成分d仅对两株革兰氏阴性的海洋致病菌有抑制作用;只有成分c对真菌黄曲霉菌有明显抑制作用,同时对4种细菌也具有抑菌活性。

图3 粗提物的TLC分析Fig.3 TLC results of the crude extracts
对抗菌提取物及其分离纯化组分进行高效液相色谱分析,如图4所示。图4(a)为从诱变菌株mutHS-407中提取出的抗菌提取物OP,图中可观察到有许多活性物质峰,其中包含了图3中的4种活性成分,主要的两组活性峰团的出峰时间在16~18 min和22~25 min。图4(b)是经硅胶柱层析对提取物OP进行分离得到的活性组分OP-1,由峰图可见,在去掉一组主要的峰团后,其出峰时间主要集中在16~18 min;并且经抑菌活性分析,该组峰团对黄曲霉菌具有明显抑制作用。由于纯度尚未达到目标,将组分OP-1经大孔吸附树脂进一步分离纯化,从图4(c)中可以看出,此次分离得到了一个单一的活性组分(质量分数达92.42%)。经TLC分析OP-1和OP-2发现,两组组分中主要包含的是图3中的活性成分c,并在过柱纯化过程中将a、b、d 3种成分去除。
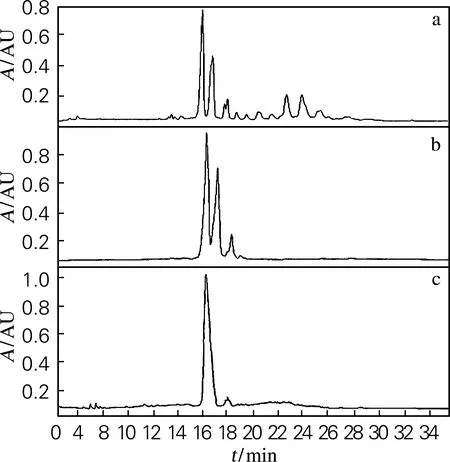
图4 抗菌提取物及其纯化组分HPLC分析Fig.4 HPLC results of antibacterial crude extracts and its purified components
经MALDI-TOF-MS质谱分析,与数据比对后证明在最初提取物OP中,a和b的主要活性物质为溶杆菌素(Bacilysin)和芬荠素(Fengycin)的混合物;c的主要活性物质为杆菌霉素D(BacillomycinD);d的主要活性物质为伊枯草菌素(Iturin)。因此能够证明,该实验最终得到的纯化组分OP-2中的活性物质主要为成分c中的脂肽类化合物杆菌霉素D。
将3个活性组分物质OP、OP-1和OP-2进行黄曲霉菌的抑菌实验,结果如5所示。在相同质量浓度(10 mg/mL)下,纯化组分OP-2的抑菌活性均高于OP和OP-1。表明枯草芽孢杆菌诱变株mutHS-407所产生的杆菌霉素D对黄曲霉菌有很强的抑制作用。

(a) OP

(b) OP-1

(c) OP-2图5 活性组分对黄曲霉菌的抑制作用Fig.5 Inhibition of A. flavus by antibacterial components
2.4 抗菌提取物在花生中的最佳质量浓度及验证
将加入了不同质量浓度抗菌提取物的花生和对照组,放入培养箱中温育6 d,取出观察并计算每组花生的发霉数量,结果如图6所示。当抗菌提取物质量浓度为40 mg/mL时,可完全抑制花生中黄曲霉菌的生长,所以选择提取物质量浓度为40 mg/mL。
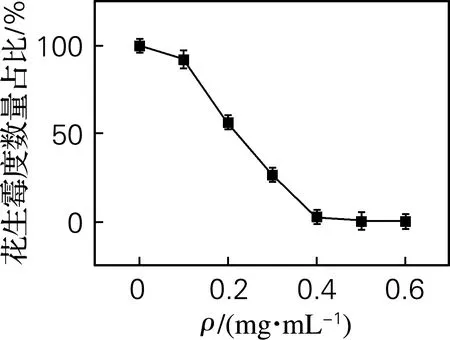
图6 不同质量浓度提取物对花生霉变的影响Fig.6 Effects of different concentrations of extracts on peanut mildew
检验40 mg/mL提取物的抗菌效果,如图7所示。在相同条件下培养10 d后,对照组能明显看出所有花生均发霉且长出浓密的黑色孢子及菌丝,而添加40 mg/mL提取物仅有少数花生发芽却未长黄曲霉菌。可以推断该抗菌提取物可有效地防止花生及其他粮食的霉变。

(a) 添加40 mg/mL抗菌提取物
向枯草芽孢杆菌诱变菌mutHS-407的菌株发酵液中加入5%的玉米淀粉,搅拌均匀并进行真空喷雾干燥,按照与市面常见防霉剂相同的加工工艺,制备成抗菌肽干粉。如表4所示,将该产品与市面上5种常见脱霉剂进行花生的抗霉菌实验对比,向含有相同质量浓度黄曲霉菌悬浮液的等量花生中,分别添加表4中的6种脱霉产品,观察并计算最低抑菌浓度。结果表明,在相同质量浓度条件下,除了添加了化学成分的脱霉剂,通过本实验筛选得到的诱变菌株mutHS-407的抑菌效果比市面上其他生物防霉剂的抑菌效果更明显,抑菌作用更强。

表4 脱霉产品名称及主要成分Tab.4 The main components of mould free products
3 讨 论
通过对枯草芽孢杆菌HS-301进行紫外化学复合诱变,筛选出一株对黄曲霉菌有强烈抑制作用的高产抗菌肽诱变稳定菌株mutHS-407,通过对其中抗真菌活性物质的提取,得到抗菌脂肽提取物。利用硅胶柱层析和大孔吸附树脂两步纯化,得到单一活性组分,通过高效液相色谱和质谱分析和鉴定该组分,发现其中主要物质为杆菌霉素D,且其质量分数高达90%以上。将该抗菌活性提取物应用于花生的抗霉菌实验中,发现其抗霉菌效果显著。得到的抗菌提取物有望开发并作为新型生物防霉剂,并应用到食品及饲料工业中。
