酶转化法和金属离子催化法联用制备人参皂苷Rh2系列异构体
2020-10-21吴鑫慧,刘春莹,徐龙权,宋建国,鱼红闪
吴 鑫 慧, 刘 春 莹, 徐 龙 权, 宋 建 国, 鱼 红 闪
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.大连大学 生命科学与技术学院, 辽宁 大连 116622 )
0 引 言
人参(PanaxginsengC. A. Meryer)属五加科植物,是我国传统的名贵中药[1]。人参皂苷是人参中的主要有效成分,大约占总质量的4%[2]。现代药理学研究表明,人参皂苷Rh2能够抑制癌细胞的扩散,对肿瘤的治疗有极为重要的作用[3-4]。人参皂苷Rh2属于稀有皂苷,虽然活性高,但在人参植物中含量极少,所以如何高效简便的转化人参皂苷Rh2是近年来的研究目标[5]。
目前催化转化人参皂苷的方法很多,大多数使用化学法和生物转化法。化学法大多采用强酸强碱、高温高压,反应剧烈,缺乏方向性和目的性,产生复杂的产物,并且会对环境造成严重污染[6-7]。而生物转化法是用不同性质的生物酶作用于不同构型和组成的糖苷键或苷键,达到定向水解的目的[8]。该方法反应温和,有很强的底物特异性,产物单一[9]。酶催化法反应温和,目的性强,产物的下游分离纯化相对容易,不会造成环境污染[10]。但要采用酶作为催化剂需要进行酶的制备和纯化,生产周期长,且酶易失活,不易存储较长时间[11-12]。
实验室前期在对人参皂苷转化方法的研究中发现,Fe3+可以催化人参皂苷F2转化为人参皂苷Rh2。该催化反应条件温和,常温常压下就能进行,产物相对单一,后期产物容易分离[13]。另外,Fe3+可以回收利用,减少了对环境的污染[14]。
本实验采用酶转化法和Fe3+催化法,首先以原二醇类人参皂苷(PPD)为底物采用酶转化法制备人参皂苷F2;再以人参皂苷F2为底物采用Fe3+催化法进一步转化制备人参皂苷Rh2,并分析了催化产物中人参皂苷Rh2系列异构体的质量分数和组成情况。
1 材料与方法
1.1 试剂与仪器
菌株Aspergillusnigerg.848,大连工业大学菌种保存室提供。F2、20(S,R)-Rh2、Rk2和Rh3对照品以及PPD样品,实验室自制。HPLC试剂为色谱纯,其他试剂均为国产分析纯。
Silica Gel 60-F254薄层层析板,德国Merck公司;Waters 2695-2424高效液相色谱仪,美国Waters公司。
1.2 方 法
1.2.1 酶液的制备
大批量培养A.nigerg.848菌株,接种至糖度为5°的麦芽汁液体发酵培养基中,pH 6.8,加入体积分数1%的人参浸出液。30 ℃下摇床发酵培养5~6 d,将发酵培养后的培养基离心,除掉不溶杂质,取上清液在搅拌条件下加入适量硫酸铵粉末,调至饱和度80%,4 ℃下静置4 h后离心除去沉淀,静置过夜,第2天离心收集酶蛋白沉淀。将沉淀溶于1/10培养基体积的0.02 mol/L NaAC-HAC缓冲液(pH 5.0),离心除掉不溶物质,所得上清液即为粗酶液,4 ℃冷藏保存[15-16]。
1.2.2 酶转化生成F2的最佳反应条件
对底物质量分数、反应温度、乙醇体积分数、反应时间[17]等酶反应条件进行研究。以PPD皂苷为底物,分别配制1 mL质量分数1%~6%的PPD,pH 5.0,温度30~60 ℃,乙醇体积分数0~40%,与等体积粗酶液混合,分别在0.5~3 h时取样,反应结束后用2倍体积的水饱和正丁醇和1倍体积水萃取反应产物,用TLC法[18]检测反应结果,根据酶反应生成F2的量确定最适条件。
1.2.3 乙醇体系中Fe3+对人参皂苷F2的催化反应条件
采用FeCl3作为催化反应中的金属离子,以F2皂苷为底物,分别配制1 mL质量分数0.50%~2.25%的人参皂苷F2,温度30~60 ℃,每隔5 ℃检测一次,乙醇体积分数0~100%,与等体积的氯化铁溶液混合,Fe3+浓度0.1~3 mol/L,分别在2~24 h时取样,反应结束后用2倍体积的水饱和正丁醇和1倍体积的水萃取反应产物。用TLC进行检测,观察点板效果,根据催化反应Rh2生成量来确定最佳反应条件。
1.2.4 酶转化反应产物和Fe3+催化反应产物的HPLC检测
将催化反应产物进行HPLC检测。色谱柱:中汇达C18色谱柱(4.6 mm×250 mm,5 μm);柱温35 ℃;进样量10 μL;体积流量1.0 mL/min;载气压力30 psi;漂移管温度80 ℃;以乙腈(A)-水(B)溶液梯度洗脱:0~20 min,20% A等度;20~31 min,20%~32% A线性梯度;31~40 min,32%~43% A线性梯度;40~70 min;43%~100% A线性梯度[19]。
对照品的制备:称取人参皂苷F2、20(S)-Rh2、20(R)-Rh2、Rh3和Rk 5 mg溶于10 mL色谱甲醇中,配成2 mg/mL的对照品溶液,分别取1 mL加入色谱甲醇稀释成质量浓度2.0、1.6、1.2、0.8、0.4 mg/mL的对照品溶液,放置于4 ℃冰箱备用。精密吸取对照溶液10 μL,按色谱条件测定分析,绘制标准曲线,用最小二乘法进行线性回归,得到各个成分的回归方程[20],结果见表1。
1.2.5 催化反应产物质量分数的计算
参照表1分别计算样品中含有的F2、20(S)-Rh2、20(R)-Rh2、Rk2和Rh3的质量。

表1 人参皂苷F2和Rh2组成的线性回归方程Tab.1 The regression equations of ginsenoside F2 and Rh2 components
w1=m′1/m1×100%
w2=(m′2+m″2)/m2w3=(m′3+m″3)/m2
式中,w1为F2的质量分数,%;m′1为F2的质量,mg;m1为酶反应后干燥样品的质量,mg;w2为20(S,R)-Rh2的质量分数,%;m2为金属离子反应后干燥样品的质量,mg;m′2为20(S)-Rh2的质量,mg;m″2为20(R)-Rh2的质量,mg;w3为Rk2和Rh3的质量分数,%;m′3为Rh3的质量,mg;m″3为Rk2的质量,mg。
2 结果与讨论
2.1 酶转化法制备F2的催化反应条件优化
采用“1.2.2”的方法检测在不同底物质量分数、乙醇体积分数、温度和酶反应时间下F2的转化率,结果如图1所示。从图1(a)可以看出,随着温度的升高,F2转化率先增大再减少,在40 ℃时,转化率达到最大;从图1(b)可以看出,随着底物质量分数的增大,F2的转化率先增大再减少,当底物质量分数为2.5%时,转化率达到最大;从图1(c)可以看出,乙醇体积分数为10%时,转化率达到最大;从图1(d)可以看出,随着时间的延长,F2的转化率先增大再减少,在反应时间1.5 h时,转化率达到最大。确定最佳反应条件为乙醇体积分数10%,底物质量分数2.5%,反应温度40 ℃,反应时间为1.5 h。
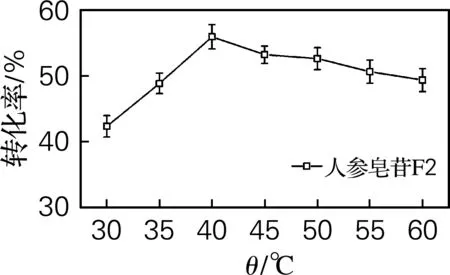
(a) 反应温度
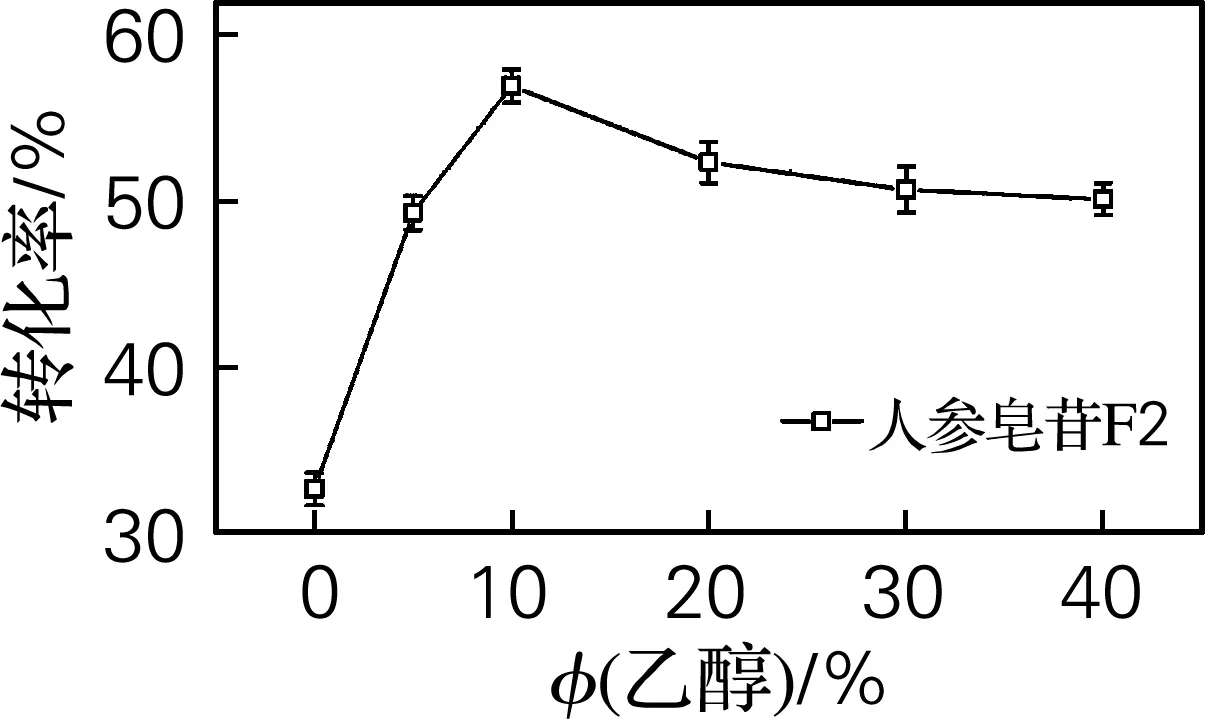
(c) 乙醇体积分数

(d) 反应时间图1 酶反应条件的优化Fig.1 Optimization of enzyme reaction conditions
2.2 Fe3+催化反应条件的优化
实验室前期研究发现,在乙醇-水体系中人参皂苷的反应效果较好。采用“1.2.3”的方法对Fe3+催化反应条件进行优化,结果如图2所示。从图2(a)可以看出,随着乙醇体积分数的增加,20(S,R)-Rh2转化率先增大再缓慢减少,当乙醇体积分数为50%时,20(S,R)-Rh2转化率最大;从图2(b)可以看出,随着Fe3+浓度的增加,20(S,R)-Rh2 转化率先增大再缓慢减小,当FeCl3浓度为0.8 mol/L时,20(S,R)-Rh2转化率最大;从图2(c)可以看出,温度越升高,底物降解的越彻底,温度为50 ℃时,20(S,R)-Rh2转化率最大;从图2(d)可以看出,F2底物质量分数为1.3%时,20(S,R)-Rh2转化率最大;从图2(e)可以看出,随时间的延长,20(S,R)-Rh2转化率先增大再缓慢降低,反应时间为17 h时,20(S,R)-Rh2转化率最大。确定最佳反应条件为乙醇体积分数50%,Fe3+溶液反应浓度0.8 mol/L,反应温度50 ℃,底物质量分数1.3%,反应时间17 h。
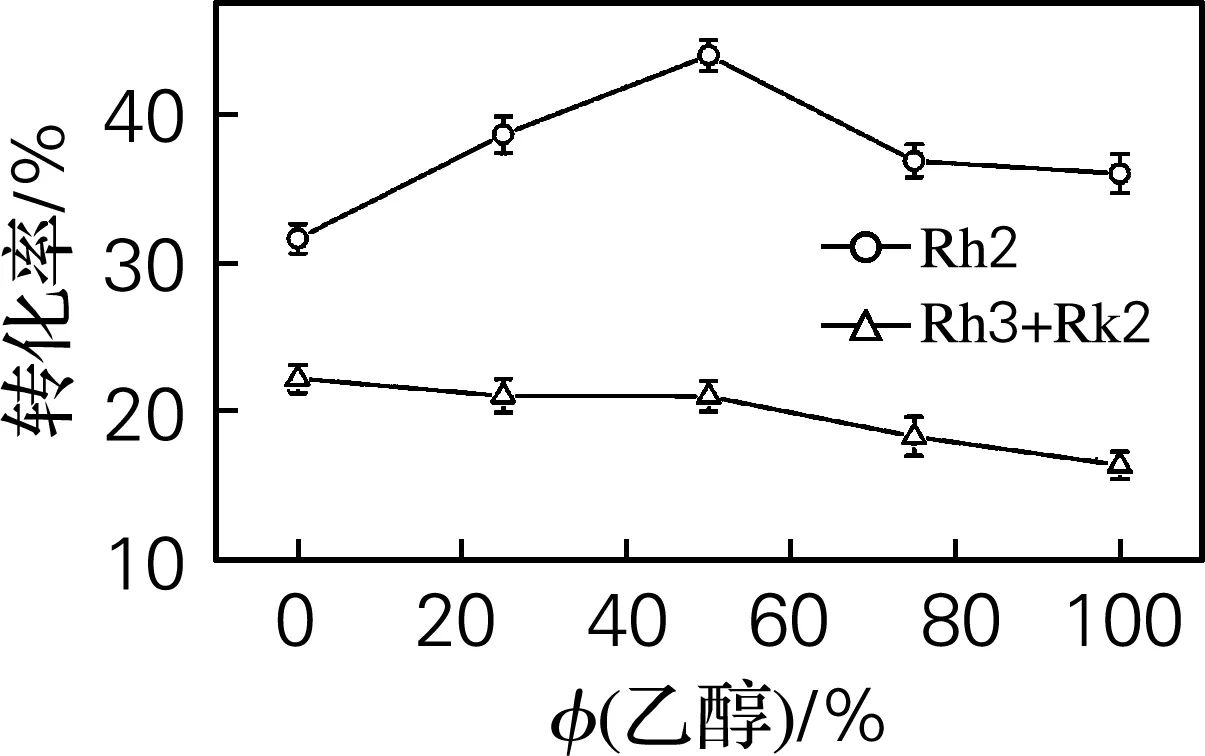
(a) 乙醇体积分数

(b) Fe3+浓度

(c) 反应温度

(d) 底物质量分数

(e) 反应时间图2 乙醇-水体系中反应条件的优化Fig.2 Optimization of reaction conditions in ethanol-water system
2.3 酶转化法和金属离子催化法联用制备人参皂苷Rh2
以PPD为底物,在最佳反应条件下,称取PPD 20 g与相同体积的粗酶液混合,在40 ℃的反应釜中反应1.5 h后,向反应溶液中加入反应溶液3倍体积95%的乙醇,终止反应,离心取上清液干燥。干燥样品溶解于1 000 mL去离子水中,吸附于800 mL AB-8树脂柱,反复上样至皂苷完全吸附,用5倍柱体积的水洗脱,除去糖等可溶性杂质。再用58%乙醇洗脱柱子,收集洗脱的醇溶液。将醇溶液在阴离子交换树脂D280上洗脱,进行脱色处理,并将溶液浓缩干燥,得到含有F2的产物13.96 g,转化率为69.8%。
采取乙醇-水作溶剂体系,配制13 g质量分数1.3%的酶液转化F2粗品溶液,与500 mL等体积的1.6 mol/L氯化铁溶液混合,于50 ℃反应17 h后加入水饱和正丁醇萃取,水洗正丁醇层3遍,除去Fe3+后进行旋转蒸发,干燥后得到催化反应产物粗品9.41 g,得率72.4%。
HPLC测定结果如图3所示。酶转化PPD混合皂苷的反应中生成主要产物为F2(图3(b)),经计算质量分数为58.2%,经纯化后得到的单品纯度高达90%(图3(c))。在Fe3+催化人参皂苷F2的产物粗品中有4种产物(图3(d)),分别为20(S,R)-Rh2、Rk2和Rh3,主要产物是20(S,R)-Rh2,计算得质量分数为43.8%,Rk2和Rh3的质量分数为19.2%。本实验从PPD皂苷经酶转化得到F2,再用Fe3+催化转化得到Rh2,最终得率为50.7%。

(a) 底物PPD
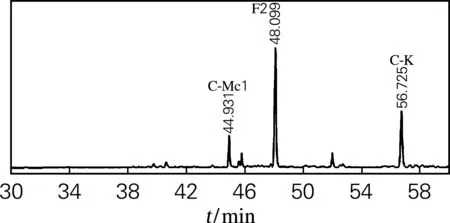
(b) F2粗品
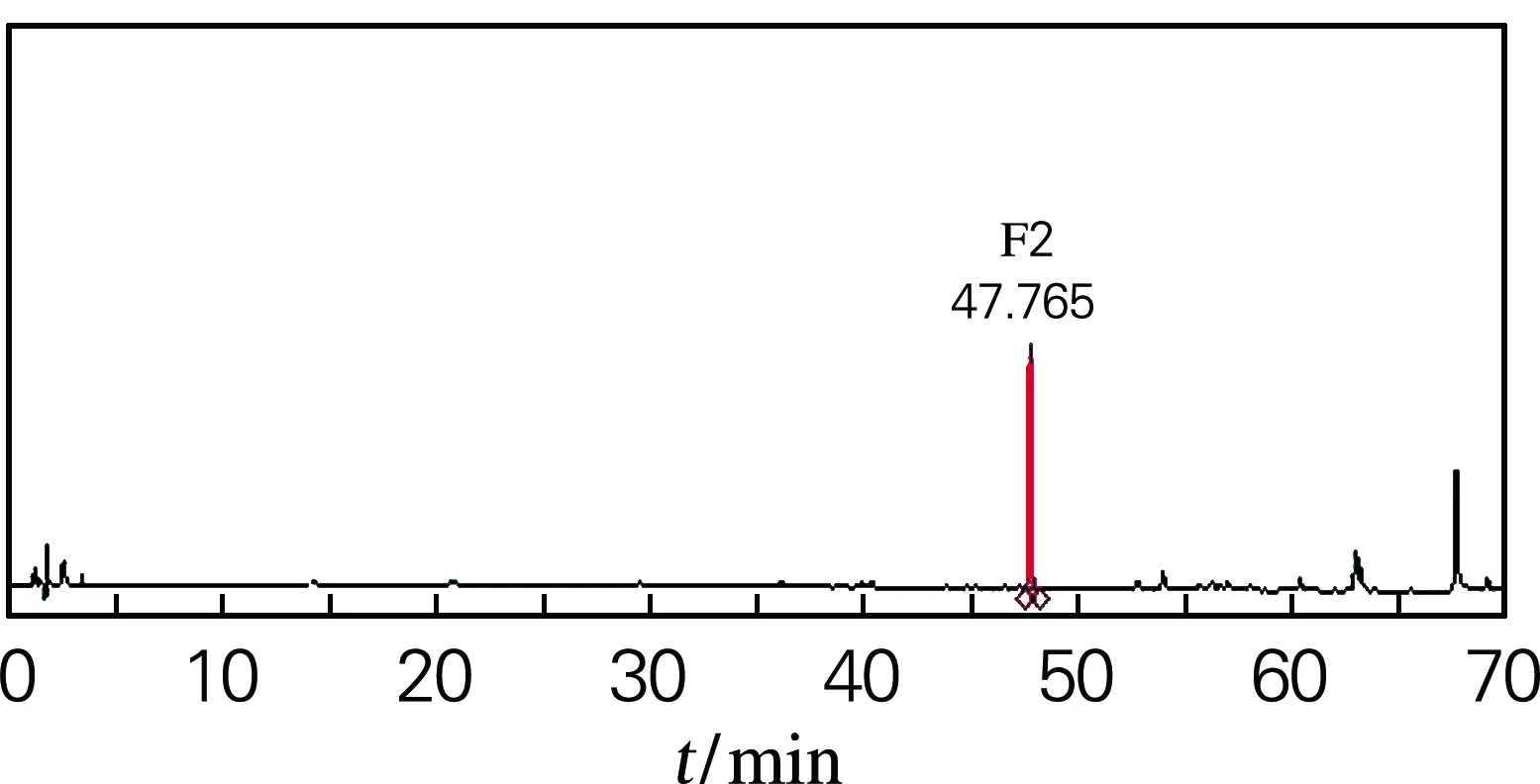
(c) 纯化产物
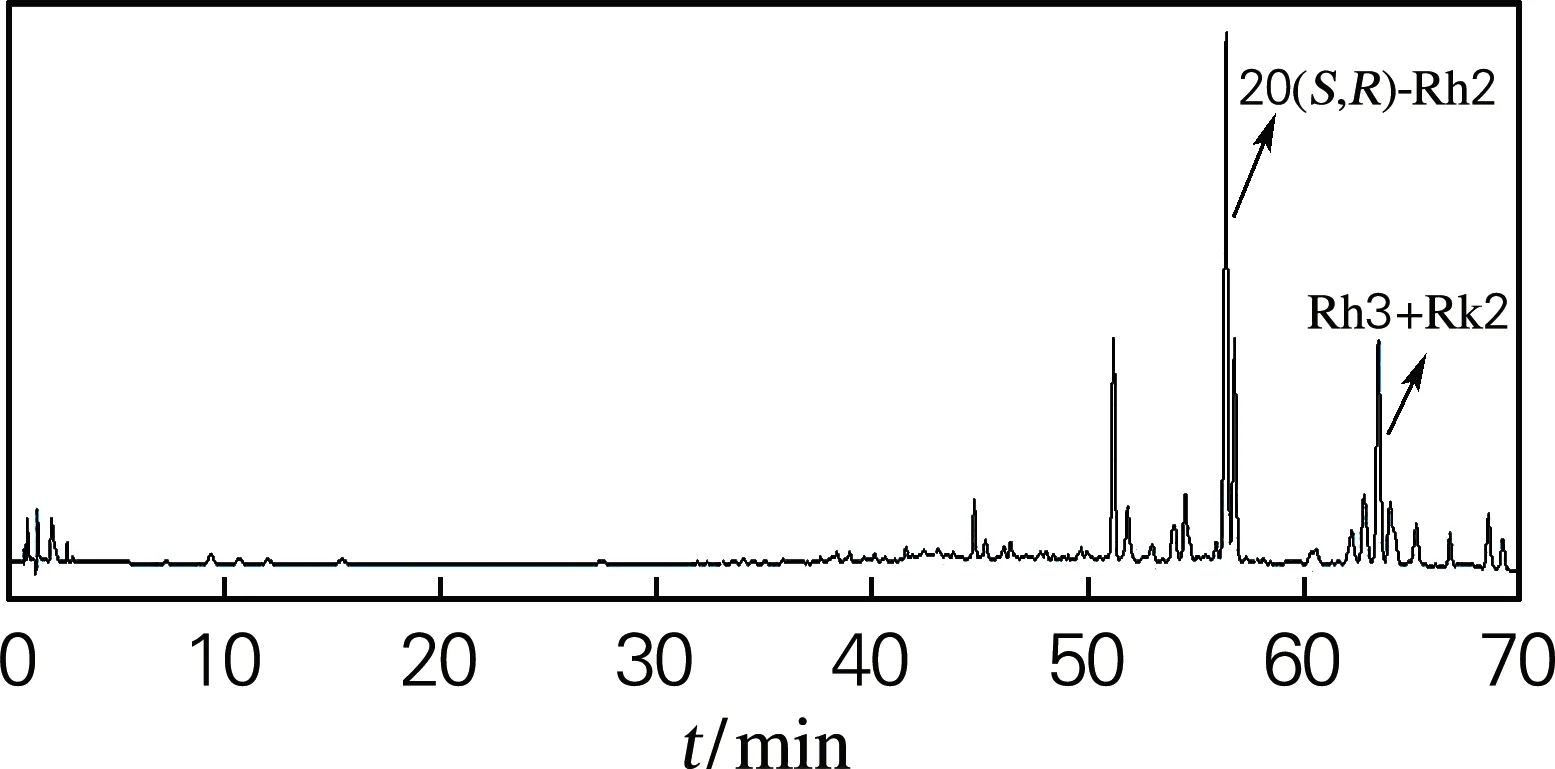
(d) Fe3+催化产物图3 反应底物和产物的HPLC图Fig.3 HPLC results of reaction substrates and products
3 结 论
通过优化PPD混合人参皂苷的酶反应条件和Fe3+催化反应条件,得到最佳酶反应条件为乙醇体积分数10%,底物质量分数2.5%,反应温度40 ℃,反应时间1.5 h,生成的F2转化率最高。Fe3+催化的最佳反应条件为乙醇体积分数50%,Fe3+浓度0.8 mol/L,反应温度50 ℃,反应时间17 h,人参皂苷F2转化率最高。在此条件下,20 g PPD最终转化成9.41 g Rh2,得率为50.6%。其中20(S,R)-Rh2质量分数为43.8%。
采用酶转化法和金属离子催化法联用制备人参皂苷Rh2系列异构体,这两种方法具有反应特异性强、条件温和(常温常压)、底物转化彻底、产物得率高、无污染等优点,用低成本的PPD有效制备了高活性稀有皂苷20(S,R)-Rh2,更易于工业化放大生产,为稀有人参皂苷的催化制备提供了新的方法。
