红枫湖水库水体溶解硅的垂直分布特征初步研究*
2020-10-20刘斌赵君代颖徐露
刘 斌 赵 君 代 颖 徐 露
(1. 遵义师范学院资源与环境学院,贵州 遵义 563006; 2. 遵义师范学院环境生物技术与水污染控制研究所,贵州 遵义 563006)
0 引 言
硅(Si)是地球上重要的矿质元素,在地壳中丰度仅次于氧.在自然水域中,硅通常以溶解态单体正硅酸盐形式存在[1],即溶解硅.硅在水生生态系统中占有重要地位,是水生植物(尤其是硅藻等)生长所必需的营养元素.硅藻吸收溶解硅,经过体内同化作用转化为硅质细胞壁,硅藻死后硅质细胞壁逐渐溶解,一部分重新进入水体,未溶解的部分则进入沉积物中形成生物硅[2].有研究表明,溶解硅与生物硅之间通过硅藻等浮游植物相互转换,一定程度上能指示水体营养盐变化情况,记录富营养化和表层水体的生产力变化过程[3].当前我国水污染问题比较突出[4-5],而红枫湖水库作为重要的饮用水源地,其水质状况一直备受关注[6-7].目前对红枫湖水库水体溶解硅的研究相对缺乏,本文通过对该水库水体溶解硅质量浓度进行测定,初步探讨水体溶解硅的垂直分布特征及其原因.
1 材料与方法
1.1 研究区域概况
红枫湖水库位于贵州高原中部乌江一级支流猫跳河上游(106°19′~106°28′E,26°26′~26°35′N),为猫跳河梯级水库的第一级水库.红枫湖水库于1960年建成并投入使用,主要由北湖、南湖和后湖组成,水流方向由南至北.红枫湖水库北湖的入湖河流为桃花园河和麦包河,南湖入湖河流为麻线河和羊昌河,后湖入湖河流为后六河(也叫马场河),水库水体最终经由大坝泄入猫跳河,汇入乌江.水库南北长约16 km,东西宽约4 km,平均深度约为20 m,最大水深达45 m,总库容为6.01×108m3,正常水位的海拔为1 240 m[8],酸碱度平均值为pH 7.85.
红枫湖水库流域属于亚热带季风湿润气候带,年均气温14.0℃,7月平均气温为22.7℃,1月平均气温为3.8℃;降雨相对集中,其中5—8月占全年降雨量的55%以上[9].
红枫湖水库除了作为重要的饮用水源地外,兼具发电、灌溉、养殖、防洪、旅游以及调节自然生态等综合功能[10].随着城镇化迅速发展,红枫湖水库周边大量工业废水、生活污水等排入湖中,导致水体质量恶化,严重影响了当地居民的饮用水质量,甚至威胁到身体健康[11].
1.2 样品采集及实验方法
2017年11月,采集红枫湖水库不同深度10个点位的水柱样品.其中,北湖湖区(HFN)采集了4个点位,分别是:HFN-1位于北湖湖心,采样深18.0 m; HFN-2位于桃花园河河口,采样深17.0 m; HFN-4位于麦包河河口,采样深13.0 m; HFN-5位于坝前,采样深33.0 m.南湖湖区(HFS)采集了6个点位,分别是:HFS-1位于南湖后五处,为南湖向北湖的过渡区域,采样深17.0 m;HFS-2位于南湖湖心,采样深18.0 m;HFS-3位于南湖三岔河处,采样深11.0 m;HFS-4位于南湖两岔河处,采样深13.0 m;HFS-5位于麻线河河口,水深较浅,采样深7.0 m;YCR-1位于红枫湖水库西南角的入湖河流羊昌河河口,采样深3.0 m.各采样点具体点位见图1.
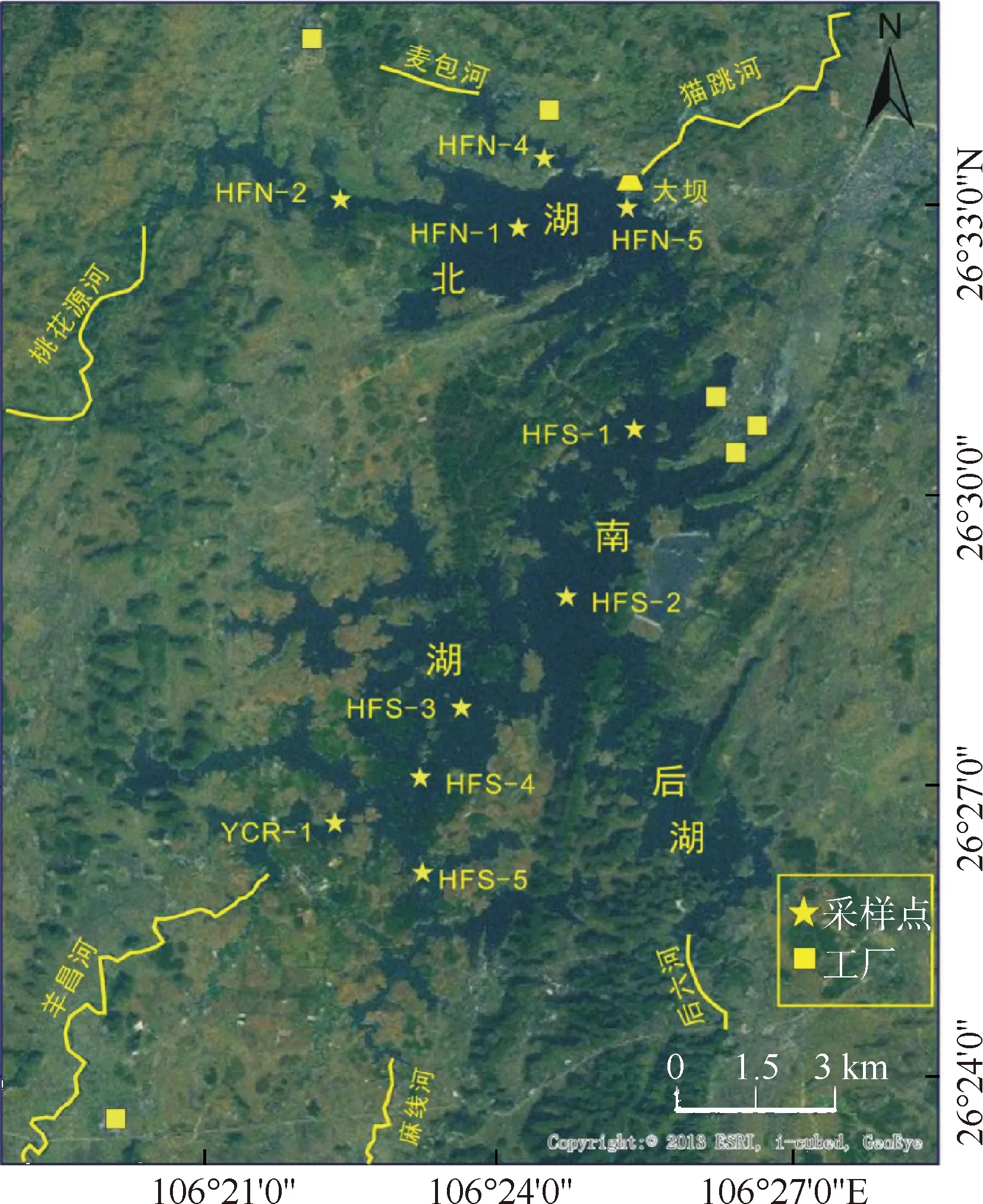
图1 红枫湖水库水样采样点分布
溶解硅的测定通常采用硅钼蓝比色法,其原理是在一定的酸性条件下,硅酸与钼酸铵反应生成硅钼黄.因硅钼黄不够稳定,且灵敏度不高,因此通常采用抗坏血酸将其还原成硅钼蓝[12].主要步骤为:取过滤后的水样5 mL于100 mL 容量瓶中,加入过量1 mol/L盐酸溶液,用超纯水稀释至50 mL摇匀;加入5 mL 50 g/L钼酸铵溶液,摇匀后静置30 min;加入10 mL 2 g/L抗坏血酸,摇匀放至冷却,加超纯水稀释至刻度线,摇匀后静置2 h;以空白试剂作为参比,在紫外-可见分光光度计波长680 nm处测定吸光度.
2 结果与分析
各采样点溶解硅随深度变化情况如图2所示.HFN-1采样点水体溶解硅的最大值为0.783 μg/mL出现在表层0.5 m处,最小值为0.731 μg/mL出现在底层12.0 m处,平均值为0.752 μg/mL,水柱各层水体溶解硅质量浓度基本一致,未出现明显变化;HFN-2采样点水体溶解硅最大值为1.189 μg/mL出现在表层0.5 m处,最小值为0.710 μg/mL出现在深度4.0 m处,平均值为0.881 μg/mL,中下层水体溶解硅质量浓度相对一致,表层水体溶解硅质量浓度明显高于中下层;HFN-4采样点水体溶解硅最大值为0.950 μg/mL出现在最底部12.0 m处,最小值为 0.679 μg/mL出现在表层0.5 m处,平均值为0.770 μg/mL,水柱中上层水体溶解硅质量浓度变化较小,最底部溶解硅质量浓度明显高于中上层;HFN-5采样点水体溶解硅最大值为0.877 μg/mL出现在最底部30.0 m处,最小值为0.783 μg/mL出现在8.0 m 处,平均值为0.830 μg/mL,溶解硅质量浓度在垂直方向上变化很小.北湖4个点位水柱溶解硅质量浓度平均值为0.811 μg/mL,垂向变化特征为北湖湖区的2个点位——HFN-1和HFN-5垂向变化较小,各层相对均匀,而2个河口处点位水柱溶解硅质量浓度呈现出相反的变化特征,HFN-2表层显著高于中下层,HFN-4最底层溶解硅质量浓度显著高于中上层.
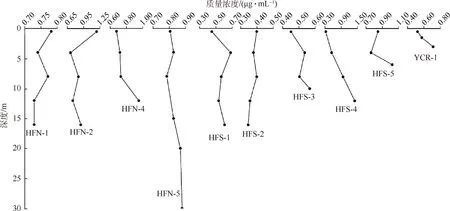
图2 各采样点水体中溶解硅质量浓度
HFS-1采样点水体溶解硅的最大值为0.679 μg/mL出现在深度4.0 m处,最小值为0.450 μg/mL出现在深度0.5 m处,平均值为0.567 μg/mL,溶解硅质量浓度在0~8.0 m变化较大,而在8.0~16.0 m未发生明显变化;HFS-2采样点水体溶解硅的最大值为0.398 μg/mL出现在深度0.5 m和8.0 m处,最小值0.346 μg/mL出现在深度16.0 m处,平均值为0.375 μg/mL,溶解硅质量浓度与深度成线性关系,大体呈现出从表层至底层逐渐降低的趋势;HFS-3采样点溶解硅的最大值为0.565 μg/mL出现在深度10.0 m处,最小值为0.450 μg/mL出现在深度0.5 m处,平均值为0.513 μg/mL,垂直方向波动不大;HFS-4采样点水体溶解硅的最大值为1.397 μg/mL出现在深度12.0 m处,最小值为0.336 μg/mL 出现在表层0.5 m 处,平均值为0.814 μg/mL,溶解硅质量浓度随深度增加而逐渐升高;HFS-5采样点水体溶解硅的最大值为1.022 μg/mL出现在深度6.0 m处,最小值0.762 μg/mL出现在深度4.0 m处,平均值为0.877 μg/mL,这一采样点不同深度溶解硅质量浓度整体比较高;YCR-1采样点水深0.5、1.5和3.0 m 处水样的溶解硅分别为0.523、0.575和0.710 μg/mL.这一采样点溶解硅质量浓度随深度增加呈现逐渐升高的趋势.
红枫湖水库所有采样点的水体溶解硅质量浓度变化范围是0.180~1.397 μg/mL,平均值是0.665 μg/mL.北湖溶解硅质量浓度平均值相对较高,南湖和羊昌河则相对较低.三者由高到低依次为:北湖(0.808 μg/mL)>南湖(0.629 μg/mL)>羊昌河(0.603 μg/mL).
3 讨 论
红枫湖水库各点位水柱溶解硅质量浓度呈现出较为复杂的垂向变化特征,其原因有以下几点:
(1)与硅溶解时间和迁移沉积有关.硅藻生物作用对水体溶解硅有调节作用,在水库水体流速相对缓慢、滞留时间延长的地方,比如水库库湾和水流方向下游处,硅藻易大量生长繁殖,从而加大水体中溶解硅的消耗量,硅藻死后沉入水体底部,最终将水体溶解硅迁移沉积到底泥中.由于硅质壳溶解很慢,导致可溶性硅酸盐难以重新回到水体,上覆水体溶解硅质量浓度下降[13].另外,南湖湖心、后五处和北湖湖心水柱溶解硅质量浓度明显较低,可能与水体相对稳定、水流较缓,硅藻等浮游植物易生长,上覆水体迁移沉积到底泥中的硅质量浓度高密切相关.
(2)与水体污染有关.随着水体污染物不断累积,表层藻类生长受到影响,水库底层沉积物中污染物蓄积量增加,溶解硅也受到影响[14].北湖坝前采样点离市区最近,不同深度溶解硅质量浓度平均值也最高,这是由于此处汇集了来自城市的生活污水和工业废水,受污染相对较严重.
(3)与降雨有关.红枫湖水库水源之一是大气降水.降雨将红枫湖水库流域的农业面源污染物、湖区居民生活废水及生活垃圾等冲刷进湖,对湖泊底层沉积物有一定影响[15].其次,雨季降雨量增大导致入湖河流流量增大,溶解硅质量浓度也会随之变化,对其垂直分布会产生一定影响.
(4)与采样点的环境位置有关.红枫湖水库北湖的溶解硅平均值显著高于南湖,这是由于溶解硅跟着流水方向迁移沉积,由南向北逐渐递增.
4 结 论
本文通过分析红枫湖水库不同深度的10个点位水体溶解硅质量浓度变化,讨论了红枫湖水库水体溶解硅的垂直分布特征.红枫湖水库各采样点水体溶解硅质量浓度相对高值出现在河口和坝前积累区;而相对低值出现在水流方向下游处和水库过渡区.溶解硅质量浓度在垂直分布上大体呈现出表层水体质量浓度相对较低,底层水体相对较高的特征.这种分布特征可能与硅藻等浮游生物数量差异对溶解硅的调节作用有关,还与特殊的地理位置有关,如河口和坝前积累区水体溶解硅质量浓度较高,而过渡区和水流方向下游区水体溶解硅质量浓度相对较低;红枫湖水库水体营养状态与溶解硅存在一定的关联,溶解硅可能是湖泊污染程度的潜在代用指标.
本研究的不足之处在于只对1个季节进行了采样,而湖泊水体溶解硅的质量浓度变化随季节变化较大,并不能代表整年的溶解硅质量浓度变化,对分析带来一定的影响,需要做进一步深入研究.
