石墨烯对蚕豆生长发育的效应研究*
2020-10-20刘泽慧陈志文赵建国王海雁邢宝岩乔玉英阮明礼杨晓峰
刘泽慧 陈志文 赵建国** 古 玲 乔 俊 王海雁 邢宝岩 乔玉英 阮明礼 杨晓峰
(1. 山西大同大学炭材料研究所,山西 大同 037009; 2. 山西大同大学化学与环境工程学院,山西 大同 037009)
0 引 言
纳米材料已被广泛应用于电子、机械、能源和生物医学等领域[1-4].在植物生长中,纳米材料可被植物吸收和运输到植物组织与器官,提高种子萌发率和促进植物生长[5-6].纳米材料主要包括金属、金属氧化物、聚合物和碳纳米材料等,其中碳纳米材料因为其独特的化学性质与结构且具有低毒性,受到研究者的广泛关注[6].
石墨烯是碳纳米材料家族的一员,其比表面积大且基面和边缘上有多种含氧官能团,能够吸附肥料并缓慢释放肥效[7].石墨烯碳(C)原子之间有大量的疏水性sp2团簇,而碳氧键(C—O)间存在大量的亲水性sp3团簇,sp3 C—O键可以将水分子聚集在其表面,而sp2团簇会进一步排斥水分子使其向植物根系或种子迁移,从而促进种子萌发[8].有研究表明石墨烯作为抗菌剂可以延长鲜切花的寿命[9].
姚建忠等[10]的研究显示适宜质量浓度的石墨烯溶液能够促进欧洲山杨(PopulustremulaL.)组培苗植株的不定根伸长、主根形成及不定根数量的增加;郭绪虎等[11]证实4.00和8.00 mg/L的石墨烯溶液可以促进MS培养基上生长的藜麦(ChenopodiumquinoaWilld.)根系的生长和发育,且增加了藜麦幼苗的生物量;胡晓飞等[12]表明2.00 mg/L的石墨烯溶液可以促进树莓(RubuscorchorifoliusL.f.)组培苗的苗高增加1.46倍,根长、比表面积、根尖数与分叉数的发育增加2倍;薛斌龙等[13]也证实 2.00 mg/L 的石墨烯溶液可以有效缓减树莓组培苗所遭受的氯化钠(NaCl)胁迫,增强了树莓的抗盐性;Wang等[14]研究显示石墨烯可以抑制小麦赤霉病菌的生长,并从转录组、蛋白质组和代谢组水平揭示了其抑菌的分子机制,表明了石墨烯在植物保护中的作用.
蚕豆(ViciafabaL.)在我国种植面积广泛,其营养价值高[15],目前石墨烯对蚕豆作物的影响尚未有研究报道.本研究利用不同质量浓度的石墨烯溶液处理蚕豆幼苗,测量石墨烯处理后的蚕豆幼苗各项生长发育与生理指标,以期完善石墨烯对蚕豆幼苗生长发育影响的数据.
1 实验部分
1.1 实验试剂
分析纯浓硫酸(H2SO4)和纯蒽酮(C14H10O)购自北京生工生物科技有限公司;葡萄糖(C6H12O6)购自上海阿拉丁生化科技股份有限公司;活性炭购自天津北辰方正试剂厂;氮标、氮1号试剂、氮2号试剂、1号粉、钾标、钾1号试剂、钾2号试剂、磷标、磷1号试剂、磷2号试剂和3号试剂均购自浙江托普云农科技股份有限公司.实验所用水均为蒸馏水.
1.2 实验仪器
使用上海博迅实业有限公司生产的GZX-9076MBE数显鼓风干燥箱烘干葡萄糖、植物与土壤样品;使用德国艾本德股份公司生产的Centrifuge 5424低温冷冻离心机完成实验离心工作;使用美国PP Systems公司生产的CIRAS-3便携式光合作用仪测定蚕豆叶片的净光合速率;使用日本Epson公司生产的Epson Perfection V850 Pro根系扫描仪扫描根系形态;使用浙江托普云农科技股份有限公司生产的TPY-8A型土壤养分速测仪测量土壤肥力.
1.3 石墨烯制备
采用电化学方法制备石墨烯[16].将2个石墨电极放入充有一定气体的密闭空间中,并在两端加足够的电压,使空间内气体发生电离而导电,产生电弧放电现象,该过程中,阳极石墨电极消耗,在密封壁上形成石墨烯层.且在石墨烯表面引入亲水基团羧基(—COOH)和羟基(—OH),使其可以稳定溶解于水中.得到质量浓度为5.00 g/L的石墨烯酸性溶液.石墨烯溶液质量浓度的计算方法:将50 mL石墨烯溶液于80℃烘干,称取石墨烯固体质量,平行测量5组取平均值.
1.4 样品前处理
以种植于山西大同大学炭材料研究所院内试验地的蚕豆为研究对象.按照完全随机分组的方法将210颗大小一致的蚕豆种子分为7组,每组10颗,每组重复3次,分别标记为空白组(1组)和实验组(6组),所有蚕豆均培养在土壤中.
取一定体积的石墨烯溶液(5.00 g/L)分别稀释300、250、200、150、100和50倍,对应的质量浓度分别为16.67、20.00、25.00、33.33、50.00和100.00 mg/L.实验组,将6个不同质量浓度石墨烯溶液分别浇灌于对应实验组的蚕豆幼苗根部,分4次浇灌,从播种开始每隔1周浇灌1次,每次浇灌1 L,浇灌时间18∶00;空白组,浇灌溶液为等体积的蒸馏水,其余处理与实验组一致.蚕豆种子种植时间为2019年7月18日.
1.5 蚕豆幼苗叶片净光合速率测定
以蚕豆幼苗叶片净光合速率代表光合作用强度,用单位时间单位面积吸收的二氧化碳(CO2)物质的量表示,单位为μmol/(m2·s).培养7周后,每组实验取9株幼苗的18个叶片,测量叶片的净光合速率.
1.6 蚕豆幼苗株高测定
以地面到顶端生长点的距离来定义株高.培养7周后,测量7组共210株蚕豆幼苗的株高.
1.7 蚕豆幼苗表型及根系形态分析
利用根系扫描仪分析蚕豆幼苗的根系形态,采用WinRHIZO 4.0b软件分析根系总长度、总表面积和体积.培养8周后,将不同组蚕豆幼苗从土壤中挖出,用自来水轻轻冲洗干净,分别与空白组对比拍摄蚕豆幼苗表型;剪取蚕豆根系,用自来水轻轻冲洗蚕豆根系,尽量保持根系完整性,进行根系形态分析.
1.8 蚕豆幼苗叶片总糖含量的测定与分析
利用C14H10O—H2SO4比色法测定蚕豆幼苗叶片总糖质量浓度.
(1)C14H10O—H2SO4溶液配置.将760 mL浓H2SO4边搅拌边缓慢加入蒸馏水中,室温下体积定容至1 L,得到H2SO4溶液储存备用.将1 g的C14H10O溶解于1 L H2SO4溶液中,置于棕色瓶中,使用当日配置.
(2)标准曲线绘制.称取5 mg干燥葡萄糖(80 ℃烘干2 h)溶于50 mL蒸馏水中,得到100.00 μg/L标准葡萄糖溶液.在7只试管中分别加入0、100、200、400、600、800和1 000 μL的标准葡萄糖溶液,再分别加蒸馏水定容至1 mL后,分别加入5 mL的 C14H10O—H2SO4溶液,放至沸水浴中加热10 min,迅速冷却至室温,于620 nm波长处测量反应液的吸光度,以质量浓度为0的标准葡萄糖溶液试管进行调零.
(3)总糖含量测量.取新鲜叶片在烘箱中110℃烘干15 min后,70℃过夜干燥.称取50 mg干叶片研磨,加入2 mL 80%(体积比)乙醇,摇匀,离心力为1 503g,4 000 rpm/min 离心10 min后,取上清液,再加上述乙醇同样条件下离心后取上清液,重复3次,收集所有上清液;在上清液中加入10 mg活性炭80℃脱色,定容至10 mL静置沉淀备用.取1 mL 上清液加入5 mL 的C14H10O—H2SO4溶液中,放至沸水浴中加热10 min,迅速冷却至室温,测量溶液吸光度.
1.9 蚕豆根系周围土壤肥力分析
为了揭示石墨烯处理后蚕豆幼苗根系指标存在差异的原因,利用土壤养分速测仪测定蚕豆幼苗根系周围的土壤肥力,即土壤中铵态氮(N)、有效钾(K)和速效磷(P)的含量.除去蚕豆根系周围浮土,以5点取样法取根系周围土壤,将土样充分混合后晾干24 h,经1 mm筛子过筛后,分别进行样品测量.
(1)铵态氮测量.①空白检测:取2 mL蒸馏水进行空白检测.②标准样品检测:在900 μL的蒸馏水中加入100 μL氮标,摇匀得到20.00 mg/kg的标准溶液,在标准溶液中分别加入100 μL氮1号试剂摇匀,再加入100 μL氮2号试剂摇匀,静置10 min后加入800 μL蒸馏水,取2 mL标准样品进行测量.③实际样品检测:称取4 g处理后土壤样品放于塑料瓶中,分别加入20 mL蒸馏水,1 g 1号粉,密封后手动震荡10 min,过滤,在滤液中分别加入100 μL氮1号试剂摇匀,再加入100 μL氮2号试剂摇匀,静置10 min 后加入800 μL蒸馏水,取2 mL实际样品进行测量.
(2)有效钾测量.①空白检测:取2 mL蒸馏水进行空白检测.②标准样品检测:在900 μL的蒸馏水中加入100 μL钾标,摇匀得到100.00 mg/kg的标准溶液.在标准溶液中加入100 μL钾1号试剂摇匀,再加入100 μL钾2号试剂摇匀,静置5 min后加入800 μL蒸馏水,取2 mL标准样品进行测量.③实际样品检测:称取4 g处理后土壤样品放于塑料瓶中,分别加入20 mL蒸馏水,1 g 1号粉,密封后手动震荡10 min,过滤,在1 000 μL滤液中分别加入100 μL 钾1号试剂摇匀,再加入100 μL钾2号试剂摇匀,静置5 min后加入800 μL蒸馏水,取2 mL 实际样品进行测量.
(3)速效磷测量.①空白检测:取2 mL蒸馏水进行空白检测.②标准样品检测:在900 μL的蒸馏水中加入100 μL磷标,摇匀得到20.00 mg/kg的标准溶液,在标准溶液中分别加入100 μL磷1号试剂和800 μL蒸馏水摇匀,加50 μL磷2号试剂,取2 mL 标准样品进行测量.③实际样品检测:称取4 g处理后土壤样品放于塑料瓶中,分别加入20 mL蒸馏水,500 μL 3号试剂,密封后手动震荡10 min,过滤,向200 μL滤液和800 μL蒸馏水中分别加入100 μL磷1号试剂和800 μL蒸馏水摇匀,再加入50 μL磷2号试剂摇匀,无需静置,取2 mL实际样品进行测量.
1.10 数据分析
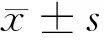
2 结 果
2.1 蚕豆生长发育的影响
不同质量浓度石墨烯溶液通过根部浇灌蚕豆及幼苗,待长到幼苗期后,取蚕豆植株拍照观察其表型(图1).石墨烯质量浓度在16.67~33.33 mg/L时,随着质量浓度的增加,溶液促进蚕豆幼苗的生长,即促进株高增加;当质量浓度在50.00~100.00 mg/L时,蚕豆植株生长较慢,即抑制株高增加.

图1 不同质量浓度石墨烯溶液培养的蚕豆幼苗形态
2.2 蚕豆植株株高、叶片光合作用和总糖含量
不同质量浓度石墨烯溶液处理后蚕豆幼苗生长发育指标详细结果列于表1.蚕豆幼苗地上部分株高为(50.83±4.82~58.12±3.10)cm,与空白组相比,25.00 mg/L实验组株高显著增加 (t=3.46,P<0.05),增加到1.1倍;20.00和33.33 mg/L实验组株高增加但差异无统计学意义(P>0.05);16.67、50.00 和100.00 mg/L实验组株高降低但差异无统计学意义(P>0.05).
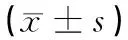
表1 不同质量浓度石墨烯溶液处理后蚕豆幼苗生长发育指标情况
空白组和实验组蚕豆幼苗叶片的净光合速率分别为(14.31±2.85)和(10.14±2.32~18.23±2.84)μmol/(m2·s).与空白组相比,25.00 mg/L实验组净光合速率显著提高(t=2.16,P<0.05),提高到1.3倍;16.67、20.00 和33.33 mg/L实验组净光合速率提高,但差异无统计学意义(P>0.05);50.00 mg/L实验组净光合速率下降,但差异无统计学意义(P>0.05);100.00 mg/L实验组净光合速率显著降低(t=-3.28,P<0.05),降低到0.7倍.
空白组和实验组蚕豆幼苗叶片的总糖质量浓度分别为(334.35±3.02)和(330.89±0.05~336.38±5.56)μg/L.与空白组相比,20.00、25.00、33.33和100.00 mg/L实验组总糖质量浓度提高,但差异无统计学意义(P>0.05);16.67和50.00 mg/L 实验组总含糖量下降,但差异无统计学意义(P>0.05).
综上所述,25.00 mg/L石墨烯溶液对蚕豆植株的株高和叶片光合作用提升作用最佳.
2.3 蚕豆根系形态的影响
不同质量浓度石墨烯溶液处理后蚕豆幼苗根系形态变化如图2所示.可知,石墨烯质量浓度在16.67~33.33 mg/L时,随着质量浓度的增加,溶液促进蚕豆幼苗根系的生长,即根系长度和根数增加;同时蚕豆幼苗根系结有根瘤的数量和体积也有所增加.当质量浓度在50.00~100.00 mg/L时,蚕豆幼苗根系的长度和数量及根瘤数量和体积均减少,即溶液抑制蚕豆幼苗根系的发育.
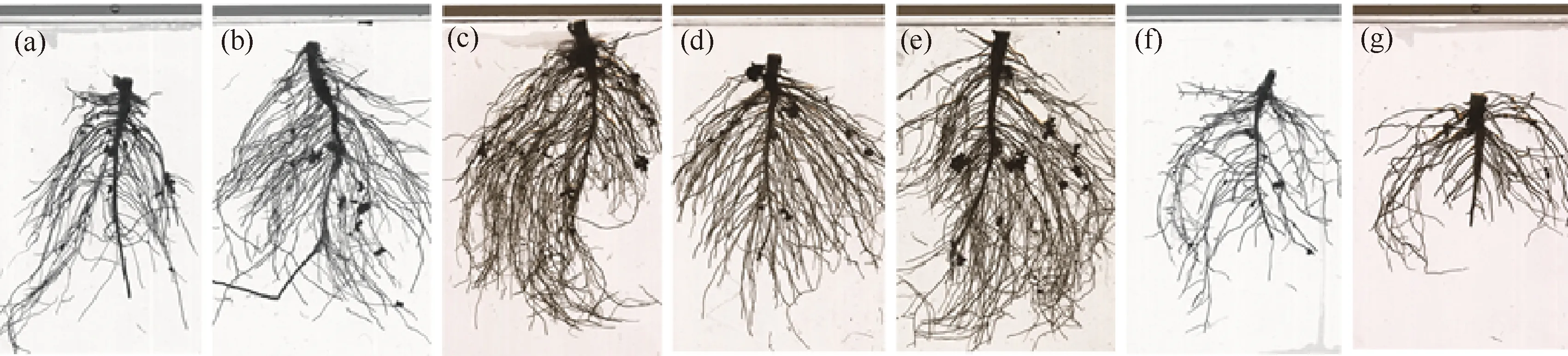
图2 不同质量浓度石墨烯溶液处理后蚕豆幼苗的根系形态
不同质量浓度石墨烯溶液处理后蚕豆幼苗的3个根系形态指标详细结果列于表2.空白组和实验组蚕豆幼苗根系的总长度分别为(223.51±23.70)和(199.33±21.08~321.17±11.20)cm.与空白组相比,20.00、25.00和33.33 mg/L实验组根系总长度增加(t=7.51、3.17和7.45,P<0.05),增加到1.3~1.4倍;16.67和50.00 mg/L实验组根系总长度增加但差异无统计学意义(P>0.05);100.00 mg/L实验组根系总长度显著降低(t=-2.52,P<0.05),降低到0.9倍.
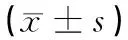
表2 不同质量浓度石墨烯溶液处理后蚕豆幼苗根系指标情况
空白组和实验组蚕豆幼苗根系总表面积分别为(21.52±1.30)和(18.68±2.07~22.37±0.31)cm2.与空白组相比,20.00和33.33 mg/L实验组根系总表面积增加,但差异无统计学意义(P>0.05);16.67、25.00和50.00 mg/L实验组根系总表面积降低,但差异无统计学意义(P>0.05);100.00 mg/L实验组根系总表面积显著降低(t=-2.85,P<0.05),降低到0.9倍.
空白组和实验组蚕豆幼苗根系的总体积分别为(4.47±0.45)和(3.04±0.60~6.08±1.35)cm3.与空白组相比,16.67、20.00、25.00和33.33 mg/L 实验组根系总体积显著增加(t=2.82、2.96、2.89和2.98,P<0.05),增加到1.1~1.4倍;50.00和100.00 mg/L实验组根系总体积显著降低(t=-3.31 和-2.78,P<0.05);均下降到0.7倍.
20.00、25.00和33.33 mg/L石墨烯溶液处理后均会促进蚕豆幼苗根系发育,综合可知20.00 mg/L实验组根系指标最佳.
2.4 土壤肥力分析
不同质量浓度石墨烯溶液处理后,蚕豆幼苗根系周围土壤的肥力详细结果列于表3.空白组和实验组蚕豆幼苗根系周围土壤的铵态氮质量分数分别为(5.14±0.62)和(5.24±0.40~8.71±0.25)mg/kg. 与空白组相比, 20.00和25.00 mg/L实验组根系周围土壤的铵态氮质量分数显著增加(t=22.10和4.87,P<0.05),增加到1.4~1.7倍;其他实验组根系周围土壤的铵态氮质量分数均增加,但差异无统计学意义(P>0.05).
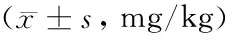
表3 不同质量浓度石墨烯溶液处理后蚕豆幼苗根系周围土壤的肥力
空白组和实验组蚕豆幼苗根系周围土壤的有效钾质量分数分别为(9.55±1.28)和(9.96±2.28~17.85±2.52)mg/kg.与空白组相比,20.00、25.00、50.00和100.00 mg/L实验组根系周围土壤的有效钾质量分数显著增加(t=5.09、3.92、4.44和3.36,P<0.05),增加到1.3~1.9倍;其他实验组根系周围土壤的有效钾质量分数也增加,但差异无统计学意义(P>0.05).
空白组和实验组蚕豆幼苗根系周围土壤的速效磷质量分数分别为(0.55±0.05)和(0.50±0.24~1.61±0.83)mg/kg.与空白组相比,16.67、20.00和100.00 mg/L实验组根系周围土壤的速效磷质量分数显著增加(t=2.81、2.80和2.78,P<0.05),增加到1.9~2.9倍;33.33和50.00 mg/L实验组根系周围土壤的速效磷质量分数增加,但差异无统计学意义(P>0.05);25.00 mg/L实验组根系周围土壤的速效磷质量分数下降但差异无统计学意义(P>0.05).
16.67~100.00 mg/L石墨烯溶液处理后蚕豆幼苗根系周围土壤肥力均会提升,而20.00 mg/L实验组根系周围土壤肥力提升最佳.
3 讨 论

在地下部分的生长指标数据中,25.00 mg/L石墨烯溶液可以促进蚕豆根系的生长发育,包括根系长度和总体积;同时20.00与25.00 mg/L石墨烯溶液均提升了根系周围土壤的肥力.有研究表明一定质量浓度的石墨烯溶液可以促进植物根系的发育,但是不同植物根系发育的最适浓度不同,比如树莓组培苗[12-13]、禾本科作物藜麦[11]和水稻[17]所需的最佳质量浓度分别为2.00、4.00和5.00 mg/L,表明植物根系响应石墨烯质量浓度存在特异性.乔俊等[18]和隋祺祺等[19]通过土柱淋溶实验证实石墨烯对土壤中的总氮、总磷和总钾有明显的持留效果,提高了0.6~1.8倍.这些研究证实了石墨烯溶液施入土壤后,对土壤中的养分有明显的持留效果,可以提升土壤的肥力,进而促进植物根系的生长发育.
本研究结果也表明了100.00 mg/L石墨烯溶液会抑制蚕豆植株地上部分和根系的生长发育.Begum等[20]报道过在Hoagland培养基中,1 000.00 mg/L 的石墨烯溶液会导致番茄、红菠菜和卷心菜的根部大量积累活性氧(ROS),并最终抑制这些植物的生长.Liu等[17]报道100.00 mg/L石墨烯溶液会抑制水稻根系和地上部分的生长发育,并减少植株生物量.这些结果均表明了高质量浓度石墨烯溶液具有抑制植物生长发育的效应.
4 结束语
本研究利用不同质量浓度的石墨烯溶液处理蚕豆幼苗根系,证明石墨烯能够影响蚕豆的生长发育.实验证明25.00 mg/L石墨烯溶液对蚕豆地上和地下部分均具有促进生长发育作用,可增加蚕豆幼苗株高、净光合速率、总根长和根体积,同时促进土壤铵态氮和有效钾肥的积累等.而石墨烯溶液对蚕豆开花、结果直至死亡的影响是本研究后续的研究方向,同时现有研究缺少石墨烯影响植物生长发育的分子机制分析[21-23],因此,未来可以结合多组学数据和分子生物学手段,解析石墨烯与植物互作的作用机制.
