尼罗罗非鱼TNF−R1和TNF−R2基因克隆及表达*
2020-10-20叶航宇葛岩岩吴金英詹绪良
叶航宇,葛岩岩,吴金英,詹绪良
(中山大学生命科学学院/水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室/广东省重要经济鱼类健康养殖工程技术研究中心,广东广州510275)
TNF−α 属于肿瘤坏死因子(tumor necrosis fac⁃tor, TNF)超家族,是一种具有促进其它免疫因子产生、促进细胞吞噬作用及趋化作用、提高活性氧的产生的细胞因子[1],在机体免疫系统中起重要的调节作用[2]。TNF−α 与两种不同的跨膜结构受体结合——TNF−R1、TNF−R2,向下传递信号。哺乳动物中,TNF−R1 存在于多种细胞的表面,无论是膜结合型的还是游离型的TNF−α 都可以与TNF−R1 结合[3],TNF−R1 受体胞内含有死亡结构域,同TNF−α 结合后可以激活细胞的凋亡途径也可以激活细胞的抗凋亡途径[4]。在高等脊椎动物中,仅能在内皮细胞和一些免疫组织的细胞表面发现TNF−R2,认为TNF−R2 主要在淋巴系统中发挥作用[2,5−6]。TNF−R2仅能与膜结合型的配体结合,胞内无死亡结构域,能够同下游TRAF 蛋白连接,激活NF−κB,JNK,EPK 等途径介导细胞分化和细胞存活[7]。在小鼠中敲除TNF−R1基因,会增加其对李斯特菌(Listeria monocytogenes)的易感性并导致快速死亡[8]。因此,可以推测TNF−R1/R2 在机体抵抗微生物感染、维持免疫系统稳态等活动中发挥重要作用。
TNF−α 其受体TNF−R1/R2 在鱼类先天免疫系统中同样具有重要的生物学功能,至今已在金鱼(Carassius aurutusL)[9]、牙鲆(Paralichthys oliva⁃ceus)[10]、虹 鳟(Oncorhynchus mykiss)[11]、草 鱼(Ctenopharyngodon idellus)[12]和尼罗罗非鱼(Oreo⁃chromis niloticus)[13]等中克隆得到TNF−α基因。对鱼类TNF−R1 和TNF−R2 受体的报道,最早是在牙鲆 中[14],LPS(500 μg/mL) 刺 激 牙 鲆 外 周 血 后TNF−R1表达量明显上升;ConA(50 μg/mL)和PMA(0.35 μg/mL)刺激后TNF−R2表达量同样出现显著性升高[15]。在金鱼中也获得两种TNF−R1和TNF−R2基因,并且证明这两种受体都能与金鱼TNFα−1、TNFα−2 结合[16],但是,关于尼罗罗非鱼TNF−R1和TNF−R2基因与TNF−R 受体相关性的研究报道较少。
尼罗罗非鱼是我国优势出口水产品,具有生长快速、起捕率高、出肉率好等特点,但是,养殖中的疾病问题也日益严重,常见的养殖过程中罗非鱼病主要有细菌性疾病、真菌性疾病以及寄生虫性疾病,其中细菌性疾病包括链球菌病、气单胞菌病、肠炎病等[16]。近年来大面积的链球菌病暴发,导致尼罗罗非鱼养殖损失巨大,而导致罗非鱼链球菌病的病原菌主要是无乳链球菌[2]。
无乳链球菌(Streptococcus agalactiae)是革兰氏阳性菌,可引起新生儿败血症、脑膜炎,感染鱼类引发脑炎[17−18]。本研究以TNF−R1及TNF−R2基因入手,克隆了TNF−R1及TNF−R2基因全长cDNA 序列,并与其他物种进行同源性对比和系统发育进化树构建;研究了TNF−R1及TNF−R2在健康罗非鱼各组织中的表达分布,并对TNF−R1及TNF−R2基因表达量与脂多糖(LPS)、多聚肌苷酸−胞苷酸(Poly Ⅰ:C)和无乳链球菌相关性进行了初步分析,旨在探究TNF−α/TNF−R 系统在罗非鱼免疫调控网络中所起的作用,为进一步深入研究鱼类免疫机制提供理论依据和参考数据,并提高罗非鱼健康养殖水平提供理论参考。
1 材料和方法
1.1 实验用鱼和样品采集
实验用鱼为尼罗罗非鱼,购自广东广州番禺广东罗非鱼良种场,体质量400~500 g,实验前在0.4 m3的水族箱,28 ℃水温,12 h/12 h 光周期,24 h 充气和1 L/min 循环过滤水的条件下驯养1 周以上。选取健康尼罗罗非鱼进行实验。取样过程所使用的塑料容器均为无RNase处理,取样金属器械经180 ℃处理4 h 以上。取样时先用MS−222(Sigma,美国)麻醉实验鱼,分别提取3 尾健康罗非鱼的鳃、头肾、脾脏、肝脏、肾脏、胃、心脏、脑、垂体、肠、皮肤、精巢和肌肉组织,用液氮速冻保存,然后放于-80 ℃冰箱备用。
1.2 RNA提取与反转录
用常规Trizol(Invitrogen, 美国)抽提法从尼罗罗非鱼脾脏中提取总RNA,具体步骤按照Trizol Reagent 说明书进行。按照反转录试剂盒ReverTra Ace(TaKaRa,日本)的操作说明将得到的总RNA反转录合成cDNA,产物保存于−20 ℃备用。
1.3 TNF−R1与TNF−R2 cDNA的克隆和测序
根据NCBI 上已发表的鱼类:牙鲆、金鱼和斑马鱼(Danio rerio)的相关cDNA 保守序列设计兼并引物(表1)。以尼罗罗非鱼脾脏RNA 反转录产物为模板进行PCR 扩增。根据得到的TNF−R1与TNF−R2cDNA中间片段设计特异性引物(表1)进行5ʹ−RACE 和3ʹ−RACE 反应。PCR 产物经w=1.5%琼脂糖凝胶电泳分离,经E.Z.N.A®Gel Extraction(Omega BioTek)回收目的片段,将回收产物连接到pTZ57R/T (Fermentas, China)载体并转化大肠杆菌DH 5α,测序由广州Invitrogen 生物技术有限公司完成。每个样品设3个重复。
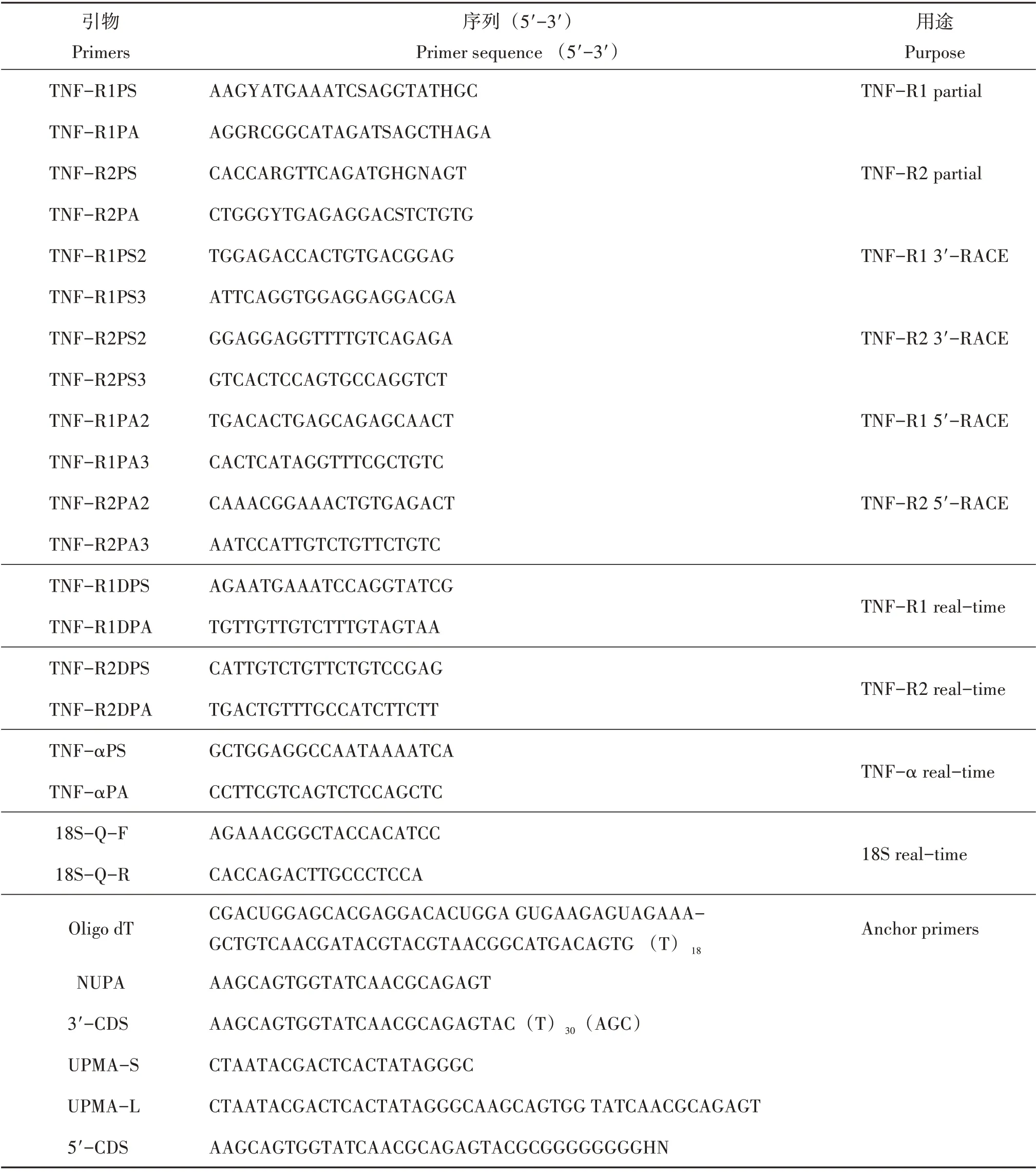
表1 用于罗非鱼TNF−R1和TNF−R2克隆以及定量检测所用引物Table 1 Primers for cloning of the tilapia TNF−R1&TNF−R2 and real−time quantitative PCR
1.4 生物信息学分析
核酸序列的同源性分析通过BLAST program(www.ncbi.nlm.nih. gov/BLAST)完成。信号肽序列以及剪切位点通过SignalP 3.0 (http://www.cbs. dtu. dk/services/SignalP)预测。跨膜结构域通过SACS MEMSAT2 跨膜结构预测系统(http://www. sacs. Ucsf. edu/cgi−bin/memsat. py)预测。同源结构域由Blastp 系统(http://blast. ncbi. nlm.nih. gov/Blast. cgi)预测。DNAMAN 进行多氨基酸序列的比对。MEGA6 用邻接法构建进化树,其中所使用到的氨基酸序列均是从GenBank 数据库中得到。
1.5 Realtime PCR 分析
Realtime PCR 分析所用仪器为Roche LightCy⁃cler 480 分析仪,染料为SYBR Green Ⅰ(Toyobo,Japan)。每个实验样品至少设3 个重复,分别提取健康罗非鱼的鳃、头肾、脾脏、肝脏、肾脏、胃、心脏、脑、垂体、肠、皮肤、精巢和肌肉的总RNA,根据TNF−R1与TNF−R2基因序列合成定量用特异性引物(表1),以18S rRNA 为内参基因,分析TNF−R1和TNF−R2mRNA的表达谱。
1.6 体外实验:细胞孵育和免疫刺激
通过Ficoll−Paque PLUS(GE)密度梯度离心获得罗非鱼脾脏和头肾白细胞,分别用浓度为10 μg/mL 的LPS 或50 μg/mL 的Poly Ⅰ:C 同白细胞孵育,阴性对照组添加等体积的PBS。所有细胞均在添加φ=10% FBS 的DMEM 组织培养基中27 ℃培养,设1、3 和6 h 3 个时间段,每个条件组均有3个以上重复。通过离心收集细胞,加入1 mL Trizol提取总RNA,最后通过Realtime PCR 检测不同实验组中的TNF−α、TNF−R1和TNF−R2的表达情况。
1.7 在体实验:感染攻毒实验
无乳链球菌从患病罗非鱼提取(由中山大学水生经济动物研究所李安兴教授惠赠),在脑心浸液琼脂培养基中培养,供攻毒实验使用。参考实验室前期研究已确定的半致死剂量进行预实验,具体实验操作为:5 个实验组,每组20 尾鱼,5 个攻毒剂量:1×106CFU,5×106CFU,1×107CFU,5×107CFU,1×108CFU。最终选择1×107CFU 作为半致死攻毒剂量。然后,将420尾尼罗罗非鱼[平均体质量(60±6) g,平均体长(13±0.5) cm]分为14 组,每组30 尾鱼。其中8 组为实验组,腹腔注射半致死攻毒剂量为1×107CFU/mL 的无乳链球菌菌液1 mL,其余6组为对照组,注射相同体积的没有无乳链球菌的培养基。腹腔注射6、12 h 和1、2、3、4、5、6、7、10、14 d 后,于各时间点取罗非鱼脾脏和头肾样品,实验组每组取1 尾鱼,共8尾,对照组每组也取1尾鱼,共6尾,通过Re⁃altime−PCR 检测TNF−α、TNF−R1和TNF−R2基因的表达变化情况。
1.8 统计分析
统计数值采用平均值±标准误差来表示,统计差异性用单因素方差分析(One−Way ANOVA 和Duncan’s检测),0.05和0.01水平用来指示差异的显著性,所有数据都采用SPSS Statistics 17.0分析。
2 结果与分析
2.1 尼罗罗非鱼TNF−R1和TNF−R2序列分析
通过RACE 技术克隆得到罗非鱼TNF−R1的cDNA 全 长 2 275 bp (GenBank) 注 册 号KM676072 ,5ʹUTR 长度为298 bp,3ʹUTR 长度为642 bp,开放阅读框长度为1 335 bp。预测前体蛋白由444个氨基酸组成,N 端含有一个由31个氨基酸组成的信号肽,其胞外区包含3个富含半胱氨酸结构域,跨膜结构域位于第213~236个氨基酸残基之间,其胞内区第303~438个氨基酸残基组成死亡结构域(图1)。利用Clustal−W 软件将罗非鱼TNF−R1 氨基酸序列与其他硬骨鱼类以及高等脊椎动物TNF−R1 氨基酸序列进行比对,包括:金鱼(Carassius aurutusL., ACR08664.1)、 斑 马 鱼(Danio rerio, NP_998355.1)、牙鲆(Paralichthys olivaceus, BAC65225.1)、非洲爪蟾(xenopus lae⁃vis, BAD36761.1)、小鼠(Mus musculus, NP_035739)、人(Homo sapiens, NP_001056),显示它们都含有3 个富含半胱氨酸结构域(CRD),每个CRD 含有6 个半胱氨酸,罗非鱼TNF−R1 与斑马鱼TNF−R1序列一致性最高,为32%。
TNF−R2cDNA 长1 719 bp(GenBank)注册号KM676073,GC比例为46%,5ʹUTR 长度为90 bp,3ʹUTR长度为153 bp,开放阅读框长度为1 476 bp。预测前体蛋白由491 个氨基酸组成,N 端含有1 个由21 个氨基酸组成的信号肽,其胞外区包含4 个富含半胱氨酸结构域,跨膜结构域由25 个氨基酸残基组成,其胞内不含死亡结构域(图2)。利用Clustal−W 软件将罗非鱼TNF−R2 氨基酸序列与其他硬骨鱼类以及高等脊椎动物TNF−R2氨基酸序列进行比对,包括:金鱼(Carassius aurutusL.,ACR08665.1) 、斑 马 鱼(Danio rerio, NP_001082979.1 )、牙 鲆 (Paralichthys olivaceus,BAC65226.1)、鸡(Gallusgallus, NP_989770.2)、小鼠(Mus musculus, NP_035740.2)、人(Homo sapiens, NP_001057.1) ,显示它们都含有4 个CRD 结构域;罗非鱼TNF−R2 与牙鲆TNF−R2 序列一致性最高,达49%。

图1 利用Clustal−W 软件分析尼罗罗非鱼与其他物种TNF−R1氨基酸序列比对情况Fig.1 Analysis of TNF−R1 amino acid sequence alignment between Nile tilapia and other species using Clustal−W software
利用Mega6 构建罗非鱼TNF−R1、TNF−R2的系统进化树,比较其与其他脊椎动物TNFR基因序列进化上的关系,各物种序列号如下:牙鲆TNF−R1(Paralichthys olivaceus, AB080946) 、金鱼TNF−R1(Carassius aurutusL FJ905476)、斑马鱼TNF−R1(Danio rerio,BC162652.1) 、非洲爪蟾TNF−R1(Xenopus laevis, BAD36761)、牛TNF−R1(Bos Taurus, O19131) , 猪TNF−R1(Sus scrofa, NP_999134) 、小鼠TNF−R1(Mus mus⁃culus, NP_035739) 、人TNF−R1(Homo sapi⁃ens, NP 001056) ;金鱼TNF−R2(Carassius au⁃rutusL FJ905477) 、斑马鱼TNF−R2(Danio re⁃rio,NP_001082979.1) 、牙鲆TNF−R2(Parali⁃chthys olivaceus,BAC65226.1)、鸡TNF−R2(Gal⁃lus gallus, NP_989770) 、牛TNF−R2(Bos Tau⁃rus, NP_001035580)、 猪TNF−R2(Sus scrofa,NP_001090910) 、小鼠TNF−R2(Mus musculus,NP_035740)、人TNF−R2(Homo sapiens, NP_001057) 。结果如图3,所有的TNF−R1 氨基酸序列聚集成一簇,包括硬骨鱼类、爬行类、哺乳类动物,而所有的TNF−R2氨基酸序列聚集成另外一簇。进一步分析表明罗非鱼TNF−R1 与牙鲆、金鱼、斑马鱼同源性相对较高,与非洲爪蟾及哺乳动物进化距离相对较远;罗非鱼TNF−R2与牙鲆同源性最高,其次为斑马鱼、金鱼,与鸡及其他高等哺乳动物同源性较低。
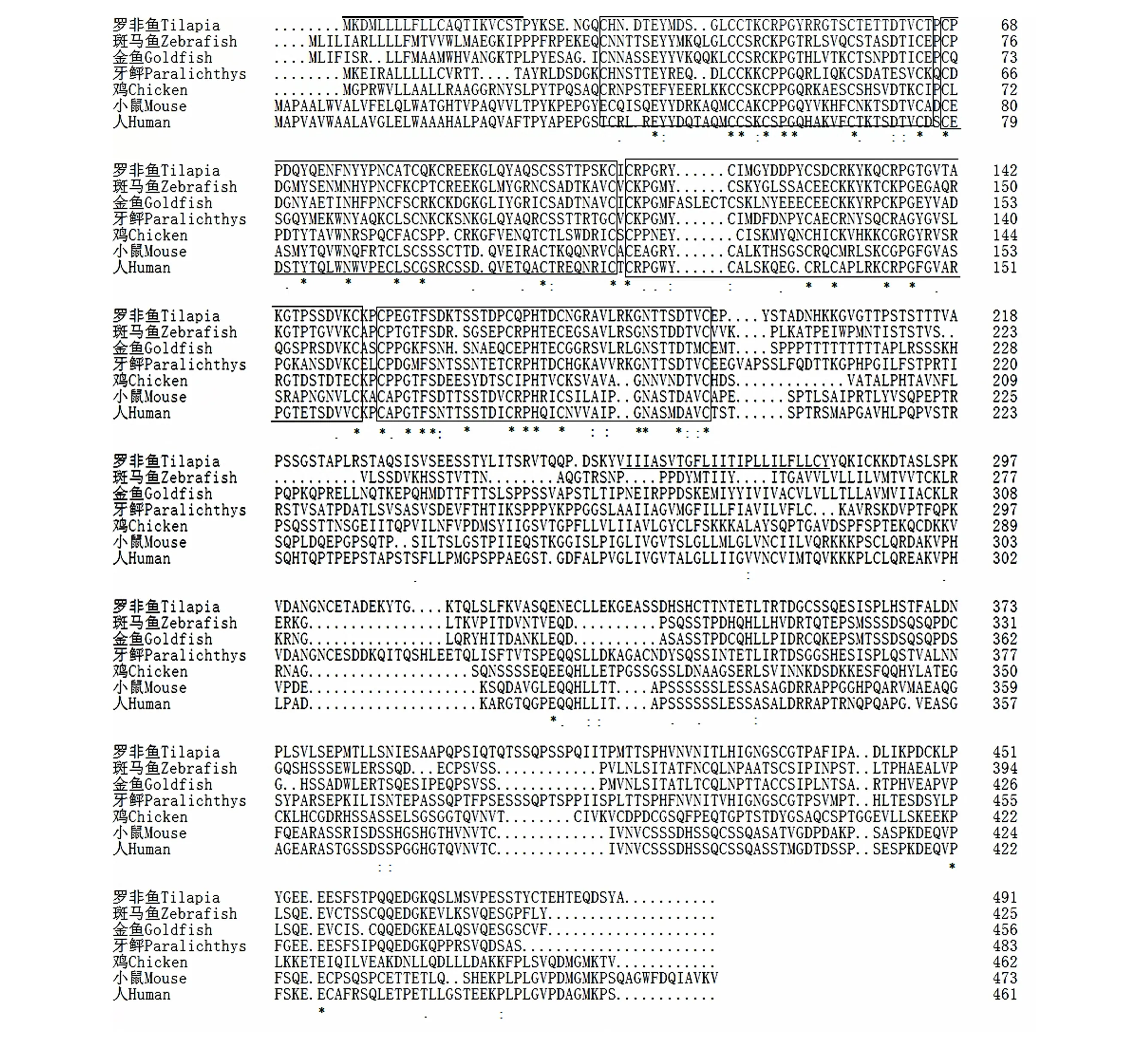
图2 利用Clustal−W 软件分析罗非鱼与其他物种TNF−R2氨基酸序列比对情况Fig.2 Analysis of TNF−R2 amino acid sequence alignment between tilapia and other species using Clustal−W software
2.2 尼罗罗非鱼TNF−R1 和TNF−R2 的组织表达分析
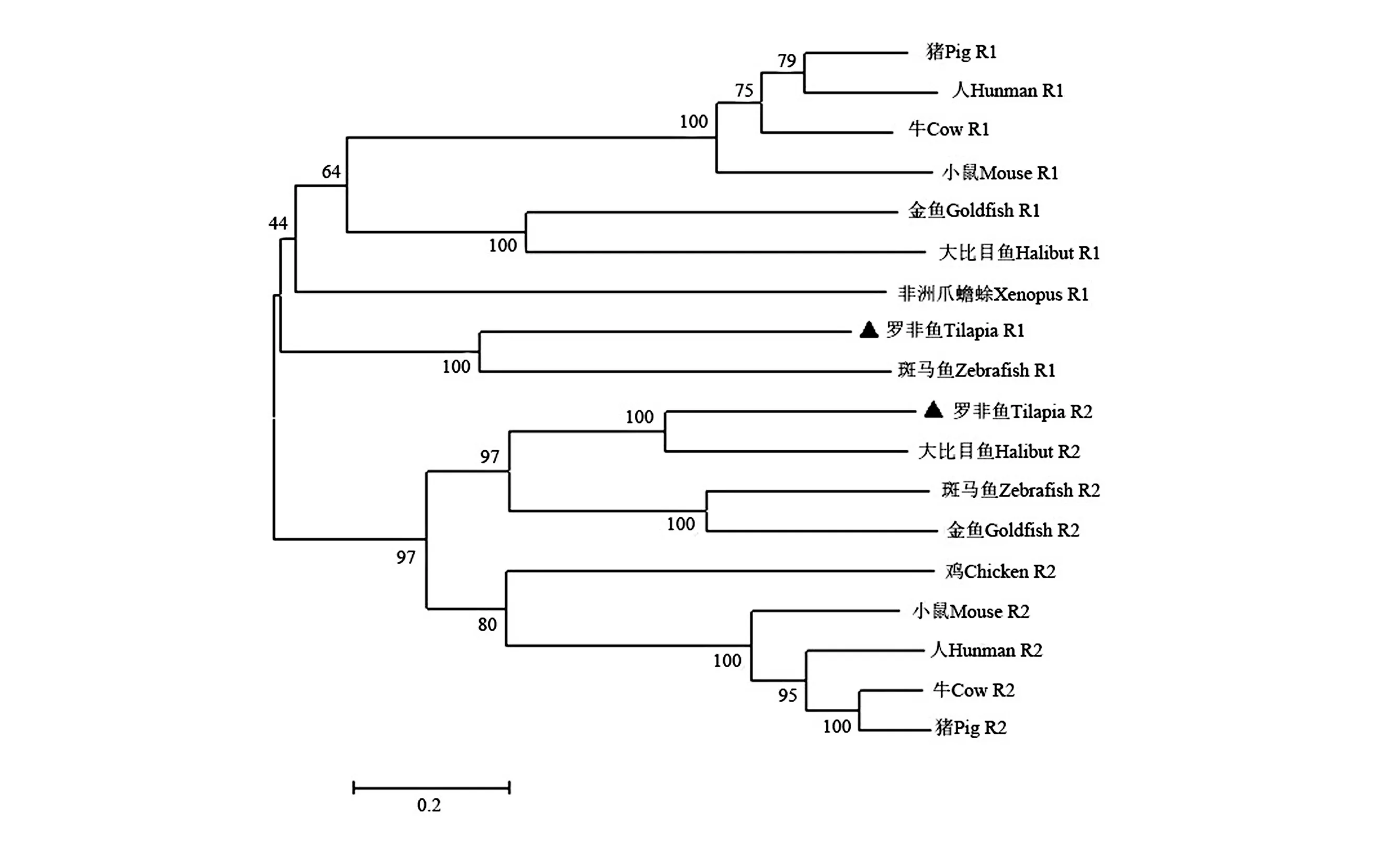
图3 基于尼罗罗非鱼TNF−R1 和TNF−R2氨基酸序列的系统发生分析Fig.3 Phylogenetic tree showing the relationship of tilapia TNF−R1 and TNF−R2 amino−acid sequence with other identified TNFR sequences
Real−time PCR 检 测 了 罗 非 鱼13 个 组 织 中TNF−R1(图4A)和TNF−R2(图4B)基因表达水平,TNF−R1在鳃中表达水平最高,其次是头肾、脾脏,然后是肝脏、肾脏、胃、精巢、大脑、心脏和肠,表达量最低的则是垂体、皮肤和肌肉。与其相似的是,TNF−R2表达量最高的也是在鳃中,然后是头肾、肝脏,接着是脾脏、心脏、肾脏、大脑、胃、皮肤、肠,最低的是垂体、肌肉和精巢,且这3个组织的表达水平非常的低。
2.3 尼罗罗非鱼TNF−α、TNF−R1 和TNF−R2 的体外刺激表达分析
使用质量浓度10 μg/mL LPS 和50 μg/mL PolyⅠ:C 分别刺激罗非鱼头肾白细胞和脾脏白细胞,在1 、3 和6 h 后 用 荧 光 定 量PCR 检 测TNF−α、TNF−R1和TNF−R2基因mRNA 水平的表达变化,结果如图5和图6所示。
罗非鱼的头肾白细胞体外刺激后,TNF−α表达量在LPS 刺激1 h 后和在3 h 时变化不明显,在6 h 时TNF−α表达量明显升高;对于Poly Ⅰ:C 刺激,TNF−α的表达量在刺激后1 h 即出现明显升高(图5A)。TNF−R1在LPS刺激1 h到3 h时表达量呈现下降趋势,但是在LPS 刺激6 h 时显著升高;对于Poly Ⅰ:C刺激,TNF−R1的表达量在刺激后1 h处上升,随后出现下降趋势,并逐渐接近同对照组表达量持平(图5B)。TNF−R2在LPS 刺激下的表达情况与TNF−R1相似,也呈现先下降后升高的趋势;对于Poly Ⅰ:C 刺激,TNF−R2在1 h 和3 h时表达量呈现下降趋势,而在6 h 时明显升高(图5C)。
在罗非鱼的脾脏白细胞体外刺激实验中,TNF−αmRNA的表达量在LPS刺激1 h后有所降低,在3 h 时出现上升,在6 h 时TNF−α表达量保持上升;对于Poly Ⅰ:C刺激,TNF−α的表达量在刺激后即出现明显升高(图6A)。TNF−R1的表达量在LPS 刺激后3 个时间点里呈现出逐渐升高的趋势,对于Poly Ⅰ:C 刺激,TNF−R1的表达量在3 h 内变化不大,而在6 h 时显著升高(图6B);TNF−R2在LPS 刺激下也呈现先升高后下降的趋势;对于Poly Ⅰ:C 刺激,TNF−R2的表达变化趋势与TNF−α相似,即先升高再下降(图6C)。
2.4 尼罗罗非鱼TNF−R1 和TNF−R2 的体内刺激表达分析
罗非鱼腹腔注射半致死剂量1x107CFU/mL 的无乳链球菌后,通过荧光定量PCR 的方法检测了TNF−α、TNF−R1和TNF−R2三个基因在头肾(图7)及脾脏(图8)中的表达水平变化。
从图7 中可以看出:在头肾中,TNF−α除了12 h 时间点外,在6 h~5 d 时间段内的表达量均上调,在6 d~10 d 时间段表达量下调至本底,但在14 d表达量上调。TNF−R16 h~4 d内都有表达量上调,在4 d 处达到最大值,5 d~10 d 时间段表达退至本底,至14 d 处又出现明显的上升;TNF−R2在攻毒6~4 d 时间段表达上调(2 d 上调不明显),在12 h处达到最大值,而在随后的时间段均下调至本底水平。
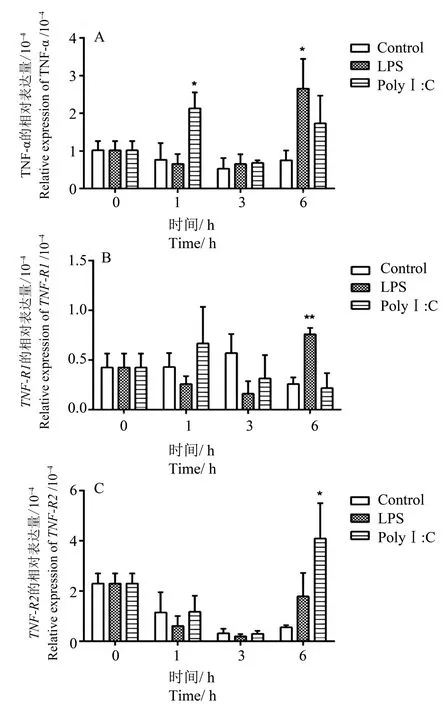
图5 LPS或Poly Ⅰ:C孵育刺激尼罗罗非鱼头肾淋巴白细胞后TNF−α(A)、TNF−R1(B)和TNF−R2(C)的表达检测Fig.5 Real−time PCR analysis expression profiles of tilapia TNF−α(A),TNF−R1(B)and TNF−R2(C)post stimula⁃tion of LPS or Poly Ⅰ:C in head kidney leukocytes
从图8中可以看到:在脾脏中,TNF−α在攻毒6~12 h 时间点即表达上调,随后1~6 d 时间段的表达量均较低,仅略高于本底水平,但在7~14 d 时间段有表达上调的趋势。TNF−R1在12 h~3 d 时间段表达上调,在2 d 处表达量最高,随后保持逐步下降趋势,14 d 处略微上升。TNF−R2在12 h~1 d时间段上调,在12 h 处达到最大值,随后下调。
3 讨 论
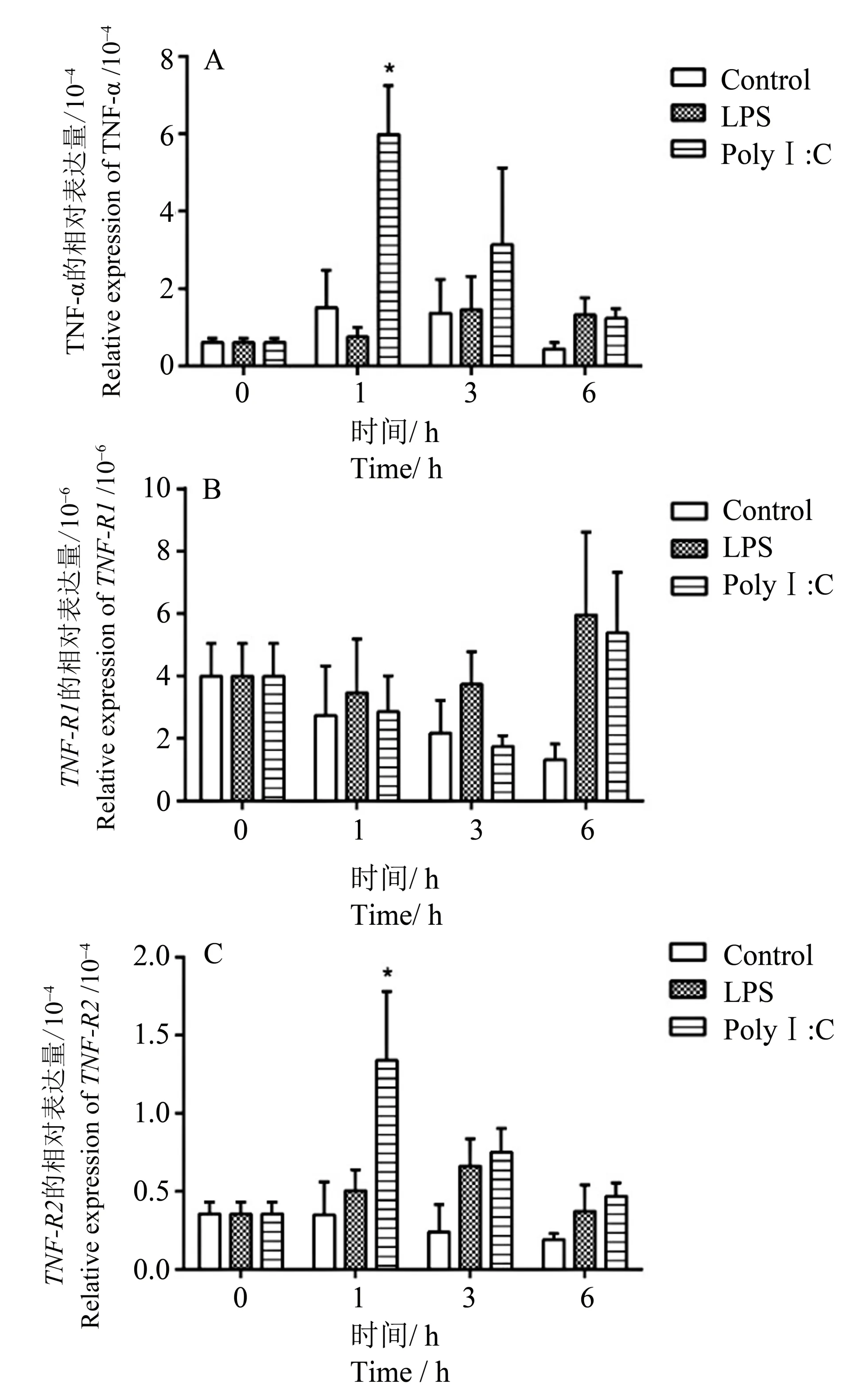
图6 LPS 或Poly Ⅰ:C孵育刺激尼罗罗非鱼脾脏淋巴白细胞后TNF−α(A)、TNF−R1(B)和TNF−R2(C)的表达检测Fig.6 Real−time PCR analysis expression profiles of tilapia TNF−α (A),TNF−R1(B)and TNF−R2(C)post stimu⁃lation of LPS or Poly Ⅰ:C in spleen leukocytes
本研究应用RACE 技术克隆得到了尼罗罗非鱼TNF−R1和TNF−R2的cDNA 全长序列,并进一步分析了它们的序列特征以及进化的地位。经蛋白质序列结构预测分析,尼罗罗非鱼TNF−R1 和TNF−R2 均属于Ⅰ型跨膜蛋白,TNF−R1 胞外区含有3个富含半胱氨酸结构域,TNF−α通过识别该区域来判定结合的可能性,其胞内区具有死亡结构域,这与其它已知脊椎动物的TNF−R1的结构非常相似,但是,哺乳动物如鼠[15]、人类[19]等中CRD数目为4 个,而尼罗罗非鱼TNF−R2 与哺乳动物TNF−R2 结构相似,胞外区含有4 个富含半胱氨酸结构域,但胞内无死亡结构域,该特征是划分TNF−R1和TNF−R2的重要依据。进化树分析显示,尼罗罗非鱼TNF−R1、TNF−R2 分别与脊椎动物TNF−R1、TNF−R2 氨基酸序列聚类,且两者分支明显,进一步证明了克隆的两种基因确为罗非鱼TNF−R1和TNF−R2。同时,TNF−R1 和TNF−R2 胞外区同源性高,但胞内区差别很大,暗示着它们具有与TNF−α 结合的能力,但胞内主要的信号传递途径会有所不同。而TNF−R1 和TNF−R2 信号通路存在交叉,即两者相互作用可介导凋亡或者存活信号[2],预测在罗非鱼体内TNF−R1 和TNF−R2具体的生物学功能复杂,可能受多种因素调控。
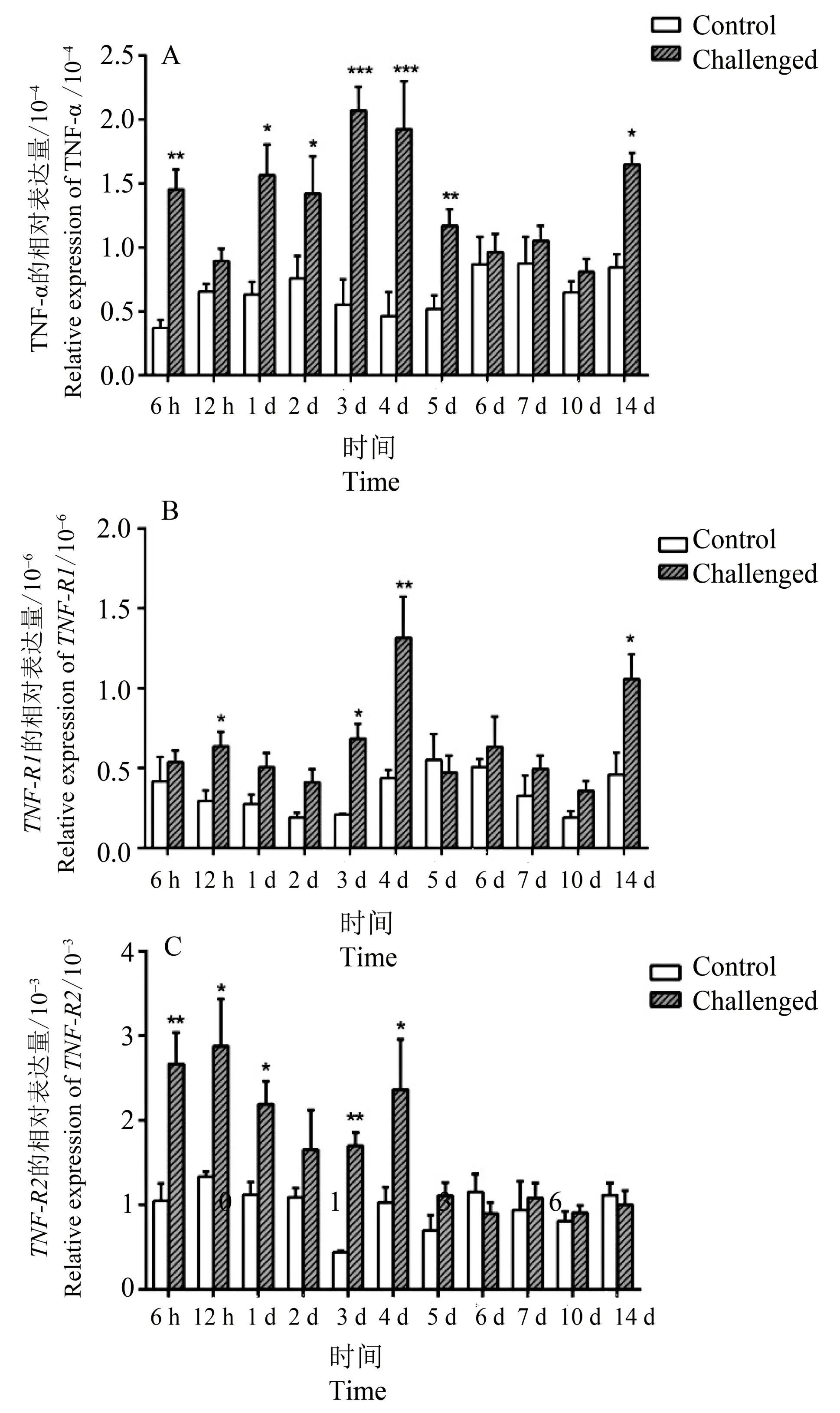
图7 无乳链球菌感染后TNF−α(A)、TNF−R1(B)和TNF−R2(C)在头肾中的表达Fig.7 Head kidney expression pattern of TNF−α(A),TNF−R1(B)and TNF−R2(C)following infection of S. agalactiae
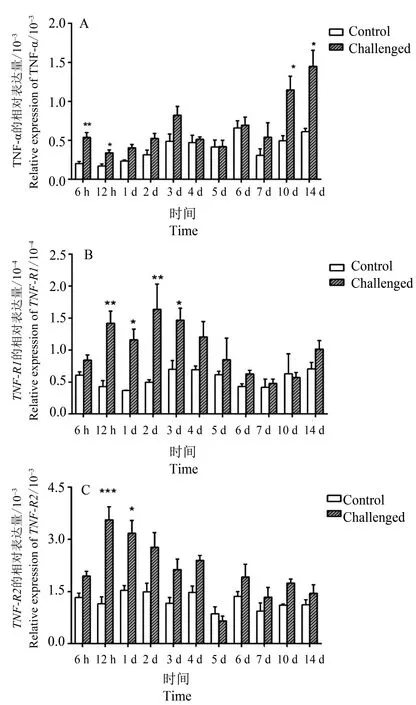
图8 无乳链球菌感染后TNF−α(A)、TNF−R1(B)和TNF−R2(C)在脾脏中的表达Fig.8 Spleen expression pattern of TNF−α(A),TNF−R1(B)and TNF−R2(C)following infection of S. agalactiae
根据本实验TNF−R1 和TNF−R2组织表达模式分析结果,TNF−R1和TNF−R2在鳃中表达量较高,而鳃是抵抗病原菌入侵的第一道防线,因此,这两种基因在鳃中的高表达可能与其免疫功能相适应,这与金鱼[16]、牙鲆[10]、黑岩鱼[20]和虾夷扇贝[21]中报道的结果相似;TNF−R1和TNF−R2在头肾和脾脏等二级淋巴免疫器官中同样具有高水平表达,预示着TNF−R1 和TNF−R2 在罗非鱼免疫系统中发挥重要作用。
已知TNF−R1和TNF−R2是肿瘤坏死因子TNF−α 的受体,TNF/TNFR 系统在脊椎动物的先天性免疫(非特异性免疫)和获得性免疫(特异性免疫)中发挥着非常重要的作用,可以参与抵抗多种病原微生物的感染[22−23]。在体外实验中,LPS刺激罗非鱼头肾白细胞后,在6 h 内TNF−α有显著的上调,这与虹鳟头肾巨噬细胞LPS 刺激后TNF−α显著上调结果相似[21],TNF−R1在LPS 刺激6 h 后表达量也有明显的上升,与牙鲆白细胞LPS 刺激后TNF−R1上调结果相似[10],不同的是牙鲆TNF−R1在刺激后1 h 即出现表达上调,而后趋于对照组水平,这印证了不同鱼类免疫器官间存在异质性及功能上的差别。另外Poly Ⅰ:C 刺激后,头肾白细胞 中TNF−α、TNF−R1表 达 量 在1 h 即 有 上 升,TNF−R2的表达量在6 h 才有上升;而Poly Ⅰ:C 刺激脾脏白细胞后TNF−α、TNF−R2表达量1 h 处即有上调,TNF−R1表达上调时间相对滞后,6 h 处才出现上升(图6)。以上体外实验结果表明:在脾脏白细胞与头肾白细胞中,同种基因表达上调时间和强度有区别,原因可能是不同免疫器官的白细胞组成成分差异较大,导致它们对同种刺激物反应有所差异。综上所述,两种刺激物刺激后不同组织中3 种基因表达的变化情况,可推知TNF−α与TNF−R1基因在应对LPS 模拟的细菌入侵刺激中起主要作用,而TNF−R2则在应对Poly Ⅰ:C 模拟的病毒入侵刺激中发挥重要作用,可以推测当外源细菌或病毒入侵时,这3种基因可能参与免疫应激反应的调节。
无乳链球菌感染在罗非鱼养殖过程中非常普遍,一些防治鱼类链球菌病的方法,例如抗生素、益生菌、疫苗等[4,24−26]也在陆续开发中,但直到现在仍未有非常有效的预防和治疗措施。为了进一步了解罗非鱼体内免疫应激调节特征,本实验进行了在体实验,即对罗非鱼进行无乳链球菌腹腔注射攻毒实验,检测了先天性免疫的生物学标志物TNF−α 及其受体TNF−R1、TNF−R2 的表达情况。在罗非鱼腹腔注射链球菌的前12 h 内,头肾及 脾 脏 组 织 中TNF−α、TNF−R1、TNF−R2的mRNA 表达量均有迅速上升(图7~8),这与体外实验中LPS 刺激头肾白细胞后,TNF−α、TNF−R1和TNF−R2的mRNA 表达水平上调趋势是相吻合的,Zhu 等[27]报道的海豚链球菌(Streptococcus ini⁃ae)攻毒后的罗非鱼转录组数据也显示出TNF−α和TNFR基因表达的明显上调。攻毒后7 d内3个基因的表达量均有先上升后下降的趋势,这可能与细胞避免过激的免疫炎症反应以及病原菌的暂时被抑制有关,同时病原菌的防御机制也可能抑制鱼体免疫因子的表达[28]。本实验第14 天时,实验组的TNF−αmRNA 的表达水平明显升高,死亡率出现上升(文中数据未体现),推测可能与体内病原菌再次繁殖引起鱼体的炎症反应有关。因此,我们预估罗非鱼感染链球菌病原菌后两周内进行辅助治疗效果更佳,尚需要后续更为系统的研究证实。综合本实验结果,表明TNF−R1 和TNF−R2可能参与了罗非鱼免疫应答过程,并初步揭示了它们在免疫调控系统中发挥着重要作用,对罗非鱼的健康养殖具有一定参考价值。
