基于网络药理学分析“黄芪—白术”治疗肺癌的作用机制*
2020-10-20刘梓燊杨国旺
刘梓燊,杨国旺
(1. 首都医科大学附属北京中医医院肿瘤科,北京100010;2. 首都医科大学,北京100069)
肺癌是全球恶性肿瘤中最常见的一种,也是主要的致死癌种。据世界卫生组织国际癌症研究中心(International Agency for Research on Cancer,IARC)在2018 年发布的GLOBOCAN 2018 文章中显示,2018 年全球肺癌新发病例占恶性肿瘤新发病例的11.6%,死亡数目占18.4%[1]。中国卫生健康统计年鉴收录了三次中国恶性肿瘤死亡抽样回顾调查,结果显示肺癌的死亡率呈增长趋势,现已居首位[2]。随着医学的发展和对疾病认识的深入,肺癌的治疗方法逐渐丰富,西医多采用手术、化疗、放疗、靶向、免疫等治疗方法,但患者预后欠佳,5 年生存率低。中医药在恶性肿瘤的治疗中应用范围广,配合放化疗、靶向治疗、免疫治疗等,可以增强治疗效果、减轻毒副反应、提高患者生存质量、延长生存期等。
肿瘤患者的发病因素复杂,且疾病的发生发展需要一定的过程,“虚、瘀、毒”是其中重要的病因病机[3],最后往往表现出虚实夹杂的症状。所以在治疗方面,不能单独针对实证应用祛邪的方法,还需兼顾扶正,针对患者的病情,祛邪与扶正并用,相得益彰,达到更好的治疗效果[4]。《素问·评热病论》中记载:“邪之所凑,其气必虚”。另外,在《医宗必读》中记载“积之成也,正气不足而后邪气踞之。”肺癌患者病位在肺,且久病伤气,导致肺气虚,往往会出现乏力、咳嗽、自汗等症状。肺气虚弱,“子盗母气”,导致脾气虚,出现纳差、大便溏等症状。故临床上常采用补肺益脾的方法治疗。一项关于原发性支气管肺癌中医证型与病理类型的相关性研究结果显示,肺癌患者以虚证多见,中医证型中比例最高为气虚证占22.1%、其次为气阴两虚证占17.5%[5]。
我国现存最早的本草著作《神农本草经》中,将药物分为上、中、下三品,黄芪和白术被列为上品[6]。黄芪归脾、肺经,具有补气固表、生津养血等功效。白术归脾胃经,具有健脾益气、止汗等功效,为“脾脏补气健脾第一要药。”白术在补脾气的同时,还能够“培土生金”,补益肺气。黄芪与白术相配伍,补益肺脾之气较单味药的力量更强,效果更好。一项基于关联规则探索中医药治疗晚期肺癌的辨证思路及用药规律的研究结果表明,使用频次居前三位的中药是黄芪、麦冬、白术[7]。另有一项基于数据挖掘技术对肺癌的中医药治疗进行分析,结果显示在治疗肺癌的处方中,黄芪使用频率为91.67%,白术为84.37%[8]。可见肺癌患者的处方中,黄芪、白术的应用广泛。但目前针对“黄芪—白术”在肺癌的防治作用机制方面缺乏深入研究。
针对中药多成分、多靶点、多途径的特点,网络药理学的研究与其高度适配。为预测“黄芪—白术”在治疗肺癌方面作用机制,本篇文章将通过网络药理学方法,对“黄芪—白术”的有效成分、作用靶点、蛋白互作、生物通路、信号通路进行研究,分析潜在的作用关系,为其今后的研究提供参考和理论基础。
1 材料和方法
1.1 化学成分及化合物靶点的筛选
通过Traditional Chinese Medicine Systems Phar⁃macology Database and Analysis Platform (TCMSP)平台(http://tcmspw.com/tcmsp.php),检索黄芪、白术的全部化学成分,并通过调整药代动力学参数(ADME)对化学成分进行筛选获得活性成分,相关参数设置为:口服利用度(oral bioavailability,OB) ≥30,药 物 相 似 性(drug−likeness,DL) ≥0.18。通过ADME 筛选后得到药物活性成分,并基于TCMSP 数据库筛选出活性成分的潜在作用靶点,通过Uniprot 数据库(https://www. uniprot.org/)对潜在作用靶点进行筛选和标准化命名,筛选条件为“reviewed” “homo sapiens”,标准化命名为基因名称。
1.2 疾病相关基因的筛选
以“肺癌”为关键词分别在“TTD”数据库(http://db. idrblab. net/ttd/)、DisGeNET 数 据 库(https://www. disgenet. org/)和“OMIM”数据库(https://www.omim.org/)进行检索,查找肺癌相关基因,并删除重复靶点。
1.3 成分靶点和疾病靶点的共同靶点的获取
使用R 语言VennDiagram 扩展包,对1.1 的成分潜在靶点与1.2 的疾病靶点取交集得到共同靶点,并绘制Venn图。
1.4 靶蛋白相互作用网络的构建
通 过 STRING (Version 11.0) 数 据 库(https://string−db. org/),对1.3 获得的共同靶点进行分析,设置蛋白种类为“homo sapiens”,获取靶蛋白相互作用数据,使用Cytoscape3.7.2 软件对结果可视化。
1.5 GO生物过程富集分析与KEGG通路富集分析
利用R 软件3.6.3 中的Bioconductor 相关数据包(http://www. bioconductor. org/)对1.4 获得的靶蛋白进行GO 生物过程富集分析和KEGG 通路富集分析,设置P<0.05 为差异有统计学意义,输出结果并绘制气泡图。
2 结 果
2.1 “黄芪—白术”化学成分及潜在靶点
通过“TCMSP”数据库共挖掘“黄芪—白术”中的全部化学成分,其中黄芪87 个,白术55 个。通过调整ADME 参数(OB≥30,DL≥0.18),以及对靶点进行Uniprot 筛选和标准化命名并去重后,共筛选出活性成分共19 个(见表1),潜在作用靶点180 个(见图1)。图中蓝色节点为黄芪和白术,绿色节点为“黄芪—白术”的活性成分,橙色节点为“黄芪—白术”活性成分的潜在靶点,橙色的颜色越深,表明其度值越大,378 条边代表活性成分与潜在靶点的相互作用关系。
2.2 疾病相关基因的筛选
以“肺癌”为关键词分别在“TTD”数据库、“DisGeNET”数据库和“OMIM”数据库进行检索,查找肺癌相关基因,删除重复数据后剩余650个疾病相关靶点。
2.3 成分靶点和疾病靶点的共同靶点的获取
通过R 语言Venn Diagram,对180 个成分潜在靶点与650 个疾病靶点取交集,得到29 个共同靶点,这29 个共同靶点视为“黄芪—白术”治疗肺癌的预测靶点(见图2)。
2.4 靶蛋白相互作用网络的构建
将“2.3”下得到的29 个交集靶点导入STRING(Version 11.0)数据库中进行分析,利用Cytoscape3.7.2 软件对所获取的靶蛋白相互作用数据进行PPI 网络构建(见图3)。共有29 个靶蛋白发生相互作用,靶点的degree 值越大则形状越大,代表靶蛋白之间互相作用的边共187条。在该蛋白质互作网络中平均度值为12.9,度值大于平均度值的靶点共12 个,将其从大到小排列,依次为:AKT1、 VEGFA、 EGFR、 ESR1、 CCND1、 IL6、PTGS2、ERBB2、CASP8、IL1B、CDKN1A、KDR,表明其在互作网络中具有重要作用,可作为“黄芪—白术”药对治疗肺癌的重要预测靶点。
2.5 GO功能富集分析及KEGG信号通路富集分析
将29个预测靶点基因提交至R 软件Bioconduc⁃tor 数据库进行GO 功能富集分析,按照P<0.05 进行筛选,其中涉及生物过程1 260 个(见图4),细胞组分12 个(见图5),分子功能32 个(见图6)。从生物过程富集分析中,主要涉及活性氧代谢过程、多细胞生物稳态、不同营养水平应答反应、外部刺激下的细胞应答、类固醇激素反应、凋亡信号通路的调控、上皮细胞增殖、氧化应激反应、T 细胞活化等。从细胞组分富集分析中,靶点主要集中在膜筏、膜微结构域、膜区、囊腔、核染色质等。从分子功能富集分析中,主要为蛋白磷酸酶结合、磷酸酶结合、抗氧化活性、泛素连接酶结合、泛素样连接酶结合、跨膜受体酪氨酸激酶活性、跨膜受体激酶活性、整合素结合、酪氨酸激酶活性、生长因子受体结合等。
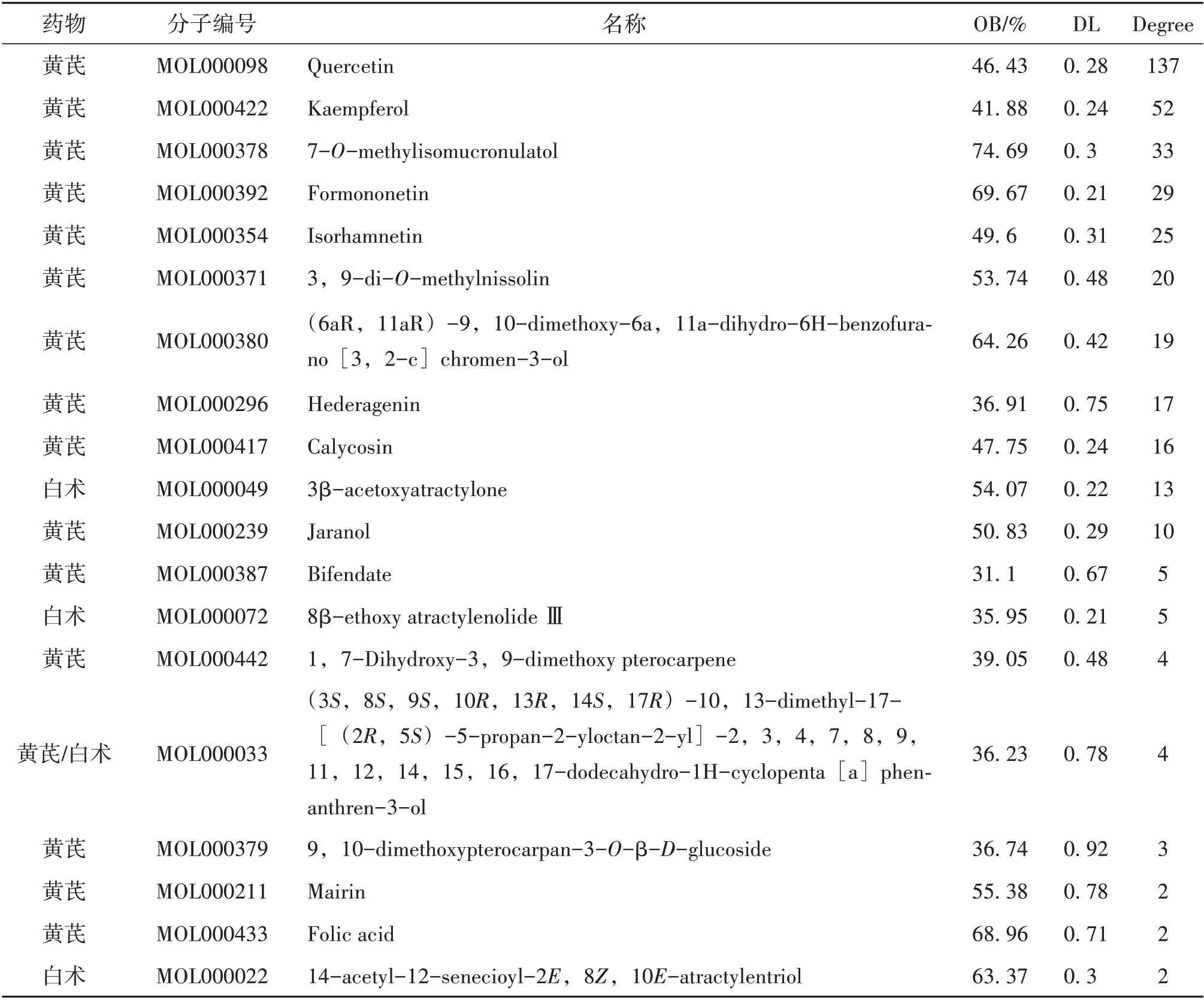
表1 “黄芪—白术”筛选出的活性成分Table 1 The active ingredients of"Astragalus membranaceus −Atractylodes macrocephala koidz"
将29 个靶蛋白基因提交至R 软件Bioconductor数据库进行KEGG 信号通路富集分析,按照P<0.05 进行筛选,其中涉及信号通路26 个(见图7)。在信号通路富集分析,主要涉及PI3K−Akt 信号通路、粘着斑、EGFR 酪氨酸激酶抑制剂耐药性、内分泌抵抗、铂类耐药性、HIF−1 信号通路、MAPK 信号通路、细胞衰老、Rap1 信号通路、Ras信号通路等。
3 讨 论
根据研究结果进行分析,“黄芪—白术”药对中口服利用度最高的是黄芪中的活性成分MOL000378 7−O−甲基−异微凸剑叶莎醇,为74.69%,另外黄芪成分中的MOL000392 芒柄花黄素、 MOL000433 叶 酸、 MOL000380 (6aR,11aR)−9,10−二甲氧基−6a,11a−二氢−6H−苯并呋喃[3,2−c]铬−3−醇以及白术中的活性成分MOL000022 14−乙酰基−12−千里香酰−2E,8Z,10E−白术三醇的口服利用度排名前五,由此推测这些成分在口服“黄芪—白术”时起到重要的药理学作用。
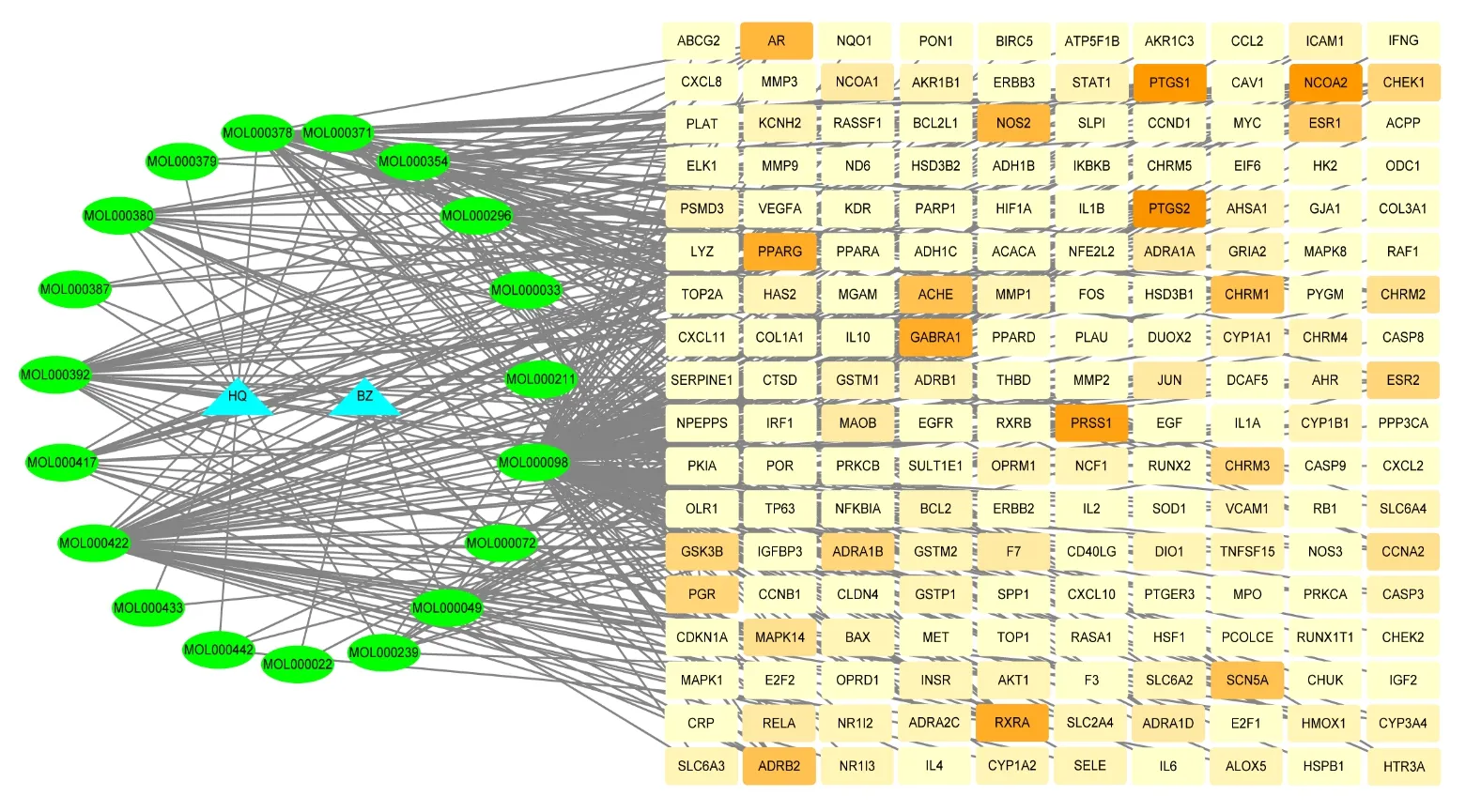
图1 “药对—化合物—靶点”的网络模型Fig.1 Network model of"drug pair−compound−target"

图2 “黄芪—白术”药对成分潜在靶点与肺癌疾病靶点Venn图Fig.2 Venn diagram of“Astragalus membranaceus −Atractylodes macrocephala koidz”drug pair potential targets and lung cancer disease targets
对“药对—化合物—靶点”网络模型进行分析,度值大于等于10 的靶点有11 个,占57.9%,从高到低依次为:槲皮素、山奈酚、7−O−甲基−异微凸剑叶莎醇、芒柄花黄素、异鼠李素、3,9−di−O−methylnissolin、(6aR, 11aR) −9, 10−dime⁃thoxy−6a,11a−dihydro−6H−benzofurano [3,2−c]chromen−3−ol、常春藤皂苷元、毛蕊异黄酮、3β−乙酰氧基苍术酮、熊竹素。其中度值最高的是槲皮素,为137,说明其能与137 个靶点发生相互作用。槲皮素对多种恶性肿瘤[9−11]的增殖有抑制作用。一项研究证实,槲皮素可诱导降低MMP−9 的活性,对NSCLC A549 的凋亡起到了重要作用[12]。山奈酚具有抗癌作用,有研究证实,山奈酚能抑制NSCLC A549细胞侵袭和迁移能力[13]。另有研究证实,山奈酚能够抑制SCLC H446 细胞的增殖,并诱导细胞的凋亡[14]。相关研究证实,芒柄花黄素对NSCLC A549 细胞有抑制其增殖和诱导凋亡的作用[15]。相关研究证实,异鼠李素在体外和体内试验均有抗肿瘤增殖的作用,其作用机制与诱导的细胞凋亡有关[16]。毛蕊异黄酮是《中国药典》里记载的黄芪含量测定成分,相关研究证实,毛蕊异黄酮可抑制肺癌细胞A549 细胞的增殖与转移[17]。除此之外,黄芪甲苷也是黄芪含量测定成分,本次因口服利用度、药物相似性小于筛选标准,故在筛选时排除,但是相关研究结果证实,黄芪甲苷也具有抗肿瘤作用[18]。白术活性成分中,靶点度值最高为3β−乙酰氧基苍术酮,度值为13,其次为8−β−乙氧基白术内酯Ⅲ,度值为5,以及白术活性成分中口服利用度63.37%的14−乙酰基−12−千里香酰−2E,8Z,10E−白术三醇,都属于白术挥发油成分,相关研究证实,白术挥发油成分在抗肿瘤方面有一定的效果[19]。另外,在180 个预测靶点中,有70 个靶点与至少2 个及以上的化合物相关,占38.9%。推测“黄芪—白术”药对发挥着复杂的成分及靶点作用。
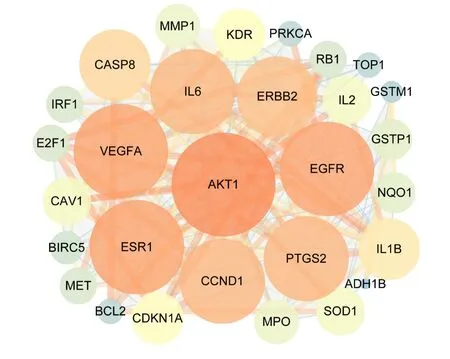
图3 靶蛋白蛋白互作网络模型(PPI)Fig.3 PPI network of target proteins
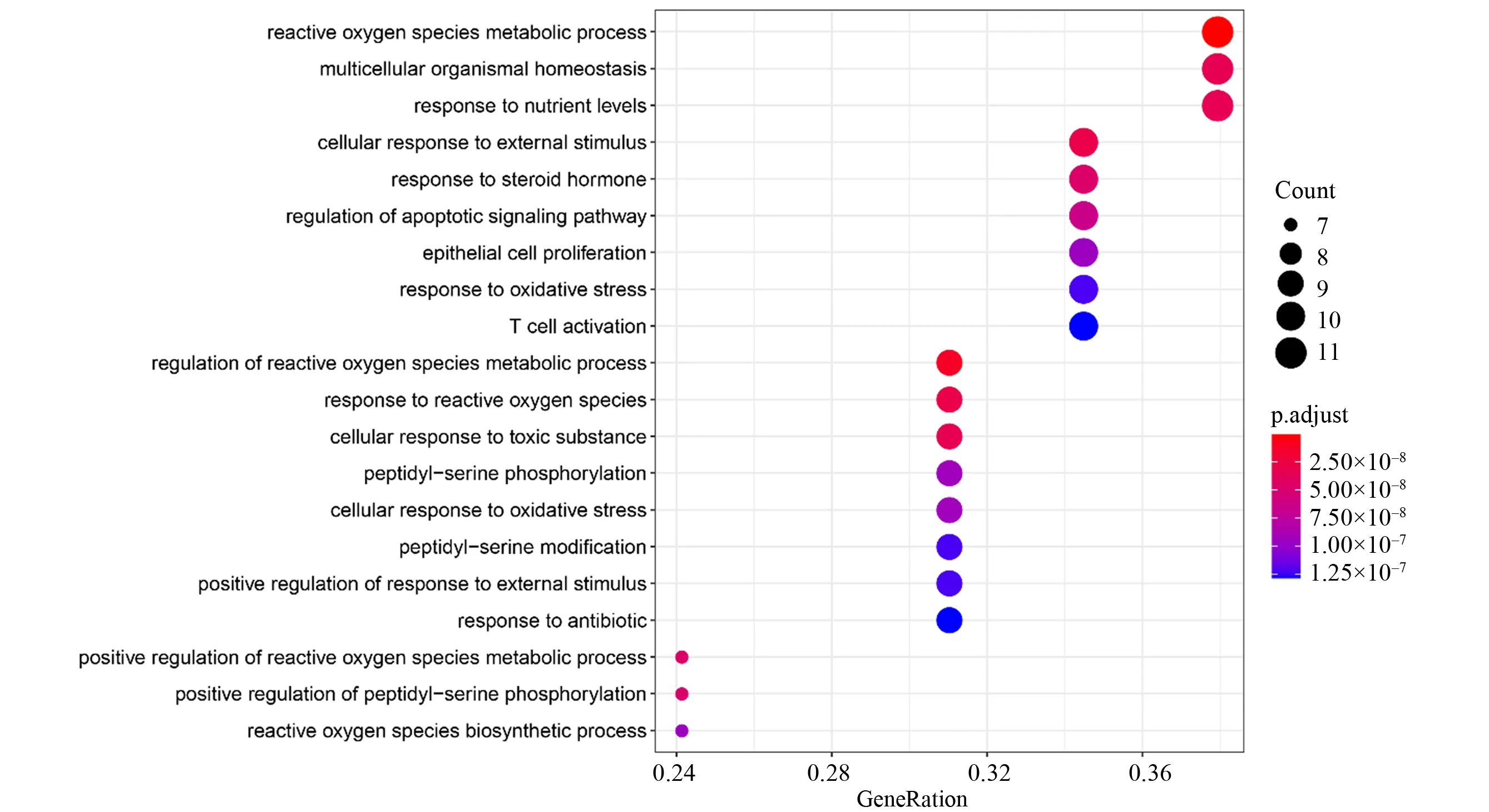
图4 “黄芪—白术”预测靶点基因生物过程富集分析Top20Fig.4 Enrichment analysis of biological processes of predicted target genes of“Astragalus membranaceus −Atractylodes macrocephala koidz”Top20
通过分析靶蛋白相互作用网络,度值大于平均度值的靶点共12个,从大到小前3位为:AKT1、VEGFA、EGFR。AKT 被认为是一种癌基因,AKT1 是AKT 的重要亚型,相关研究表明,AKT1在NSCLC中表达上调[20]。相关临床研究结果证明,AKT1 在NSCLC 发生过程中起促癌作用[21]。Folk⁃man[22]提出“肿瘤生长和转移依赖于新生血管生成”,为抗肿瘤血管生成药物提供了理论基础。VEGF 是常见的血管生成刺激因子,血管内皮生长因子A(VEGFA)是VEGF 中的一种。相关研究结果显示,NSCLC 患者癌组织VEGFA 阳性率高于癌旁组织[23]。VEGFA 与血管内皮生长因子受体(VEGFR)中的VEGFR2(又称KDR)参与调控血管生成,其主要是通过对ERK、PI3K/Akt 等通路的调控,从而诱导血管内皮细胞增殖[24]。目前针对抗血管生成药物有大量的研究,比如临床常用药贝伐单抗可与VEGFA 结合,从而减少VEGFA 与受体结合,达到抑制血管生长的目的[25]。EGFR是上皮生长因子(EGF)细胞增殖和信号传导的受体。研究表明,在许多实体肿瘤中存在EGFR 的高表达或异常表达[26]。异常活化的EGFR 信号通路与肿瘤细胞的增殖、侵袭、转移、细胞凋亡的抑制、血管生成均有关联。目前临床已有多种针对EGFR 及其相关信号通路的靶向药物,但其耐药性,仍是目前需要解决的问题。

图5 “黄芪—白术”预测靶点基因细胞组分富集分析Fig.5 Enrichment analysis of cellular component of predicted target genes of“Astragalus membranaceus −Atractylodes macrocephala koidz”
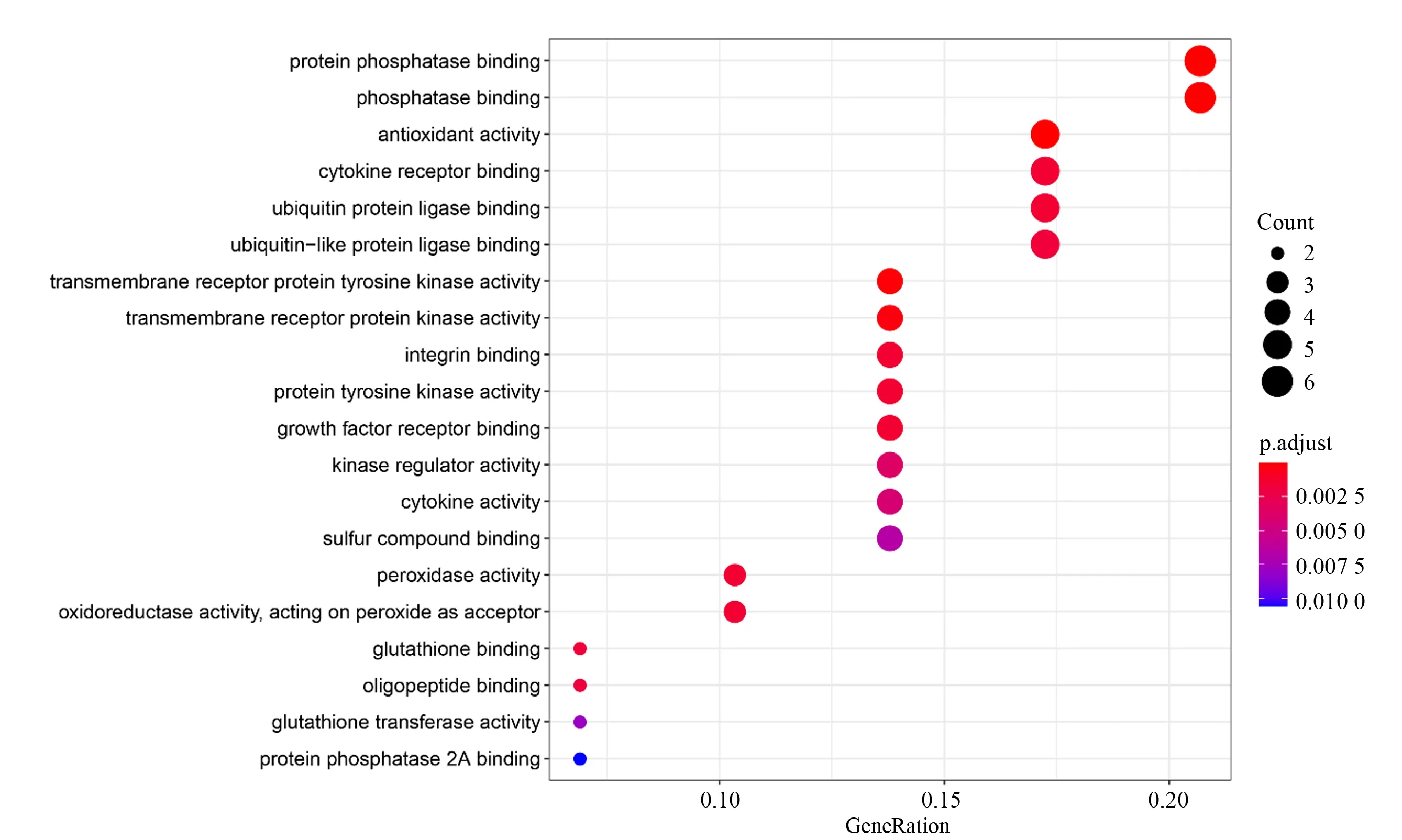
图6 “黄芪—白术”预测靶点基因分子功能富集分析Top20Fig.6 Enrichment analysis of molecular function of predicted target genes of“Astragalus membranaceus −Atractylodes macrocephala koidz”Top20
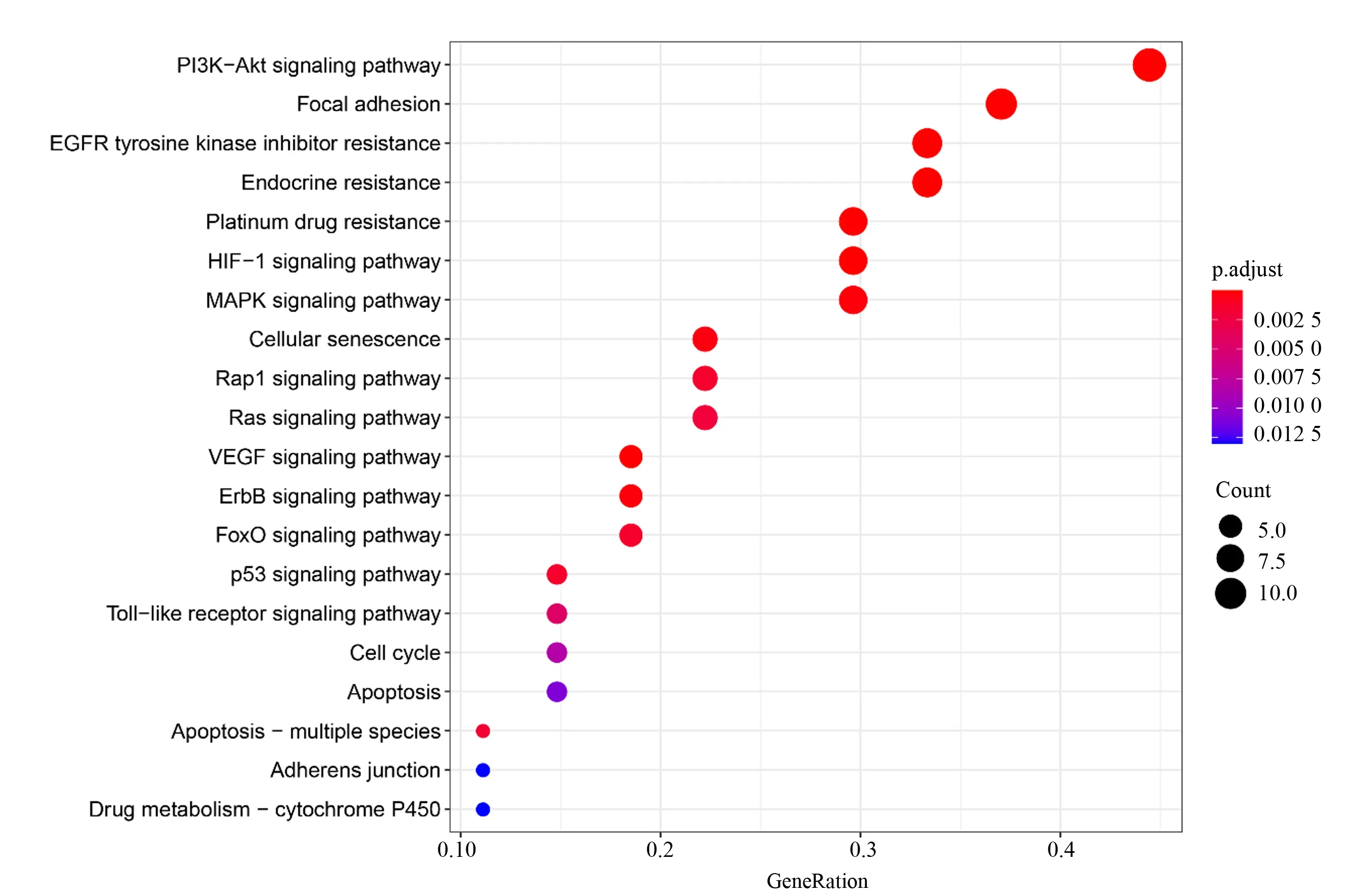
图7 “黄芪—白术”预测靶点基因信号通路富集分析Top20Fig.7 Enrichment analysis of KEGG pathway of predicted target genes of“Astragalus membranaceus −Atractylodes macrocephala koidz”Top20
通过生物功能富集分析,发现靶点参与了多项生物过程,其中活性氧(ROS)代谢功能涉及11 个靶点,度值最高。ROS 的积累易导致基因突变,从而增加细胞癌变的风险,考虑与其破坏DNA、蛋白质等有关系[27]。部分学者认为适度增高的ROS 与肿瘤的发生和发展有着密切联系,包括参与肿瘤活化的初始阶段、参与多阶段的致癌过程、促进肿瘤细胞的恶性增殖、参与肿瘤的侵袭和转移[28−29]。与此同时,相关研究证明高浓度的ROS 能够做到阻滞细胞周期、诱导细胞的凋亡和坏死[30]。在临床治疗方面,部分化疗药物通过产生大量的ROS 杀伤肿瘤细胞,以达到治疗目的。综上,ROS 代谢功能的增高程度,对于肿瘤的发生发展有不同的结局,所以针对ROS 的调控在肿瘤治疗方面非常关键。
在KEGG 信号通路富集分析中发现,“黄芪—白术”药对涉及多种信号通路,其中PI3K−Akt 信号通路在肿瘤的发生发展过程中起到重要作用,PI3K/AKT 信号通路与促进细胞增殖、抑制细胞凋亡、促进肿瘤血管生成、促进肿瘤转移、化疗耐药性等有关[31]。另还有研究证实,通过抑制PI3K/Akt 信号通路,能有效地逆转肺癌细胞对于顺铂的耐药[32]。为肿瘤治疗提供了新的思路,针对PI3K/AKT 信号通路的抑制剂是近年的研究热点。有研究表明,EGFR 在肺癌、胃癌、结肠癌等肿瘤中,存在过表达的现象。EGFR 的过表达会促进肿瘤的生成、肿瘤血管的生成,以及肿瘤的转移。EGFR酪氨酸激酶抑制剂的靶向药物,为肿瘤的治疗提供了新的方向,但靶向治疗在取得治疗效果的同时,仍需面临继发性耐药的问题。针对晚期NSCLC 存在EGFR 基因突变的患者,第一、二代EGFR 酪氨酸激酶抑制剂在治疗6 至13 个月时出现继发性耐药,第三代则在治疗9 至3 个月时出现继发性耐药[33]。延缓继发性耐药的时间,与患者的生存时间紧密相关。
通过网络药理学的预测分析,“黄芪—白术”药对在治疗肺癌的过程中涉及多活性成分、多靶点和多信号通路,为今后的研究提供了参考和思路,但网络药理学的预测分析仍存在不足,比如未涉及到用药剂量、用药时间、用药剂型、药物相互作用等,针对此方面的问题,还有待相关研究的进一步证实。
