儿童1型糖尿病血管并发症血清学预测指标的研究
2020-10-19陶月红
韩 敬,陶月红
(1.大连医科大学,辽宁 大连 116044;2.扬州大学临床医学院 江苏省苏北人民医院,江苏 扬州 225001)
全球1型糖尿病(type 1 diabetes mellitus,T1DM)的患病率正逐渐升高,且呈低龄化趋势[1-2]。T1DM患者带糖生活时间长、急慢性并发症发生风险高,给患者、家庭及社会带来了沉重的负担。随着胰岛素的临床应用,急性并发症的病死率明显降低,但慢性并发症如糖尿病微血管病变、大血管病变、神经病变等,成为威胁患者生命的主要原因。在对糖尿病并发症发生发展机制的不断探索和研究的过程中,发现晚期糖基化终产物(advanced glycation end products,AGEs)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)可能是重要影响因素[3-4]。关于AGEs和iNOS及血糖控制情况、糖尿病并发症的相关研究,多见于动物实验及2型糖尿病患者中,而在T1DM患者,尤其是在儿童T1DM的研究中较为少见。
众所周知,糖化血红蛋白(glycohemoglobin A1c,HbA1c)是临床评价长期血糖控制的“黄金标准”。但血糖波动程度也是评估血糖控制不可或缺的部分。由自我血糖监测计算得到的血糖标准差(standard deviation of blood glucose,SDBG)可用来评估血糖波动情况[5]。目前公认,尿白蛋白肌酐比(urinary albumin/creatinine ratio,UACR)是糖尿病患者早期肾脏病变的筛查指标[6],血流介导的血管扩张功能(flow-mediated dilatation,FMD)是评价血管内皮功能的指标[7]。本文旨在研究血清AGEs水平和iNOS活性与血糖控制情况、病程,以及UACR、FMD的关系,探讨AGEs和iNOS作为T1DM患儿早期微血管及大血管并发症预测指标的可行性。
1研究对象与方法
1.1研究对象
选取2018年1月至2019年12月在江苏省苏北人民医院儿科就诊的T1DM患儿,参照纳入及排除标准筛查后,T1DM组的研究对象共有33例,其男童10例,女童23例;年龄为4~16岁;病程为0.1~84.0个月。选择健康对照组15例,其中男童5例,女童10例。所有研究对象的监护人均知情同意。
纳入标准符合2018年国际儿童青少年糖尿病协会提出的T1DM的诊断标准[8]。①实验室检测指标:血浆血糖≥200mg/dL(11.1mmol/L),或空腹全血血糖(FPG)≥126mg/dL(7.0mmol/L);或口服糖耐量试验葡萄糖负荷后2h静脉血葡萄糖≥200mg/dL(11.1mmol/L);或HbA1c≥6.5%;或糖尿病相关自身抗体的酪氨酸磷酸酶样胰岛素瘤抗原2、谷氨酸脱羧酶抗体、胰岛素自身抗体、β细胞特异性锌转运蛋白8自身抗体中一项为阳性。②临床表现:起病年龄小,20岁以前起病;起病急,有糖尿病典型“三多一少”症状(烦渴多饮、多尿、多食、不明原因的体重下降),部分直接表现为脱水、循环衰竭或昏迷等酮症酸中毒的症状;治疗上依赖胰岛素治疗。
排除标准:①2型糖尿病,其他类型糖尿病,如新生儿糖尿病、年轻的成年发病型糖尿病(maturity onset diabetes of the young,MODY)、胰腺外分泌疾病等;②甲状腺功能亢进,肾上腺皮质功能减退等其他内分泌疾病;③酮症酸中毒;④先天性心血管疾病。
1.2研究方法
收集研究对象的一般资料:年龄(岁)、身高(cm)、体重(kg)、糖尿病病程(月);血糖资料:自我指尖血糖检测值(mmol/L)、HbA1c(%);血管功能指标:UACR(mg/g)、FMD(%)。
收集研究对象的早晨空腹血清样本,于-80℃冷冻储存。采用酶联免疫法测定血清AGEs水平及iNOS活性,按试剂盒说明书进行操作,试剂盒均购自上海信裕生物科技有限公司。
血糖波动程度通过SDBG体现:由研究对象提供的自我指尖血糖监测值计算得到其标准差[5]。
身体质量指数(BMI)=体重(kg)/[身高(m)]2。
1.3统计学方法
2结果
2.1 T1DM组与健康对照组各指标的比较
对T1DM组与健康对照组的各指标进行比较,符合正态分布资料的比较采用独立样本t检验,非正态分布资料的比较应用非参数检验。T1DM组与健康对照组的年龄、BMI、FMD间均无显著性差异(均P>0.05),T1DM组的HbA1c、AGEs、iNOS、UACR均高于健康对照组,两组间均存在显著性差异(均P<0.05),见表1。因受伦理学限制,健康对照组未进行每日多次的血糖监测,故缺乏SDBG数值。
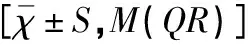
表1 T1DM组与健康对照组各指标的比较结果
2.2 T1DM血清预测指标与其他指标的关系
对T1DM患儿血清预测指标与其他指标进行相关性分析。AGEs与HbA1c、SDBG、UACR均呈正相关(均P<0.05),与FMD呈负相关(P<0.05);iNOS与HbA1c、SDBG、UACR均呈正相关(均P<0.05),与FMD呈负相关(P<0.05);AGEs和iNOS与病程、年龄、BMI均无相关性(均P>0.05),见表2。

表2 T1DM血清预测指标与其他指标的相关性结果
3讨论
3.1血清AGEs水平与血糖控制指标及病程关系的分析
本研究结果显示T1DM患儿血清AGEs水平高于健康儿童,且与HbA1c、SDBG均呈正相关,但与病程无相关性,即T1DM患儿血糖控制越差,血清AGEs水平越高。分析其机制:AGEs是还原糖与蛋白质、脂蛋白、核酸发生非酶促共价结合,然后再进行一系列折叠、重排形成的不可逆化合物[9]。糖尿病患者高血清葡萄糖为AGEs的产生提供了原料;而长期高血糖和血糖波动触发机体的氧化应激加速了AGEs的形成,同时机体产生过多的AGEs又反过来加强氧化应激,由此形成一个恶性循环[10-11]。Jaisson等[12]的研究显示,T1DM患者血清AGEs水平与HbA1c呈正相关,与病程无相关性。这与本研究结果一致。本研究表明,在平均病程不足2年的情况下,T1DM患儿血清AGEs水平仍与血糖控制指标存在正相关,更加说明了早期强化血糖控制及保持血糖相对稳定的重要性。
3.2 AGEs作为T1DM早期微血管及大血管并发症预测指标的可行性
本研究结果显示,T1DM患儿血清AGEs水平与FMD呈负相关,而与UACR呈正相关,即T1DM患儿血清AGEs水平越高,内皮功能和肾功能越差。这验证了AGEs在T1DM早期大血管和微血管病变中的损伤作用。分析其机制:AGEs通过抑制内皮iNOS的表达来减少内皮细胞源性一氧化氮(NO)的产生,导致内皮功能受损[13];而且AGEs与AGEs受体结合诱导氧化应激炎症反应,导致血管内皮功能受损[14]。有研究表明,糖尿病患者内皮功能障碍与血清AGEs水平有关,存在严重内皮功能障碍时,血清AGEs水平更高[15]。这都表明AGEs在糖尿病大血管疾病发生发展中起重要作用。血清AGEs水平可作为T1DM患儿早期大血管并发症的预测指标。
肾脏中AGEs的沉积和AGEs-AGEs受体轴的激活导致肾小球基底膜增厚、系膜扩张、肾小球系膜细胞和肾小管细胞损伤、肾小球硬化[3,16],这些都是糖尿病肾病的病理学改变,临床上将会表现为尿蛋白排泄增加和肾功能进行性恶化。有研究表明,足细胞损伤是蛋白尿形成的重要组成部分,而AGEs参与糖尿病患者足细胞的损伤[17]。可见血清AGEs水平相较于UACR可能反应更早的糖尿病肾脏损害。血清AGEs水平可以作为T1DM患儿早期微血管并发症的预测指标。
3.3血清iNOS活性与血糖控制指标及病程关系的分析
本研究结果显示,T1DM患儿血清iNOS活性明显高于健康儿童,并且与血糖控制指标呈正相关,血糖控制越差,iNOS活性越高。高血糖导致iNOS活性表达增加的机制为:iNOS几乎只在炎症、氧化应激等病理条件下才表达、激活。糖尿病患者长期处于高血糖病理状态,刺激单核细胞激活多种炎症细胞释放炎症因子[18],且不正常的短期血糖波动可活化核因子(nuclear factor-kappa b,NF-kB)等核因子,调节炎症基因的表达,加重机体氧化应激炎症反应[19],这些都会导致糖尿病患者体内iNOS活性表达增加。本研究中未发现血清iNOS活性与病程的关系。这可能与本研究中病例数偏少、病程短有关。
3.4 iNOS作为T1DM早期微血管及大血管并发症预测指标的可行性
本研究结果显示,T1DM患儿血清iNOS活性与UACR呈正相关,iNOS活性越高,UACR越高,这验证了iNOS对糖尿病患者早期肾功能的损害作用。分析其机制:高血糖使机体iNOS活性表达增加,然后催化产生大剂量NO参与糖尿病肾病的发生和进展[20]。Hofni等[21]的动物实验表明,由链脲佐菌素诱导的糖尿病大鼠模型,其UACR水平、iNOS活性表达较健康对照组显著增加,经过螺内酯与坎地沙坦联合治疗后,iNOS活性表达显著降低,从而改善了UACR。这支持本研究结果。FMD是评价大血管功能较可靠的检测指标,但目前尚未见可靠的iNOS与FMD临床关系的研究。Li等[4]的研究发现,通过抑制NF-kB途径减少iNOS的表达激活可减轻糖尿病大血管病变。本研究结果显示,T1DM患儿血清iNOS活性与FMD呈负相关,即血清iNOS活性越高,FMD越低,血清iNOS活性可能成为预测T1DM早期大血管病变的预测指标。
