科尔沁沙地樟子松根内真菌群落结构和功能群特征*
2020-10-17赵珮杉郭米山高广磊丁国栋
赵珮杉 郭米山 高广磊 丁国栋 张 英
(1.北京林业大学水土保持学院 水土保持国家林业和草原局重点实验室 北京 100083;2.宁夏盐池毛乌素沙地生态系统国家定位观测研究站 盐池 751500)
根际微生物是连接根系与土壤的重要纽带(Puglisietal., 2013; Becketal., 2015),根内真菌定殖(或部分定殖)于植物根内,其多样性和群落结构与宿主植物的生长、发育和更新能力存在密切关系(Philippotetal., 2013; Baldrian, 2017)。一般来说,根内真菌可分为寄生真菌、腐生真菌和共生真菌3种类型(Bonitoetal., 2016; Kilpelainenetal., 2016)。其中,寄生真菌诱发植物病害,威胁森林生态系统健康; 腐生真菌是生态系统重要的分解者,参与生态系统物质转化和能量循环(Mooreetal., 2004); 共生真菌主要为菌根真菌,能够促进宿主植物吸收水分和矿物质养分,协助植物提高抗逆性和适应性(Frewaetal., 2018; Martinetal., 2017)。因此,根内真菌组成及其功能直接影响宿主植物的生长和健康状况,与生态系统稳定性存在密切联系。
一般来说,根内真菌对宿主植物常表现出特定偏好,具有宿主特异性,这一现象在植物组成丰富多样的天然次生林中尤为明显(Tojuetal., 2013a; Picklesetal., 2015)。但在干旱荒漠地区,降水稀少,植被单一、稀疏,部分根内真菌也表现出较强的普适性,能广泛定殖于多种宿主植物(Botnenetal., 2014; Mergesetal., 2018)。根内真菌分布及其选择宿主植物的影响因素较为复杂,既依赖于宿主植物特性,又与环境条件密切相关。在大空间尺度水平,气候和生境条件是造成植物根内真菌组成差异的主要原因(Davidetal., 2016; Barnesetal., 2016a); 而在小空间尺度水平,土壤理化性质则是根内真菌物种丰度和组成变化的主要影响因素(Gaoetal., 2015; Liuetal., 2015)。林龄即是林分的重要属性特征,又对林下土壤理化性质有重要影响(Gaoetal., 2014)。已有研究表明,林龄是影响根内真菌定殖的重要因子(Kyaschenkoetal., 2017),宿主植物受病原菌侵害程度与林龄密切相关(Sangüesa-Barredaetal., 2015),菌根真菌的侵染率、多样性和群落组成均随林龄的变化而变化(陈雪冬等, 2017; Spakeetal., 2016),在不同演替阶段根内真菌的优势菌种存在差异(Daveyetal., 2015)。因此,针对干旱荒漠地区不同林龄固沙植被,探究其根内真菌群落结构和功能群特征,对植被恢复和森林抚育管理具有重要意义。
樟子松(Pinussylvestrisvar.mongolica)天然分布于呼伦贝尔红花尔基地区,具有适应性强、耐低温干旱、生长迅速等特点(任悦等, 2018),是我国干旱、半干旱和亚湿润干旱区防风治沙的重要常绿乔木树种(朱教君等, 2007)。鉴于此,本研究以科尔沁沙地樟子松人工林为研究对象,基于高通量测序和真菌功能群划分,比较分析不同林龄樟子松根内真菌多样性、群落组成和真菌营养类型特征,以期为樟子松人工林经营管理提供依据。
1 研究区概况
研究区位于科尔沁沙地东南部的辽宁省彰武县章古台沙地森林公园(42°23′N,122°22′E),海拔226.5 m。属温带亚湿润大陆性季风气候,光照充足,昼夜温差大。年均气温8 ℃,年均降水量526.5 mm,年蒸发量约1 932.7 mm,年均日照时数为2 615.2 h。土壤类型为风沙土。研究区常见植物包括樟子松、胡枝子(Lespedezabicolor)、小叶锦鸡儿(Caraganamicrophylla)、狗尾草(Setariaviridis)、羊草(Leymuschinensis)、冰草(Agropyroncristatum)等。
2 研究方法
2.1 样品采集与处理
2017年7月,在26、33和43年生樟子松人工林内各设置1个50 m×50 m的样地(以下简称26a、33a和43a)。对每个样地内所有樟子松进行树高和胸径的测量并进行相关调查,详情见表1。每个样地随机选取间距8 m以上的5株标准木作为采样对象。采样时,先用铁锹除去林木基部半径2 m内的地表覆盖物,后沿其根部小心挖至根的末级,剔除杂根。将3个样地共15株樟子松细根样品及少量新鲜土壤(保鲜根样)分别装入塑封袋中并编号,并置于4 ℃便携式保温箱内带回。同时,采集适量根系附近土壤样品用于土壤理化性质分析。
2.2 根内真菌的分子鉴定
根系样品带回后保存于-80 ℃冰箱。试验时,用蒸馏水轻轻冲洗根样以去除杂物,并剪成10 cm左右的根段,洗净后将同一样地的根尖样品充分混合,再随机分成5份作为重复组。参照PowerSoil® DNA Kit(MO BIO公司)试剂盒说明书对根尖样品进行DNA提取。采用PCR对根内真菌的rDNA ITS区进行扩增,真菌通用引物为 ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和 ITS2(5’-GCTGCGTTCTTCATCGATGC-3’),每个样本重复3次。对PCR扩增产物进行凝胶电泳检测,合格后使用Illumina MiSeq平台进行上机测序。利用NCBI数据库中BLAST 分析对相似性≥97% OTU序列进行比对,并注释其群落的物种信息,注释遵循以对比相似度≥97%鉴定到种水平,相似度介于90%~97%之间则可鉴定到属水平(Kennedyetal., 2010)。
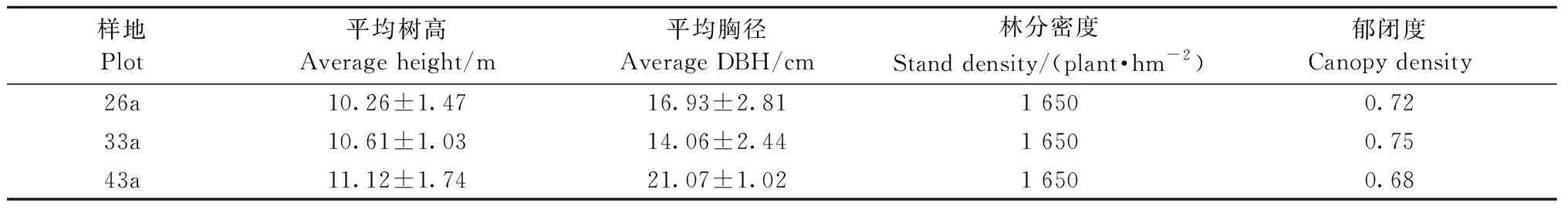
表1 样地概况Tab.1 Basic characteristics of the three sampling plots
2.3 真菌功能类群分析
利用FUNGuild v1.0将樟子松根内真菌划分为不同的营养型和功能群(表2),结果数据仅保留置信度为“很可能”(Probable)和“极可能”(Highly probable)的OTUs及其类别; 将营养类型鉴定为复合营养型的群落全部纳入“其他真菌”(Other fungi),功能群鉴定为复合多功能方式的群落分别统一为该营养型下的“其他病理/腐生真菌”(Other pathogenic/saprotrophic fungi)(Nguyenetal., 2016)。
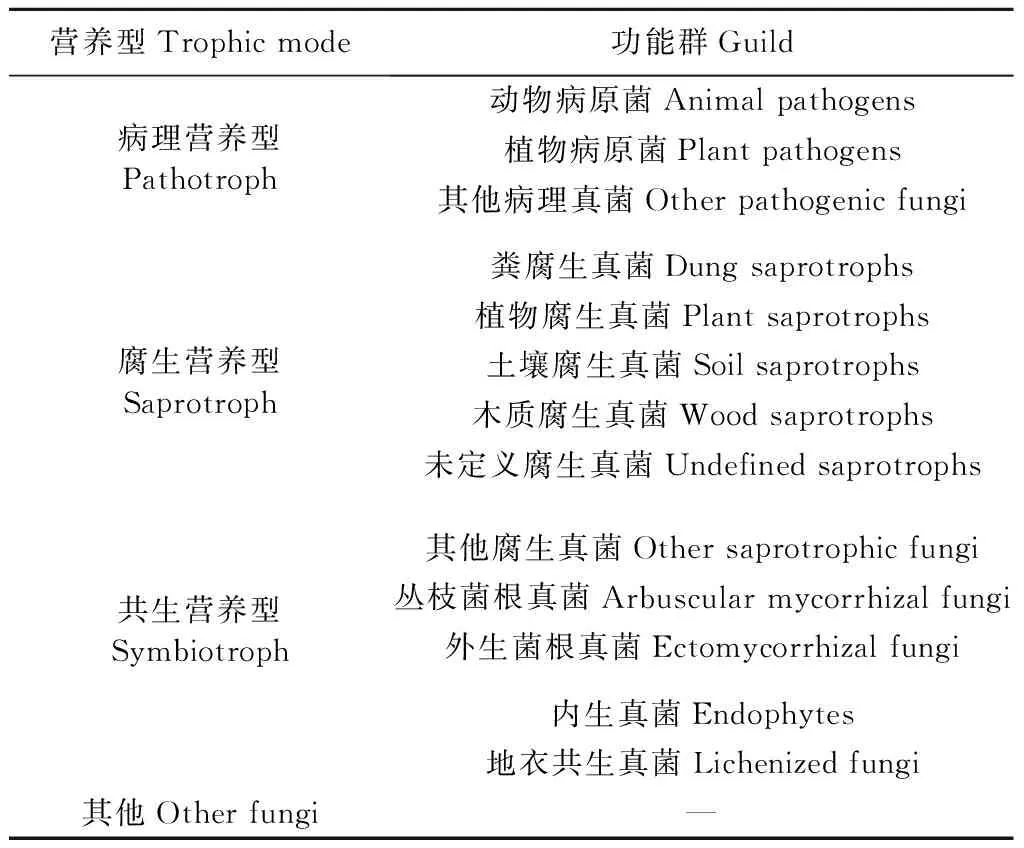
表2 真菌营养型和功能群的划分Tab.2 Classification of trophic mode and guild for fungi
2.4 土壤理化性质测定
采用环刀烘干称重法测定土壤孔隙度(total soil porosity,TSP)和土壤含水量(soil water content,SWC),采用pH分析仪(上海雷磁,中国)测定土壤pH值,采用重铬酸钾外加热法测定土壤有机碳(soil organic carbon,SOC)含量,采用全自动化学分析仪(Smartchem 200,意大利)测定土壤全氮(total nitrogen,TN)和全磷(total phosphorus,TP)含量。
2.5 数据分析
根据真菌类群在整体群落中的占比划分优势度,占比≥10%为优势属,1%~10%为常见属,≤1%为稀有属(谯利军等, 2018)。采用SPSS 20进行数据处理与分析,包括最小显著性差异法(LSD)和斯皮尔曼相关性检验(Spearman’s rank correlation),运用R 3.5.1进行Shannon、Simpson和Pielou多样性指数及物种相关性矩阵计算,采用OriginPro 2017和Cytoscape绘图和输出结果。
3 结果与分析
3.1 樟子松根内真菌alpha多样性
从科尔沁沙地26a、33a和43a样地樟子松根尖样品中共获得根内真菌高质量ITS序列384 016条及可划分OTU数量832个。如表3所示,随着林龄的增加,樟子松根内真菌Shannon、Simpson和Pielou指数逐渐增大,均在43a样地中达到最大值,分别是2.04、0.72和0.44,但不同林龄林分之间无显著差异(P>0.05)。
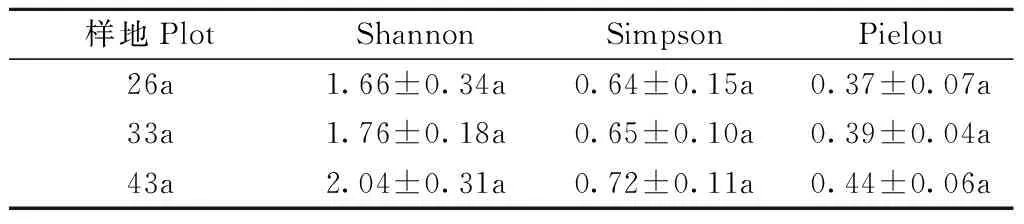
表3 科尔沁沙地樟子松根内真菌多样性指数①Tab.3 Diversity indices of fungi in roots of P. sylvestris var. mongolica in the Horqin Sandy Land
3.2 樟子松根内真菌群落组成
科尔沁沙地樟子松根内真菌隶属于5门16纲54目84科182属。从门水平上看(图1),不同林龄均包含子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota),且每种菌门在不同林龄中的相对丰度均不存在显著差异(P>0.05)。子囊菌门的相对丰度随林龄增加逐渐降低,由68.11%下降至57.79%。担子菌门相对丰度随林龄增加而增加,变化范围为29.32%~38.41%。接合菌门相对丰度均值为2.99%,壶菌门和球囊菌门占所有根内真菌的0.05%。
从属水平上看(图2),各林龄沙地樟子松根内真菌优势属和常见属共包括22属。其中,26a样地优势属为鞘孢属(Chalara)和肉座菌属(Hypocrea),33a样地优势属为Phialocephala、鞘孢属和肉座菌属,43a样地优势属为Phialocephal。26a、33a和43a样地根内真菌优势属占所有真菌属的比例分别为42.89%、47.58%和17.83%。26a、33a和43a样地根内真菌常见属分别有10、9和18属,占比分别为 46.19%、42.13%和72.34%。稀有属个数和占比在不同林龄间相近,分别是128、130和126属以及10.92%、10.30%和9.83%。随着林龄增长,优势属比例呈下降趋势,常见属呈增加趋势,而稀有属则保持在一个较为稳定的水平。结合它们的相对丰度进行聚类分析(图2),26a和33a样地聚合性较好,表明其2组根内真菌组成结构具有较高的相似度。
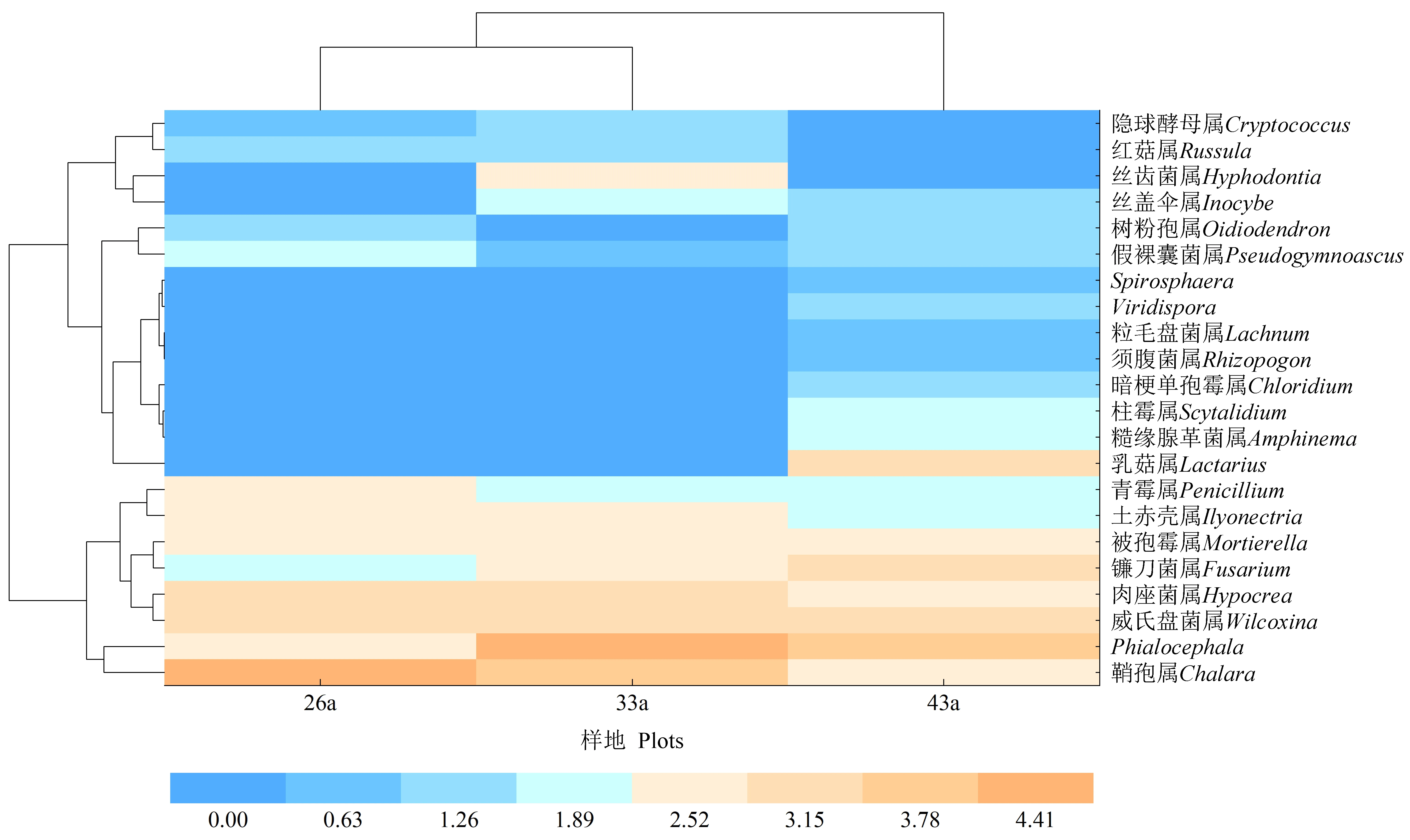
图2 科尔沁沙地樟子松根内真菌聚类热图Fig.2 Cluster heatmap of fungi in roots of P. sylvestris var. mongolica in the Horqin Sandy Land
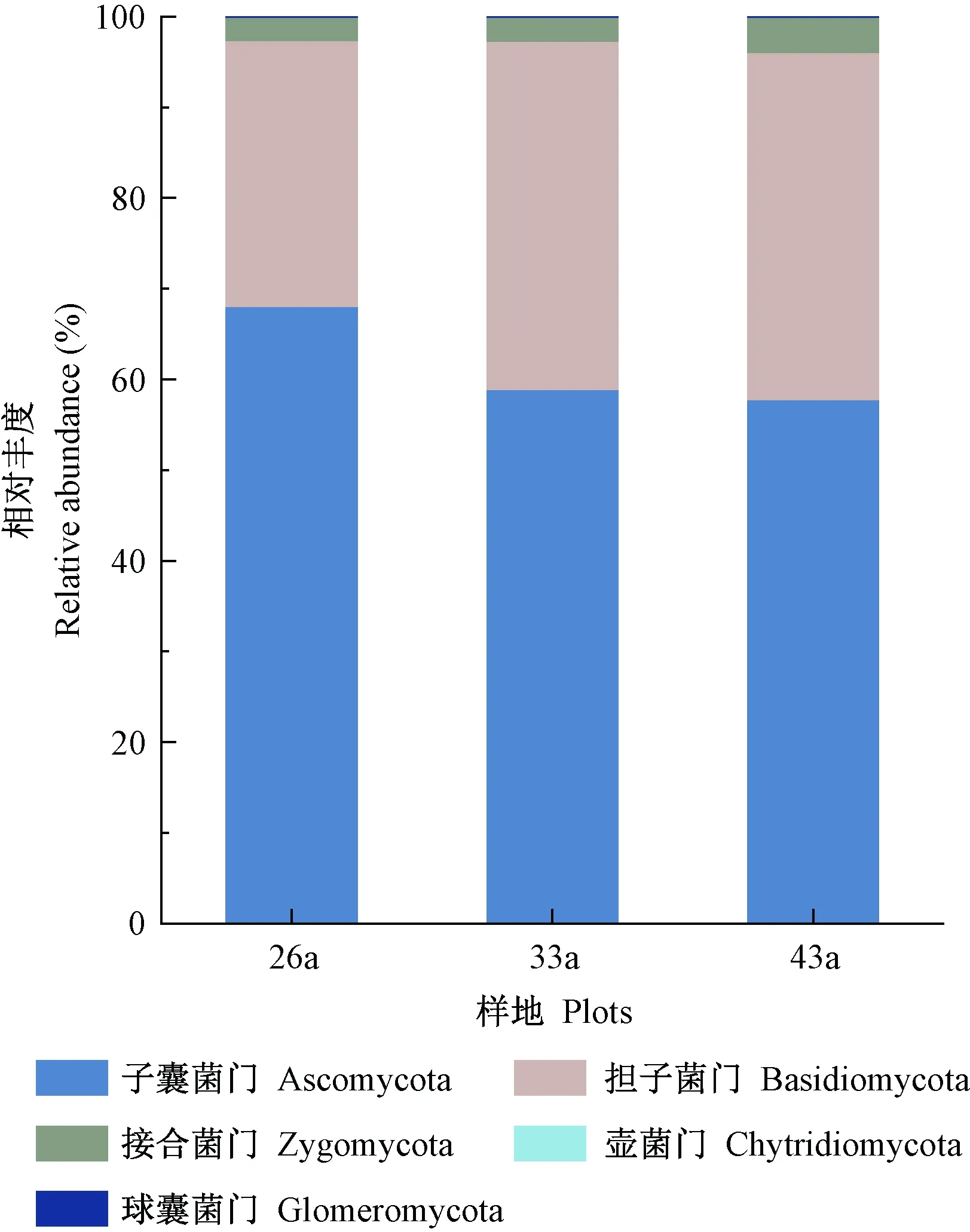
图1 科尔沁沙地樟子松根内真菌门的相对丰度Fig.1 The relative abundance of fungi in roots of P. sylvestris var. mongolica in the Horqin Sandy Land
3.3 沙地樟子松根内真菌生态功能群
科尔沁沙地樟子松不同营养型真菌相对丰度随着林龄的增加呈现出不同的变化趋势(图3)。病理营养型真菌相对丰度呈现下降趋势,由17.48%下降到7.73%,腐生营养型较为稳定(7.84%~10.06%),共生营养型则表现出较大波动,在26a、33a和43a样地中的相对丰度分别为22.05%、38.90%和48.79%。其中,不同林龄中共生营养型根内真菌主要由外生菌根真菌和内生真菌组成,且均存在少量丛枝菌根真菌。26a和33a样地的共有优势属(鞘孢属和肉座菌属)均为复合营养型真菌,33a和 43a样地的共有优势属Phialocephala为内生真菌。43a和33a样地中相对丰度较高的乳菇属(Lactarius)、丝盖伞属(Inocybe)、糙缘腺革菌属(Amphinema)和须腹菌属(Rhizopogon)均为共生营养型中的外生菌根真菌。

图3 科尔沁沙地樟子松根内真菌功能群的网络分布Fig.3 Function network of fungi in roots of P. sylvestrisvar. Mongolica in the Horqin Sandy Land不同真菌营养型在各样地中的相对丰度用扇形图表示,真菌属在不同林龄的相对丰度由边厚度表示,节点的面积表示所有样品中属的绝对丰度,不同林龄根内真菌共16个优势属和常见属被可靠鉴定。The pie diagram indicates the relative abundance of trophic mode in different age groups, the thickness of links indicates the relative abundance of genera, the square measure of nodes roughly represents the absolute abundance of genera in all samples, 16 dominant genera and common genera were identified reliably.
3.4 土壤理化性质对根内真菌多样性和营养型的影响
不同林龄樟子松根围土壤的理化性质如图4所示。 26a样地中土壤含水量显著高于33a和43a样地(P<0.05),土壤有机碳、全氮和全磷含量均呈随林龄增加而均出现显著升高(P<0.05),表明土壤养分含量上升。根系周围土壤理化性质与根内真菌多样性指数和根内真菌营养型相对丰度的相关性如表4所示,根内真菌多样性与土壤理化性质均无显著相关关系(P>0.05),不同真菌营养型中仅共生营养型真菌相对丰度与土壤含水量显著负相关(P<0.05)。
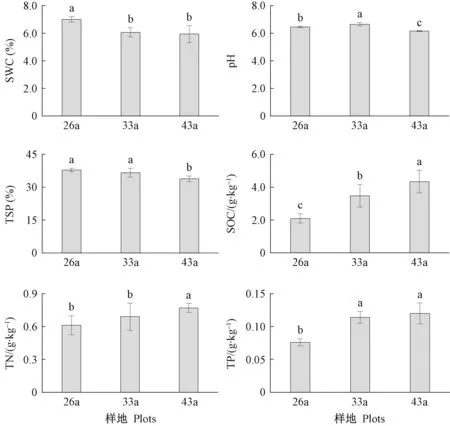
图4 科尔沁沙地樟子松根围土壤理化性质Fig.4 Soil properties of rhizospheric soil under P. sylvestris var. mongolica in the Horqin Sandy LandSWC: 土壤含水量Soil water content; TSP: 土壤孔隙度Total soil porosity; SOC: 有机碳Soil organic carbon; TN: 全氮Total nitrogen; TP: 全磷Total phosphorus. 下同The same below.
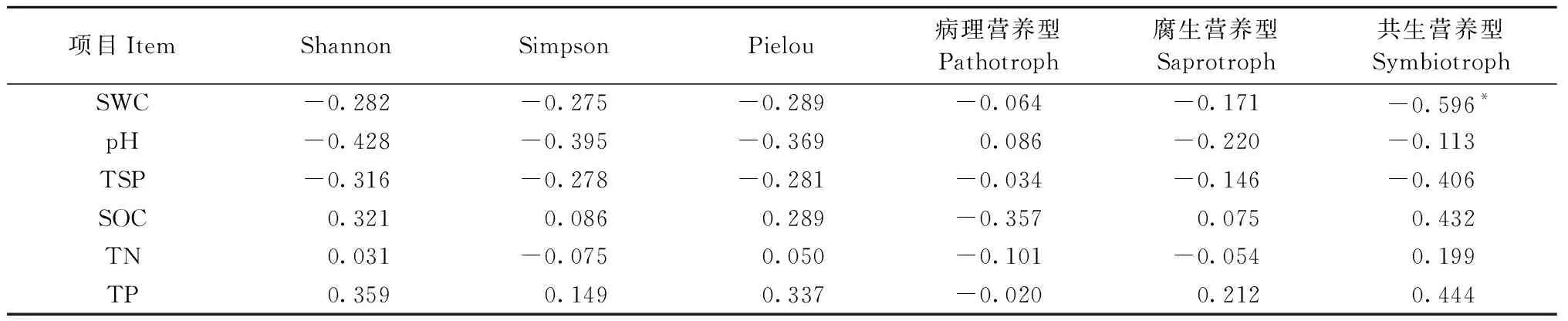
表4 沙地樟子松根内真菌多样性和营养型相对丰度与土壤理化性质的相关性①Tab.4 Correlation coefficients between diversity and relative abundance of the trophic mode with soil properties
4 讨论
4.1 科尔沁沙地樟子松根内真菌多样性和群落组成
土壤真菌多样性指数的高低代表着群落稳定性和抵抗力强弱(高尚坤等, 2018),43a样地中樟子松根内真菌群落抗扰能力强于26a和33a样地,这对樟子松的健康生长具有积极效应。众所周知,植物根内真菌丰富度和多样性常受土壤pH值和有机质含量等因素影响(Toljanderetal., 2006; Barnesetal., 2016b),然而沙地樟子松根内真菌多样性与环境干扰因素的相关性较差,这种现象在先前研究中同样存在(Jumpponenetal., 2014; Entwistleetal., 2013),这是因为真菌多样性与环境因子的相关性取决于所处生态系统的范围和类型,在某些生态系统中真菌对气候变化的承受力具有较大弹性(Zhengetal., 2017)。
从门水平上看,科尔沁沙地樟子松根内真菌主要由子囊菌门和担子菌门组成,其余为少量结合菌门及极少量壶菌门和球囊菌门,这与栎树(Quercus)和极地柳(Salixpolaris)等外生菌根依赖型树种根内真菌群落组成结果相似(Tojuetal., 2013b; Kernaghanetal., 2011)。其中,不同林龄中子囊菌门相对丰度均高于担子菌门,一是因为子囊菌的进化速度和物种多样性均高于担子菌(王海英等, 2010),在干旱地区的适应性更强; 二是因为沙地土壤中养分含量较低,而子囊菌门包含的许多腐生真菌能将难降解性有机质分解、促进营养元素矿化过程,使土壤中养分含量增加并提高可利用率,从而间接影响着植物的生长(Barnesetal., 2018)。从属水平上看,沙地樟子松根内真菌优势属为鞘孢属、肉座菌属和Phialocephala,其中: 鞘孢属被认为是造成植物枯梢的植物病原菌(Tuliketal., 2018),肉座菌属是通过产生抗生素抑制植物病原真菌的腐生真菌(Jaklitsch, 2009),而FUNGuild却将鞘孢属鉴定为复合营养型,肉座菌属鉴定为病理营养型,这可能是因为内生真菌在发育阶段的不稳定性导致它们不停地改变生态策略,于是生活史复杂的病原菌在不同的宿主中表现出不同的生活状态(Arnoldetal., 2007); 也可能是伴随着根内真菌所在植物根系组织的死亡,其为维持正常的生理活动而改变自身的营养方式(Paulin-Mahadyetal., 2002)。Phialocephala为常出现于健康植物中的深色有隔内生真菌(dark septate endophytes,DSE),在针叶树种DSE中占主要地位(Suronoetal., 2018),它能激发植物对非生物胁迫的抗性,加速根系内物质运输和矿化作用,抑制根系病原菌(Mandyametal., 2005; Tellenbachetal., 2013)。总体上看,不同林龄沙地樟子松根内真菌优势属和常见属的种类和占比波动较大,出现真菌组成异质性的原因可能是林龄影响了宿主植物根系分泌物的组成成分(李娇等, 2014),而不同根系分泌物将直接影响根际微生物的数量和群落结构(Lladóetal., 2018)。
4.2 科尔沁沙地樟子松根内真菌生态功能特征
植物根系中不同营养型真菌之间相互促进与制约,根内真菌功能群结构组成与植物生长发育状况密不可分。43a和33a样地中,相对丰度高于26a样地的根内真菌为乳菇属、丝盖伞属、糙缘腺革菌属和须腹菌属,它们均为樟子松林常见的外生菌根真菌(郭米山等, 2018),这证实了外生菌根真菌多样性在森林发育的前30~40年增长较快(Wuetal., 2013; Wallanderetal., 2010)。共生营养型真菌的增加同时对病理营养型和腐生营养型真菌产生影响: 一方面,共生营养型真菌可对植物致病菌产生拮抗作用,减少病原菌的定殖以保护植物免受病害(Nagyetal., 2013; Frewaetal., 2018),导致病理营养型真菌不断减少; 另一方面,菌根真菌(尤其是外生菌根真菌)对土壤中营养物质的大量摄取,腐生真菌和其他微生物分解者受到抑制(Grauetal., 2017)。因此,即使土壤养分含量随林龄增加,科尔沁沙地樟子松根内腐生营养型真菌相对丰度一直处于较为平稳的水平。沙地樟子松根内真菌营养型结构随林龄的变化表现出一定的波动,共生营养型真菌占优势时宿主的抗扰能力增加(Chuetal., 2016),反之,若病理营养型和腐生营养型真菌比例高于共生营养型真菌,则极易导致植物病害发生(Millbergetal., 2015)。
土壤理化性质和根内真菌功能类型组成之间的因果关系难以确定,真菌自身生理活动直接影响土壤生态系统的健康与稳定,同时土壤水分和养分又是真菌的主要物质来源(Lietal., 2018)。干旱区沙地樟子松的生长发育过程需要大量水分,增加共生真菌有助于植物根系从土壤中吸收水分(Groveretal., 2011),从而导致土壤含水率降低。土壤pH值在土壤真菌群落组成和功能类型上的影响普遍存在(Barnesetal., 2018),研究区沙地樟子松人工林根围土壤pH值在6~7之间,并与根内真菌功能群结构无显著相关性,这是因为真菌对pH值变化的敏感程度较低,具有较广的土壤酸碱耐受范围,且无明显生长抑制区(许美玲等, 2004; Rousketal., 2010)。本研究中大部分土壤理化性质并未与根内真菌营养型组成出现显著相关关系,这是因为宿主根系与根内真菌保持着相对稳定的供养和反馈相互作用(陈智裕等, 2017),此时根系微环境已经过强烈的环境过滤,改变土壤性质对根内真菌群落的变化影响程度较低(Becketal., 2015)。
值得注意的是,每个样地的樟子松根尖样品均鉴定出极少量的丛枝菌根真菌,同样作为具有外生菌根真菌侵染偏好型的北美红栎(Quercusrubra)和赤松(Pinusdensiflora)根系中也发现了此类现象(Dickieetal., 2001; Tojuetal., 2018a)。在26a和43a样地根尖样品中鉴定出的杜鹃花类菌根真菌粉枝孢属(Oidiodendron),在纸桦(Betulapapyrifera)、香脂冷杉(Abiesbalsamea)和白云杉(Piceaglauca)等非杜鹃花植物根系中也被鉴定出(Kernaghanetal., 2011)。这跨越了根据宿主植物种类对菌根真菌进行划分的传统分类模式,更进一步证实宿主与真菌共生体存在较强的环境依赖性(Tojuetal., 2018b)。
5 结论
1)科尔沁沙地樟子松根尖样品共获得832个OTUs,根内真菌多样性指数随林龄的增加而不断增大,但不同林龄樟子松人工林不存在显著差异,且根内真菌多样性和土壤理化性质无显著相关关系。
2)不同林龄樟子松根内真菌隶属于5门16纲54目84科165属,子囊菌门和担子菌门为主要组成部分,根内真菌优势属包括鞘孢属、肉座菌属和Phialocephala。不同林龄根内真菌群落组成存在异质性,中优势属和常见属菌种类型和相对丰度变动较大。
3)科尔沁沙地樟子松根内真菌功能群组成丰富,随林龄的增加科尔沁沙地樟子松根内共生营养型真菌急剧增加,同时病理营养型呈现下降趋势,腐生营养型维持在一个稳定水平。土壤含水量和共生营养型真菌相对丰度存在显著相关关系。
