无视网膜病变的糖尿病患者视网膜神经与血管损害及其相关性分析△
2020-10-17胡云燕曾运考曹丹余洪华庄雪楠李娟杨静吴乔伟刘宝怡张良
胡云燕 曾运考 曹丹 余洪华 庄雪楠 李娟 杨静 吴乔伟 刘宝怡 张良
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病的主要微血管并发症之一,也是全球致盲的主要原因之一[1]。研究发现,早期发现2型糖尿病并筛查视网膜病变与降低视网膜病变的患病率和严重程度有关[2]。一旦出现临床上可见的视网膜病变,就较难逆转损害,DR进展的风险也会增加[3-4]。此外,目前对DR的治疗主要集中在视网膜结构和视力已经受到影响的晚期[5]。如果我们对神经血管损伤的早期发病机制有更清晰的认识,就可能提供新的、更有效的预防策略。因此,在糖尿病患者中检测和监控临床前期DR患者的神经血管细微变化具有一定临床意义。
既往研究表明,无DR(NDR)的糖尿病患者存在神经节细胞复合体(ganglion cell complex,GCC)层厚度减少、视网膜神经纤维层(retinal nerve fiber layer,RNFL)厚度减少和毛细血管密度降低等视网膜结构损害[6-8]。此外,视网膜电图(ERG)研究还发现,NDR患眼潜伏期延长和振幅降低[9]。虽然这些研究已经提示了NDR患者视网膜结构和功能异常的改变,但仍需要更多的研究来阐明神经结构、功能变化及其对应的微循环之间的关系。
RETeval是一种新型、手持式、免散瞳的全视野ERG记录设备,它使用一种特殊的皮肤电极来采集ERG信号。既往研究表明,该装置能有效地检测出糖尿病患者ERG异常[10-11]。视锥细胞密度在黄斑中心凹最高,频率为28.3Hz的闪光ERG可以显示视锥系统的电活动[12]。此外,光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)能够定量测量黄斑和视盘的神经结构及其相应的血流供应。目前,国内对NDR患者的ERG与OCTA参数的改变及其相关性的研究尚少。因此,本研究拟利用RETeval电生理检查系统及OCTA对NDR患者的视网膜神经血管结构进行探讨,为揭示DR早期的神经血管退行性病变提供更多的证据。
1 资料与方法
1.1 一般资料招募66例未合并DR的2型糖尿病患者为NDR组,招募62名健康者为对照组。2型糖尿病由内分泌科医师根据美国糖尿病协会的诊断标准确定[13]。根据《国际临床糖尿病性视网膜病变和糖尿病性黄斑水肿疾病严重程度量表》对DR进行诊断和分级[14]。若双眼均符合纳入标准,则随机选取一眼的数据纳入分析。排除标准:(1)有其他影响眼神经血管结构的疾病(如青光眼、葡萄膜炎、屈光不正> 3.00 D等);(2)有眼部手术史、外伤史、弱视史;(3) 合并DR者;(4) OCTA成像质量不佳者(扫描质量<6);(5)眼压>21 mmHg(1 kPa=7.5 mmHg)者;(6)有严重全身性疾病病史者。本研究经广东省人民医院研究伦理委员会批准(编号:2016232A),所有参与者均知情同意并签署知情同意书。
1.2 一般检查受试者接受完整的眼部检查,包括最佳矫正视力(BCVA)、眼压、屈光状态和裂隙灯检查。根据裂隙灯眼底镜检查和ETDRS 35° 7个标准视野彩色视网膜照相(日本 Topcon),由经验丰富的眼科医师对DR进行分级。同时记录2型糖尿病患者糖化血红蛋白(HbA1c)水平及糖尿病病程。
1.3 ERG检查采用RETeval(美国 LKC)仪器检测ERG,按照厂家指定的使用指南进入DR评估程序检查[15-16]。该程序旨在评估内层视网膜的视锥体通路,闪光刺激频率为28.3 Hz,脉冲持续时间小于1 ms,默认闪光刺激视网膜照度为16 Td·s(6.0 mm瞳光直径时,1 cd·s·m-2=28.3 Td·s)和32 Td·s。患眼无需散瞳,下眼睑下方2 mm置电极,患者平静状态下注视内置的指示灯,选择DR评估程序并开始检测,即可在5 min左右完成双眼检查。观察ERG波形(图1),记录ERG潜伏期、振幅、不同光刺激下瞳孔面积比和DR评分。DR评估程序可以根据潜伏期、振幅、年龄和瞳孔反应生成一个DR评分,DR评分的参考范围为7.0~19.9分[10]。
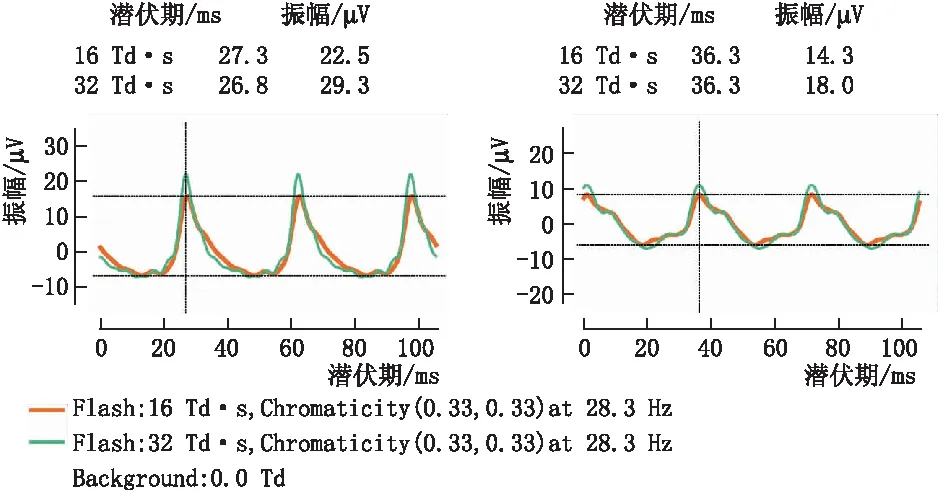
图1 16 Td·s 和32 Td·s光刺激时对照组右眼ERG波形(左) 和NDR组右眼ERG波形(右)
1.4 OCTA检查应用美国Optovue公司的OCTA系统,散瞳后在暗房中进行OCTA检查。选择黄斑HD 6.0 mm×6.0 mm和视盘HD 4.5 mm×4.5 mm程序,使用840 nm光源,每秒进行70 000次A扫描。软件自动生成浅层毛细血管丛(superficial capillary plexus,SCP)和深层毛细血管丛(deep capillary plexus,DCP),SCP从内界膜(internal limiting membrane,ILM)延伸到内丛状层(inner plexiform layer,IPL)10 μm以上,DCP则由IPL 10 μm以上延伸到外丛状层(outer plexiform layer,OPL)10 μm以下。FD300的定义是黄斑中心凹无血管区周围300 μm区域的血管密度(vessel density,VD),FD300包含该区域从ILM到OPL的毛细血管密度。GCC层是指从RNFL延伸到IPL。软件自动拟合黄斑中心凹,形成直径1.0 mm的圆。旁中心凹区定义为与黄斑中心凹1.0 mm圆同心的直径3.0 mm的圆环,中心凹周围区定义为围绕旁中心凹的直径6.0 mm的圆环(图2A、图2B)。定量测量以下参数:SCP、DCP在旁中心凹区和中心凹周围区的VD、FD300(图2C)、GCC层厚度。软件自动拟合以视盘为中心的圆(直径2.0 mm),视盘周围区域定义为围绕视盘2.0 mm圆的1.0 mm宽的圆环(图2D)。放射状视盘周围毛细血管层是指从ILM至RNFL的厚度,定量测量放射状视盘周围毛细血管层范围内的视盘周围VD和RNFL厚度。采用分频幅去相关血管成像对VD进行量化。

图2 某健康右眼的OCTA定量测量图 A:黄斑区SCP 6.0 mm×6.0 mm图。旁中心凹区:2个蓝色环之间的区域(环宽=1.0 mm);中心凹周围区:中间蓝色环和红色环之间的区域(环宽=1.5 mm)。B:黄斑区DCP 6.0 mm×6.0 mm。C:两条黄线之间面积的VD代表FD300(黄斑中心凹无血管区周围300 μm宽的区域)。D:视盘4.5 mm×4.5 mm图。视盘周围区:两个蓝色环之间的区域
1.5 统计学处理采用SPSS 19.0软件行数据分析。采用Shapiro-Wilk test检验数据的正态性,采用t检验或χ2检验比较NDR组与对照组的差异,应用Pearson相关性分析评价眼部结构、ERG参数与临床相关指标之间的线性相关性,采用多元线性回归分析方法研究ERG潜伏期与其他参数的相关性。检验水准:α=0.05。
2 结果
2.1 两组一般资料对比对照组和NDR组入选者的年龄分别为(55.16±12.50)岁和(58.77±12.13)岁;对照组62名健康者中男31名、女31名,NDR组66例患者中男38例、女28例,对照组62眼中右眼30例、左眼32例,NDR组66眼中右眼35例、左眼31例。两组患者年龄、性别比例、眼别构成差异均无统计学意义(P=0.100、0.390、0.599)。NDR组患糖尿病的病程为(8.65±6.50)a,HbA1c水平为(9.21±2.54)%。
2.2 两组OCTA测量参数对比NDR组黄斑区(包括旁中心凹区及中心凹周围区)SCP、DCP的VD均明显低于对照组(均为P<0.01),NDR组FD300 也明显低于对照组(P<0.001)。NDR组与对照组间的GCC层厚度相比差异无统计学意义(P=0.661),但NDR组的RNFL厚度明显低于对照组(P=0.009)。与对照组相比,NDR组视盘周围VD明显降低(P<0.001)(见表1)。

表1 对照组与NDR组OCTA检测各参数比较
2.3 两组ERG检测结果比较在16 Td·s和32 Td·s光刺激时与对照组相比,NDR组ERG潜伏期均延长、振幅均下降(均为P<0.01)。NDR组的DR评分显著高于对照组,而NDR组的瞳孔面积比显著低于对照组(均为P<0.01)(见表2)。

表2 对照组与NDR组ERG检测结果比较
2.4 糖尿病相关指标与眼结构、ERG参数的单变量线性分析16 Td·s和32 Td·s刺激时的ERG潜伏期与HbA1c水平均呈显著正相关(r=0.434,P=0.001;r=0.448,P<0.001),但与糖尿病病程均不相关(均为P>0.05)。旁中心凹区和中心凹周围区的SCP和DCP的VD与糖尿病病程均呈显著负相关(均为P<0.05),但与HbA1c水平均不相关(均为P>0.05)。FD300、GCC层厚度、视盘周围VD、RNFL厚度及16 Td·s和32 Td·s刺激时的ERG振幅与HbA1c水平和糖尿病病程均未呈现出有统计学意义的相关性(均为P>0.05)(见表3)。

表3 糖尿病病程、HbAlc与眼结构、ERG参数的Pearson相关性分析
2.5 ERG参数与视网膜神经血管结构的单变量分析及多元线性回归分析16 Td·s和 32 Td·s光刺激的ERG潜伏期的延长均与旁中心凹区、中心凹周围区SCP的VD降低和中心凹周围区DCP的VD降低显著相关(均为P<0.01);16 Td·s和 32 Td·s光刺激的ERG潜伏期延长也跟FD300的降低显著相关(均为P<0.01);GCC层厚度与16 Td·s的潜伏期呈负相关(r=-0.243,P=0.049)(见表4)。在多元线性回归分析中(见表5),16 Td·s和 32 Td·s光刺激的ERG潜伏期的延长均与HbA1c升高显著相关(β= 0.350,P<0.001;β= 0.328,P<0.001)。此外,16 Td·s和 32 Td·s光刺激的ERG潜伏期的延长只与旁中心凹区SCP的VD下降显著相关(β=-0.266,P=0.013;β=-0.253,P=0.005)。

表4 OCTA参数与ERG参数的Pearson相关系数

表5 16 Td·s和 32 Td·s光刺激ERG潜伏期的多元回归模型
3 讨论
本研究我们发现,在眼底出现肉眼可见的视网膜病变之前,糖尿病患者视网膜结构和功能损伤就已经开始。在单因素线性分析中,多个神经和血管结构的损伤均与ERG潜伏期延长有关,而在多因素回归分析中,只有旁中心凹区SCP的VD下降与潜伏期延长相关。本研究全身性的因素中,HbA1c水平与潜伏期呈正相关。
近年来越来越多的证据表明,在没有临床可见DR的糖尿病患者中存在视网膜神经血管损伤。随着OCTA的发展,一些研究发现,NDR患者VD较健康人下降[8,17]。VD的改变可能是由于视网膜神经血管自动调节功能被破坏引起的[18]。此外,血管内皮细胞损伤是慢性高血糖最重要的病理反应,进而引发DR缺血特征的进行性加重[5]。一旦内皮细胞开始丢失,视网膜毛细血管就变成无细胞状态,这也可能是导致视网膜VD降低的原因之一。
在神经结构方面,既往研究发现,与健康对照者相比,临床前期DR患者的视盘周围RNFL厚度显著降低[19]。NDR患者的黄斑区GCC层厚度明显变薄[20]。但Demir等[21]发现,在2型糖尿病患者中,不管有没有DR,RNFL和GCC层厚度均无显著改变。本研究中,NDR患者的GCC层厚度变化与RNFL厚度变化并不是同时发生的,之前也有研究发现GCC层和RNFL厚度的变化并不相关[22]。GCC层厚度变薄的确切机制尚不清楚。DR神经退行性改变的可能原因包括细胞凋亡增加、胶质细胞反应活性增加和谷氨酸代谢改变[23]。内层视网膜代谢需求较高,灌注相对较低,更容易受到糖尿病引起的代谢应激的影响[24]。有研究发现,视网膜神经节细胞和无长突细胞可能是高糖诱导凋亡的第一批神经元[5]。然而,在本研究中,NDR患者与对照组的GCC层厚度没有明显差异,这表明本研究入组的糖尿病人群GCC层相对完好,可能不是造成视功能损害的原因,但仍需要更进一步的研究来阐明糖尿病患者视网膜神经血管结构的变化。
本研究中,ERG的结果提示NDR者存在早期的视功能损害。ERG被认为是早期神经元异常的敏感标记[25]。既往有研究使用ERG来预测神经功能障碍和血管异常之间可能的关系[26-27]。RETeval是一款手持、免散瞳、全视野闪光ERG检查系统。它用一个直径为60 mm的ganzfeld圆屋顶产生闪光刺激,由3个彩色发光二极管(绿色,530 nm;红色,622 nm;蓝色,470 nm)来产生白光刺激。在测试过程中,瞳孔大小被自动实时测量。刺激闪光亮度自动调整,以保持恒定的视网膜闪光照度。在28.3 Hz的光刺激下,闪光光反应是由on-off通道和受体后on-off通道产生的,它们在较高的刺激频率下对正弦波闪光ERG起着重要作用[28]。换句话说,ERG检测视锥通路主要反映GCC的功能。如上所述,OCTA检测到的GCC层是由分布在ILM和OPL之间的毛细血管供血的。OCTA检测的血管区域较好地反映了受体后on-off通道的灌注情况。视锥体通路功能依赖于神经和血管结构的完整性。在本研究中,NDR患者的GCC层厚度与对照组差异无统计学意义,而VD已经显示出损伤的迹象。此外,在多元线性回归分析中,只有旁中心凹区SCP的VD与潜伏期相关,而GCC层厚度和视盘周围RNFL的厚度与视功能变化无关。Soliman等[29]发现,NDR糖尿病患者的旁中心凹区视锥细胞密度与健康对照组相当。综上,我们推测,ERG在NDR患者中检测到的视功能变化可能是由于黄斑血供受损所致。
以往的研究发现,视锥细胞介导的30 Hz闪光和视锥细胞孤立的振荡电位与血糖或HbA1c水平无关[30-31]。然而,本研究结果表明,HbA1c水平的升高与ERG潜伏期延长有关,糖尿病病程的延长与黄斑VD降低有关。HbA1c过高提示近3个月左右血糖控制不良[32]。长期高血糖会导致视网膜缺氧并诱发炎症反应[33-34]。这些因素可能导致糖尿病患者视网膜结构和神经功能的损害。因此,控制好血糖对预防和延缓DR的进展至关重要。
本研究有几个局限性。首先,OCTA检查只能定量测量后极部视网膜的VD和GCC层厚度,而视锥体通路细胞分布于整个视网膜,虽然视锥体通路大部分位于黄斑区,但周围视网膜的结构变化尚不清楚。其次,本研究仅记录并分析了HbA1c水平及糖尿病病程这两个因素与视网膜结构和功能的关系,而没有涉及血压、血脂等可能影响眼底血管病变的因素,并且由于样本量不够大,没有对HbA1c与糖尿病病程进行分层分析。最后,本研究为横断面研究,糖尿病造成的神经功能和结构损伤的纵向变化仍需要进一步研究。
综上所述,糖尿病患者视网膜结构和功能的损伤可能先于可见视网膜病变的出现。NDR糖尿病患者黄斑微循环已有损害,伴随着ERG潜伏期延长和振幅降低,且较高的HbA1c(血糖控制不良)与NDR患眼ERG潜伏期延长有关。
致谢:感谢广东省人民医院统计学工作室提供的统计支持!
