抗感染联合痰热清注射液治疗肺癌患者放射性肺纤维化的疗效及作用机制研究
2020-10-17马新国丛金鹏
马新国,丛金鹏
1青岛大学临床学院,山东 青岛266003
2青岛大学附属医院呼吸内科,山东 青岛2660000
肺癌是临床常见的恶性肿瘤。2018 年全球癌症统计数据结果显示,肺癌新增病例高达200 万,死亡人数达到170 万左右,发病率和病死率均位于第1 位[1]。受无法耐受手术、晚期病变无法行手术切除等因素的影响,临床约2/3 的患者需接受放射治疗。近年来,虽然放疗技术得到了较大的发展,但肺组织对放疗毒性较为敏感,治疗期间仍不可避免地会出现不同程度的放射性肺损伤。放射性肺损伤的早期表现为放射性肺炎,晚期表现为放射性肺纤维化(radiation-induced lung fibrosis,RILF),二者的时间界限不一,多为数周至6 个月不等[2]。RILF 为不可逆性肺损伤,临床多采用糖皮质激素、抗感染药物等治疗RILF,但效果并不理想。痰热清注射液具有清热、解毒、化痰的功效[3],在慢阻肺、支原体肺炎等疾病的临床治疗中应用较为广泛。近年来,有研究指出,痰热清注射液预防及治疗放射性肺损伤有一定成效[4],但具体作用机制尚不明确。本研究对痰热清注射液治疗肺癌患者RILF 的治疗效果进行分析,并探讨其作用机制,现报道如下。
1 对象与方法
1.1 研究对象
选取2016 年11 月至2019 年11 月青岛大学附属医院收治的66 例肺癌放疗后伴随RILF 的患者。纳入标准:①临床病理检查确诊为非小细胞肺癌;②患者均接受放疗,且研究期间未接受任何其他治疗;③RILF 的诊断参照美国放射治疗肿瘤协作组(Radiation Therapy Oncology Group,RTOG)提出的放射性损伤评价标准[5];④TNM 分期为Ⅲ~Ⅳ期;⑤卡氏功能状态(Karnofsky performance status,KPS)评分﹥60 分;⑥预计生存期﹥3 个月。排除标准:①合并其他恶性肿瘤;②合并急性、慢性感染性疾病、血液系统疾病、免疫系统疾病及内分泌系统疾病;③合并严重的心、肝、肾等脏器功能障碍;④放疗期间及放疗后接受化疗或有同一部位放疗史;⑤过敏体质;⑥存在精神疾患和意识障碍;⑦妊娠期或哺乳期妇女。采用随机数字表法将66 例肺癌放疗后伴随RILF 患者随机分为观察组和对照组,每组33 例。两组患者的年龄、性别、化疗史、KPS 评分、TNM 分期等基线资料比较,差异均无统计学意义(P﹥0.05)(表1),具有可比性。本研究经过医院医学伦理委员会审核通过,患者及家属均对本研究知情同意并自愿签署知情同意书。
1.2 治疗方法
两组患者经放疗后均出现RILF。对照组给予激素、抗感染等常规治疗:常规给予化痰、平喘等治疗,泼尼松片0.5 mg/(kg·d)口服,巩固治疗4 周后开始减量,改为0.25 mg/(kg·d)口服,共4 周;以后维持减量至0.125 mg/(kg·d)口服;给予抗感染治疗,根据药敏实验结果给予敏感抗生素治疗。观察组在对照组的基础上给予痰热清注射液20 ml+0.9%氯化钠注射液500 ml 静脉滴注,每天1 次,均以21 天为1 个疗程,共治疗2 个疗程。
1.3 疗效评价标准
参照《疾病临床诊断和疗效判断标准》[6]并结合临床症状、胸部X 线片评估临床疗效。临床治愈:临床症状消失,胸部X 线片显示片状阴影或毛玻璃影消失,且稳定1 个月以上;有效:临床症状明显改善,胸部X 线片显示片状阴影或毛玻璃影部分消失,或仅有少许纤维条索影;无效:临床症状、胸部X 线片检查结果显示无明显改善。总有效率=(临床治愈+有效)例数/总例数×100%。
1.4 观察指标
①治疗结束后,观察并比较两组患者的临床疗效;②采用Vmax 229 型肺功能仪(美国森迪斯公司)评估患者治疗前后的肺功能,记录第1 秒用力呼气容积与用力肺活量的比值(forced expiratory volume in one second to forced vital capacity,FEV1/FVC)、肺一氧化碳弥散量(diffusion capacity of car-bon monoxide of lung,DLCO);③治疗前后均行空腹静脉采血,肝素抗凝,检测抗氧化因子水平,即分别采用硫代巴比妥酸(thiobarbituric acid,TBA)比色法检测血清脂质过氧化物(lipid peroxidation,LPO)水平,采用二硫代双硝基苯甲酸(dithio-bisnitrobenzoic acid,DTNB)直接测量法检测谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平,试剂盒分别购自上海沪震实业有限公司、泉州市睿信生物科技有公司;检测炎症因子[转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、白细胞介素(interleukin,IL)-6、IL-10]水平、血内皮素1(endothelin-1,ET-1)水平和基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)水平,均采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测,试剂盒均购自上海酶联生物科技有限公司。

表1 两组患者的基线特征
1.5 统计学方法
采用SPSS 20.0 软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t 检验。以P﹤0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床疗效的比较
观察组中,临床治愈5 例,有效20 例,无效8例;观察组中,临床治愈2 例,有效15 例,无效16例。观察组患者的治疗有效率为75.76%(25/33),高于对照组患者的51.52%(17/33),差异有统计学意义(χ2=4.190,P﹤0.05)。
2.2 两组患者肺功能指标的比较
治疗前,两组患者的FEV1/FVC、DLCO 水平比较,差异均无统计学意义(P﹥0.05);治疗后,两组患者的FEV1/FVC、DLCO 水平均较本组治疗前升高,差异均有统计学意义(P﹤0.05)。治疗后,观察组患者的FEV1/FVC、DLCO 水平均明显高于对照组,差 异 均 有 统 计 学 意 义(t=5.358、6.467,P ﹤0.01)。(表2)
表2 两组患者治疗前后肺功能指标的比较(±s)
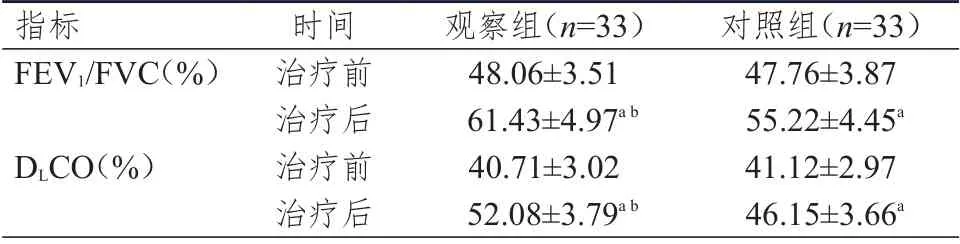
表2 两组患者治疗前后肺功能指标的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.01
指标FEV1/FVC(%)DLCO(%)时间治疗前治疗后治疗前治疗后观察组(n=33)48.06±3.51 61.43±4.97a b 40.71±3.02 52.08±3.79a b对照组(n=33)47.76±3.87 55.22±4.45a 41.12±2.97 46.15±3.66a
2.3 两组患者LPO、GSH-Px 水平的比较
治疗前,两组患者的LPO、GSH-Px 水平比较,差异均无统计学意义(P﹥0.05);治疗后,两组患者的LPO 水平均较本组治疗前下降,GSH-Px 水平均较本组治疗前升高,差异均有统计学意义(P﹤0.05)。治疗后,观察组患者的LPO 水平低于对照组,GSH-Px 水平高于对照组,差异均有统计学意义(t=2.375、8.001,P﹤0.05)。(表3)
表3 两组患者治疗前后LPO、GSH-Px 水平的比较(±s)

表3 两组患者治疗前后LPO、GSH-Px 水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.01
指标LPO(μmol/L)GSH-Px(U/ml)时间治疗前治疗后治疗前治疗后观察组(n=33)6.75±1.44 4.58±1.20a b 22.06±3.64 38.05±4.02a b对照组(n=33)6.69±1.53 5.33±1.36a 23.15±3.79 30.21±3.94a
2.4 两组患者炎性因子水平的比较
治疗前,两组患者的TGF-β1、IL-6、IL-10 水平比较,差异均无统计学意义(P﹥0.05);治疗后,两组患者的TGF-β1、IL-6 水平均低于本组治疗前,IL-10 水平均高于本组治疗前,差异均有统计学意义(P﹤0.05)。。治疗后,观察组患者的TGF-β1、IL-6 水平均明显低于对照组,IL-10 水平明显高于对照组,差异均有统计学意义(t=4.309、9.577、4.938,P﹤0.01)。(表4)
表4 两组患者治疗前后炎性因子水平的比较(±s)
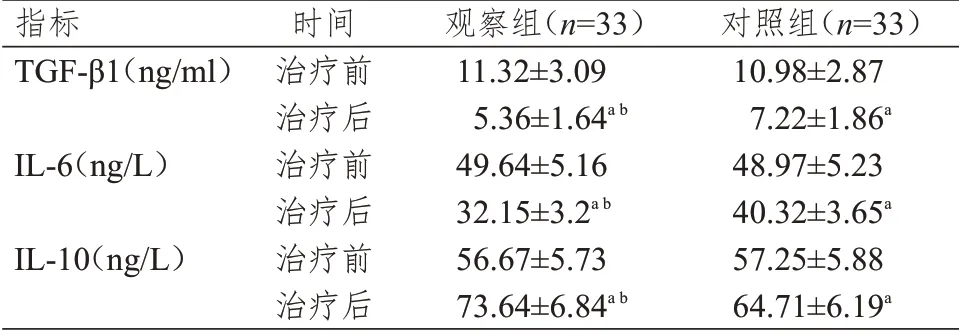
表4 两组患者治疗前后炎性因子水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.01
指标TGF-β1(ng/ml)IL-6(ng/L)IL-10(ng/L)时间治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=33)11.32±3.09 5.36±1.64a b 49.64±5.16 32.15±3.2a b 56.67±5.73 73.64±6.84a b对照组(n=33)10.98±2.87 7.22±1.86a 48.97±5.23 40.32±3.65a 57.25±5.88 64.71±6.19a
2.5 两组患者治疗前后ET-1、MMP9 水平的比较
治疗前,两组患者的ET-1、MMP9 水平比较,差异均无统计学意义(P﹥0.05);治疗后,两组患者的ET-1 水平均低于本组治疗前,MMP9 水平均高于本组治疗前,差异均有统计学意义(P﹤0.05)。治疗后,观察组患者的ET-1 水平明显低于对照组,MMP9 水平明显高于对照组,差异均有统计学意义(t=12.892、8.671,P﹤0.01)。(表5)
表5 两组患者治疗前后ET-1、MMP9 水平的比较(±s)
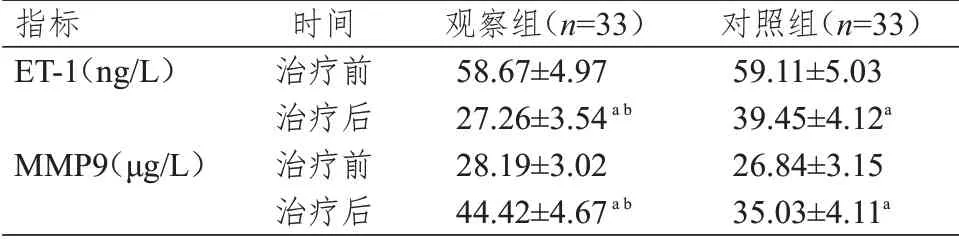
表5 两组患者治疗前后ET-1、MMP9 水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.01
指标ET-1(ng/L)MMP9(μg/L)时间治疗前治疗后治疗前治疗后观察组(n=33)58.67±4.97 27.26±3.54a b 28.19±3.02 44.42±4.67a b对照组(n=33)59.11±5.03 39.45±4.12a 26.84±3.15 35.03±4.11a
3 讨论
放疗是临床治疗不能耐受手术、晚期肺癌患者的有效手段,一旦放疗总剂量、剂量率超过肺组织生物效应阈值,往往会导致放射性肺损伤的发生。有研究显示,15%~20%的肺癌患者于接受放疗的过程中发生RILF[7]。RILF 是导致肺癌患者死亡的重要原因。目前,临床尚无RILF 的特效疗法,多以激素治疗为主,但长期用药产生的不良反应较多。
祖国医学中认为RILF 属于“热毒”的范畴,放射所致热毒蕴结于肺脏,肺失宣降,毒热灼阴,津枯肺燥,肺失濡养。本病主要由热毒之邪所致,以清热解毒为主要治法。痰热清注射液主要由黄芩、熊胆粉、山羊角、金银花、连翘等构成,其中,黄芩清热燥湿、泻火解毒,熊胆粉清热平肝,山羊角镇静、解热,金银花、连翘清热解毒;现代药理研究结果表明,痰热清注射液具有抗病毒、抗炎、镇咳、抗氧化、调节免疫功能等作用[8]。本研究中,观察组治疗有效率高于对照组,肺功能改善情况优于对照组(P﹤0.05),说明痰热清注射液可提高肺癌放疗后伴随RILF 患者的临床疗效。
有研究指出,氧化应激是放射性肺损伤的始动因素,且贯穿于放射性肺损伤的始终[9]。放疗期间,细胞内的一氧化氮合酶被激活,产生大量的一氧化氮,促使氮物质生成,这也是射线致氧自由基损伤的重要原因;随着放射剂量和放射频率的增加,肺组织活性氧及自由基持续生成,可能造成细胞的结构及功能受到损伤,导致肺部发生病理性改变;放射过程中产生的氧自由基可通过激活机体产生炎性反应,而炎性因子的增多使机体的内源性活性氧物质增加,形成恶性循环,进一步加重肺损伤[10]。LPO、GSH-Px 是反映机体抗氧化能力的重要指标,本研究中,观察组患者治疗后的LPO水平低于对照组,GSH-Px 水平高于对照组(P﹤0.05),说明痰热清注射液可调节肺癌放疗后伴随RILF 患者机体的氧化/抗氧化失衡,分析原因可能与痰热清注射液中黄芩、熊胆粉等具有抗氧化的作用有关。
目前,RILF 的发生机制尚未完全明确,已有的报道显示,炎性反应在RILF 的发生、发展过程中起重要的参与作用[11]。TGF-β1 是公认的纤维化形成与发展的重要细胞因子,与肺纤维化的严重程度密切相关,其可通过活化巨噬细胞诱导多种炎性因子释放、促使细胞外基质沉积、抑制基质降解等途径参与RILF 的形成[12]。安方玉等[13]开展的动物研究发现,肺纤维化大鼠组织中TGF-β1 的表达水平明显上升。IL-6 是由B 细胞、巨噬细胞、T 细胞等分泌的致炎因子,高水平的IL-6 可能参与促进肺纤维化的过程。IL-10 是经典的抗炎细胞因子,可通过抑制炎性反应和炎症细胞在肺组织中的浸润程度,从而达到减轻肺损伤的目的[14]。本研究中,观察组患者治疗后的TGF-β1、IL-6 水平均明显低于对照组,IL-10 水平明显高于对照组(P﹤0.01),说明痰热清注射液可抑制炎性细胞的浸润,降低炎性因子水平;另外,机体氧化应激反应减轻也是机体炎性因子水平降低的重要原因。
ET-1 主要在上皮细胞、成纤维细胞、内皮细胞等细胞中分泌,可通过介导上皮-间充质转化诱导间质细胞活化、增殖,调节肺内炎性反应,在肺纤维化的发生、发展过程中起到参与作用。既往研究指出,细胞外基质合成与降解平衡失调是肺纤维化发生的重要机制之一[15]。MMP9 是基质金属蛋白酶(matrix metalloproteinase,MMP)家族中分子量最大的酶,可破坏细胞外基质中的Ⅲ、Ⅳ型胶原,损伤肺基底膜及结构支架,导致RILF 发生。本研究中,观察组患者治疗后的ET-1 水平明显低于对照组,MMP9 水平明显高于对照组(P﹤0.01),提示痰热清注射液可降低内毒素水平,减少炎性细胞浸润,不仅可改善血管内皮的功能,还可减少对纤维细胞的刺激,从而达到抗纤维化的目的。
综上所述,痰热清注射液联合抗感染治疗可提高肺癌放疗后伴随RILF 患者的临床疗效,改善肺功能,其机制可能与痰热清注射液具有提高机体的抗氧化能力、减轻炎性反应及调节ET-1、MMP9水平的作用有关。
