免疫检查点抑制剂在小细胞肺癌中的应用分析
2020-10-17王静郝学志邢镨元王琦李峻岭
王静,郝学志,邢镨元,王琦,李峻岭#
1北京市朝阳区三环肿瘤医院内科,北京100122
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科,北京1000210
小细胞肺癌发病率约占所有肺癌类型的14%[1],恶性程度高、预后差,放化疗是其主要的治疗手段,局限期小细胞肺癌的同步放化疗有效率为70%~90%,广泛期含铂方案联合化疗有效率为60%~70%,虽然近期缓解率较高,但多数患者很快出现复发进展,局限期小细胞癌患者中位总生存期(overall survival,OS)为14~20 个月,2 年生存率约为40%,广泛期患者的中位总生存期为9~11 个月,2 年生存率不足5%[2]。
近年来,免疫检查点抑制剂在实体肿瘤尤其非小细胞肺癌的治疗中取得了令人惊喜的成绩,长期生存获益明显优于化疗。Impower133 研究[3]采用阿替利珠单抗+依托泊苷+卡铂(EC 方案)治疗广泛期小细胞肺癌,OS 较标准化疗方案延长2 个月(12.3 个月vs 10.3 个月,HR=0.7,P=0.0069),1 年生存率分别为51.7%和38.2%,目前,中国国家药品监督管理局已批准阿替利珠单抗上市,联合化疗用于广泛期小细胞肺癌的一线治疗。Keynote028研究[4]和Keynote158 研究[5]将帕博利珠单抗作为小细胞肺癌的二线及以上治疗方案,其中位缓解持续时间超过18 个月,基于上述研究,美国食品药品管理局(FDA)已批准帕博利珠单抗用于小细胞肺癌的三线治疗。目前,关于免疫检查点抑制剂在中国小细胞肺癌患者的真实世界数据较少。本研究回顾性分析小细胞肺癌患者接受免疫检查点抑制剂治疗的临床资料,以评估免疫治疗在临床实际应用中的疗效和耐受性,现报道如下。
1 资料与方法
1.1 一般资料
选取2017 年3 月至2019 年12 月北京市朝阳区三环肿瘤医院收治的接受免疫检查点抑制剂治疗的小细胞肺癌患者。纳入标准:均经病理学诊断为小细胞肺癌,有明确可测量病灶;治疗过程中接受过免疫检查点抑制剂[包括程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)抑制剂或程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)抑制剂]治疗。排除标准:无明确病理诊断依据,无可测量病灶;未明确记录使用免疫检查点抑制剂类型、用量、用药时间和不良反应;未明确记录既往治疗经过,随访资料不完整。依据纳入和排除标准,本研究共纳入9 例接受免疫检查点抑制剂治疗的小细胞肺癌患者。
1.2 治疗方法
所有患者均接受免疫检查点抑制剂治疗(无论免疫检查点抑制剂的类型,帕博利珠单抗和信迪利单抗均采用200 mg,3 周1 次;纳武单抗采用3 mg/kg,2 周1 次,直至疾病进展或出现不可耐受的不良反应),无论单药还是联合其他治疗模式,联合方案均包括化疗、抗血管生成药物或另一种免疫检查点抑制剂。采用问诊和电话随访的方式对所有患者进行随访,随访截止至2019 年12 月31日,每月1 次,无失访。
1.3 观察指标和评估标准
①收集9 例小细胞肺癌患者的临床资料,包括性别、年龄、临床分期、PD-1 抑制剂类型、治疗线数、联合治疗方案、吸烟史、胸部放疗史和临床疗效。②采用实体瘤疗效评价标准1.1 版(response evaluation criteria in solid tumors 1.1,RECIST 1.1)[6]评估小细胞肺癌患者的临床疗效,包括完全缓解(complete response,CR)、部 分 缓 解(partial response,PR)、疾病进展(progressive disease,PD)和病情稳定(stable disease,SD)。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。无进展生存期(progression free survival,PFS)指首次使用免疫检查点抑制剂开始至PD 或死亡的时间;缓解持续时间(duration of response,DOR)指肿瘤第一次评估为CR 或PR 至第一次被评估为PD 或任何原因死亡的时间。③采用美国国家癌症研究所常规毒性判定标准3.0(National Cancer Institute-common toxicity criteria 3.0,NCI-CTC 3.0)进行评估。
1.4 统计学方法
采用SPSS 17.0 软件对所有进行统计分析,计数资料以例数和率(%)表示;采用Kaplan-Meier 绘制生存曲线。
2 结果
2.1 临床特征
9 例小细胞肺癌患者中,男7 例(均有吸烟史),女2 例(均不吸烟);年龄45~72 岁,中位年龄58.3岁;临床分期:局限期病变局部复发2 例,初治局限期病变1 例,广泛期病变6 例;治疗方法:1 例初治的局限期患者一线接受PD-1 抑制剂联合EC 方案化疗,4 例患者接受二线PD-1 抑制剂治疗(其中3例联合化疗),4 例患者在三线及以上治疗后接受了PD-1 抑制剂治疗(其中1 例接受PD-1 联合另一种免疫检查点抑制剂——伊匹单抗)。(表1)
2.2 临床疗效
9 例小细胞肺癌患者的ORR 为22.2%(2/9),DCR 为55.5%(5/9),2 例获得PR 的患者中,1 例二线接受PD-1 抑制剂联合化疗治疗,1 例接受六线PD-1 抑制剂联合伊匹单抗治疗;3 例获得SD 患者的均接受了PD-1 抑制剂联合化疗。4 例单纯接受免疫检查点抑制剂治疗的患者中,1 例患者获得PR,其余3 例均PD。9 例小细胞肺癌患者的PFS 为4.0 个月(95%CI:0~11.1 个月),在4 例二线及以上接受PD-1 抑制剂治疗的患者中PFS 为1.58 个月(95%CI:0~5.2 个月)(图1、图2)。1 例二线使用PD-1 抑制剂联合贝伐珠单抗及伊立体康治疗的患者的DOR 达到了4.0 个月,接受PD-1 抑制剂联合伊匹单抗治疗的患者持续缓解时间超过2 年。
2.3 不良反应
9 例非小细胞肺癌患者中,不良反应发生率为66.7%(6/9),其中2 级免疫性肺炎2 例(22.2%),均在激素治疗过程中继发复杂细菌感染,停止免疫治疗;肝功能损害2 例(22.2%),其中1 例为3 级肝功能损害,继发肝衰竭死亡,另1 例为1 级肝功能损害,未影响后续治疗;2 级皮疹1 例(11.1%);2 级骨髓抑制2 例(22.2%)。
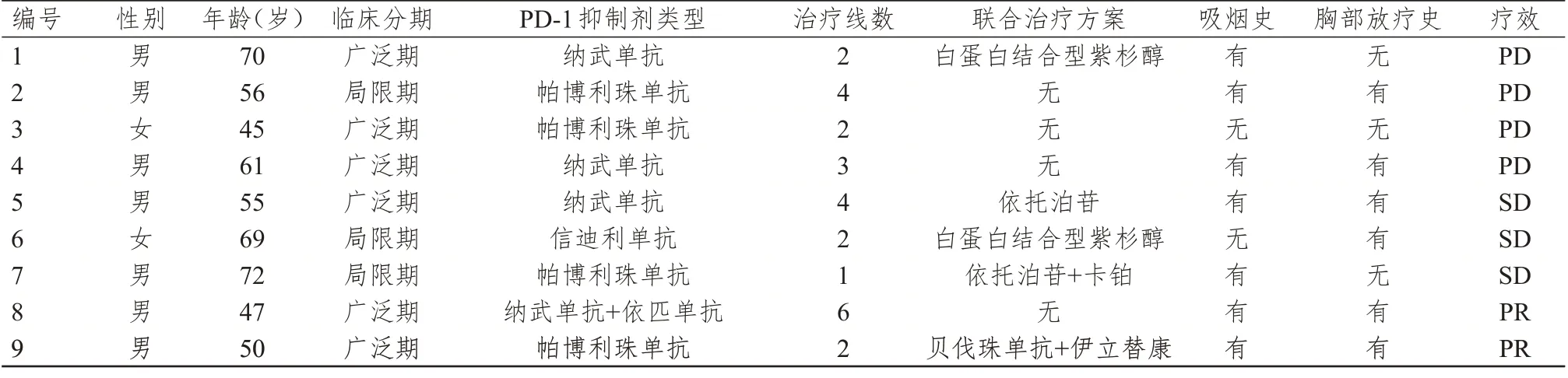
表1 9 例小细胞肺癌患者的临床特征
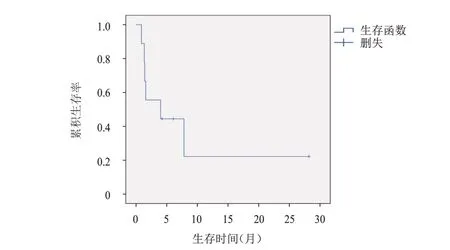
图1 9例非小细胞肺癌患者的PFS曲线
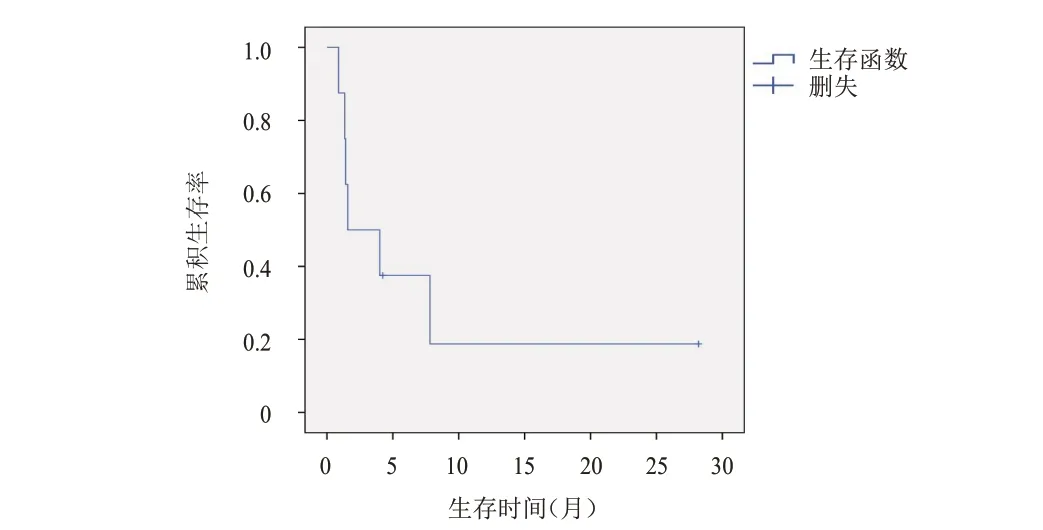
图2 8例二线及以上接受免疫检查点抑制剂治疗的非小细胞肺癌患者的PFS曲线
3 讨论
本研究中,免疫检查点抑制剂联合或不联合化疗的有效率为22.2%(2/22),其中1 例为三线以上治疗的患者,1 例为二线治疗联合化疗。所有DCR的患者中,4 例联合了化疗,仅1 例为单纯免疫检查点抑制剂治疗,且为两种免疫检查点抑制剂的联合。4 例疾病进展的患者中,3 例为单纯免疫检查点抑制剂治疗,1 例联合化疗,且均为二线及以上的治疗。由此可见,免疫检查点抑制剂与化疗联合,似乎获益更为明显,这与免疫检查点抑制剂治疗非小细胞肺癌的数据一致,Checkmate 026 研究[7]中,PD-L1 表达阳性的晚期非小细胞肺癌患者接受一线纳武单抗单药治疗,与化疗比较,此类患者无明显的生存获益(ORR:26% vs 33%;PFS:4.2 个月vs 5.9 个月,P﹥0.05)。但Keynote407 研究[8]采用帕博利珠单抗联合紫杉醇或白蛋白结合型紫杉醇一线治疗晚期肺鳞状细胞癌的有效率分别为57.9%和38.4%;Keynote189[9]研究结果显示,帕博利珠单抗联合培美曲塞+铂类一线治疗非鳞非小细胞肺癌的有效率亦明显优于单纯化疗(48.3% vs 19.9%,P﹤0.01)。免疫检查点抑制剂与化疗联合的理论基础包括以下三个方面:①化疗可促进肿瘤细胞死亡,促进肿瘤抗原释放,促进抗原提呈细胞提呈新抗原给T细胞,激活抗肿瘤免疫[10-11];②化疗可杀伤肿瘤诱导产生的调节性T细胞和免疫抑制细胞,从而间接激活免疫;③此外,肿瘤本身可诱导机体发生免疫抑制,免疫抑制剂可能通过激活免疫增加化疗的作用[10]。
但临床上,仍然有相当一部分患者不能从免疫检查点抑制剂的治疗中获益,其中一个重要的原因就与肿瘤微环境复杂的调节机制有关。肿瘤微环境包括肿瘤间质细胞和免疫细胞、细胞外基质分子、血管和淋巴管,其中肿瘤血管是实体瘤发生发展的重要因素,血管异常可导致肿瘤乏氧状态从而上调PD-1 的表达和免疫抑制细胞的浸润[12]。贝伐珠单抗作为抗血管生成药物的典型代表,一方面可阻断肿瘤新生血管生成,另一方面还可使肿瘤血管正常化,促进免疫效应细胞进入肿瘤组织,下调免疫抑制细胞的表达,将肿瘤微环境的抑制状态转变为激活状态[11],为联合免疫治疗提供理论基础。Impower150[13]研究也验证了免疫治疗联合抗血管生成药物治疗可获益。但两项Ⅲ期研究[14-15]的数据显示,化疗联合贝伐单抗治疗小细胞肺癌并未取得生存获益。Impower150 研究[13]中,免疫检查点抑制剂+抗血管生成药+化疗的三药联合的模式能否在小细胞肺癌的治疗获得同样的结论有待进一步的研究探索,贝伐珠单抗能否提高小细胞肺癌免疫治疗的疗效需要进一步的数据支持,多靶点的小分子抗血管药物安罗替尼也值得进一步探索。
研究显示,PD-L1 的表达与免疫检查点抑制剂的疗效密切相关[16-17]。Keynote028 研究[4]中,帕博利珠单抗二线以上治疗PD-L1 表达阳性的广泛期小细胞肺癌的治疗有效率达33.3%,而在Checkmate032 研究[18]中,纳武单抗三线及以上治疗小细胞肺癌的治疗有效率为11.9%,纳武单抗单药治疗的患者中PD-L1 表达≥1%和﹤1%的两组人群并未观察到疗效的差异。既往的研究也发现小细胞肺癌PD-L1 的表达水平较低[19]。
目前,肿瘤突变负荷(tumor mutation burden,TMB)也成为了预测免疫检查点抑制剂临床疗效的标志物[20-21],小细胞肺癌被认为是具有最高突变负荷的肿瘤。Checkmate032 研究[18]的单独分析显示,TMB 高的患者(全外显子测序有248 突变)的ORR 为21.3%,而TMB 低的患者为4.8%(0﹤143 个突变)。然而在Impower133 研究[3]中阿替利珠单抗联合化疗用于一线广泛期小细胞肺癌的治疗,并未观察到TMB 与疗效的明确关系,无论TMB 界值是10/MRb 或16/MRb。由此推论,尽管TMB 水平较高,但由于小细胞肺癌组织免疫细胞浸润少,PD-L1 的表达水平偏低4,18-19],从而影响了免疫治疗的疗效,且由于检测方法的不同,使TMB 的界值无法统一,也影响了其作为疗效预测的价值。此外,有研究认为,与非小细胞肺癌相比,小细胞肺癌中主要组织相容性复合体(major histocompatibility complex,MHC)分子的下调及不同的自分泌和旁分泌调节,可能会导致机体对免疫疗法的响应降低[22]。鉴于小细胞肺癌病理生理机制的复杂性,单一的生物标志物难以达到预测其疗效的目的,需要从分子病理层面进一步探索可能的疗效预测因素。
本研究结果显示,9 例小细胞肺癌患者中,1 例患者的死亡与不良反应相关,2 例因不良反应(肺炎)停药。2 例免疫性肺炎的患者既往均进行过胸部放疗,曾经出现过放射性肺炎。但由于本研究纳入的病例数较少,不能完全反映不良反应的实际发生情况,胸部放疗是否会增加免疫性肺炎的发生风险有待更多的数据证实。
尽管小细胞肺癌患者的初始治疗有效率较高,但容易复发转移,复发后的治疗较为困难,有效率低,患者生存期短。免疫检查点抑制剂为二线以上复发转移的小细胞肺癌的治疗提供一个新的治疗选择。
综上所述,免疫检查点抑制剂联合化疗在多线治疗中仍有效,而单纯使用免疫检查点抑制剂的疗效不佳,尚需进一步探索最佳的小细胞肺癌治疗模式,以改善肿瘤微环境,以期待免疫检查点抑制剂能获得更大的疗效。
