猕猴桃贮藏中常见病原菌的分离鉴定及抗菌中药的筛选
2020-10-17吕蕊花白崇旭方亚妮史琳娜吕瑞华张喜荣
吕蕊花,林 枞,白崇旭,方亚妮,冯 昭,史琳娜,吕瑞华,张喜荣
(陕西中医药大学 医学技术学院,陕西 咸阳 712046)
猕猴桃(Actinidiachinensis)为呼吸跃变型的多汁浆果,产后极易腐烂变软,为提高猕猴桃经济价值,延长销售时间,其保鲜冷藏技术一直被广泛关注。陕西省周至县享有“中国猕猴桃之乡”的美名,全县猕猴桃种植面积达2.77万hm2,年贮藏能力可达30万t。现普遍使用的冷藏库消毒技术多为在猕猴桃入库之前,用高锰酸钾和甲醛配比液对冷藏库空间进行全面熏蒸,这种背景下猕猴桃果实采摘预冷后直接进入冷藏库,不作任何消毒处理,在贮藏过程中极易发生霉烂。2002年,该县贮藏猕猴桃腐烂率在30%~40%,甚至高达60%,最低也在10%左右,且不同品种的霉烂率不尽相同。
在猕猴桃典型病害研究方面,引起猕猴桃褐斑病、软腐病、类似象皮病和果腐病的病原菌已被鉴定,分别为链格孢菌(Alternariaalternate)[1]、葡萄球座菌(Botryosphaeriadothidea)[2]、柔膜菌目真菌(Cadophoramelinii)[3]和拟茎点霉(Phomopsissp.)[4]。在猕猴桃采摘后病害鉴定方面,丁爱冬等[5]发现贮藏19周的猕猴桃腐烂率高达50%,从中分离得到7种病原菌,其中,灰葡萄孢菌(Botrytiscinerea)、青霉属(Penicilliumsp.)和拟茎点霉(Phomopsissp.)3种病原菌为优势菌。除此之外,葡萄球座菌(Botryosphaeriadothidea)、拟隐壳孢属(Cryptosporiopsissp.)、间座壳属(Diaporthespp.)、念珠菌(Cylindrocarponcf.candidum)和多变茎点菌(Phomaexigua)5种真菌均被证实可以侵染猕猴桃,且极易从猕猴桃受损部位侵入[6]。在猕猴桃病害防治方面,王小洁等[2]从海沃德软腐病病果中分离出了10种致病菌,经鉴定均为葡萄球座菌,药剂筛选试验结果表明,多菌灵对病原菌菌丝生长的抑制效果最好,抑制率高达91.97%。由此可见,引起猕猴桃贮藏期病害的病原菌种类繁多,但使用农药对真菌菌丝或孢子进行防控仅限于研究层面,不能在生产上进行有效应用。因此,进一步明确病原菌种类,并探究中药对猕猴桃贮藏期病原菌的防治效果是当下降低猕猴桃贮藏过程中霉变率的有效途径。鉴于此,以陕西省周至县贮藏量较大、收益较高的猕猴桃品种为研究对象,研究在猕猴桃贮藏过程中引起果实霉烂的几种常见病原菌,并选取常用抗菌中药,通过菌丝生长抑制方法,分别对分离到的病原菌进行抑制效果测定,以期为猕猴桃贮藏、保鲜提供参考。
1 材料和方法
1.1 材料与试剂
供试病样及菌种:贮藏期病果于2018年11月—2019年1月从陕西省周至县猕猴桃冷藏库中获得,为贮藏1~4个月的成熟果实。病果具有该地区猕猴桃贮藏期间常见的发病症状,病果品种为该地区经济价值较高的品种:海沃德、徐香、华优。病原菌致病性测定所用上述品种健康猕猴桃亦由此地购得。
培养基:马铃薯葡萄糖琼脂(Potota dextrose agar, PDA)培养基:去皮马铃薯200 g、葡萄糖20 g、琼脂粉12 g、蒸馏水1 000 mL;马铃薯葡萄糖(Potota dextrose, PD)液体培养基:不添加琼脂粉的PDA培养基。
试剂及仪器:真菌基因组DNA提取试剂盒购自北京索来宝科技有限公司;PCR扩增、检测及产物克隆所用试剂盒均购自TAKARA公司;胶回收试剂盒、质粒提取试剂盒均购自OMEGA公司;琼脂糖、核酸Marker、预染EB均购自上海生物工程有限公司;光学显微镜购自日本Olympus公司;双压电泳仪和电泳槽购自北京君意公司。
中药材:选取的10种抗真菌常用单味药[7]的颗粒剂,均购于陕西中医药大学第一附属医院,生产厂家为四川新绿色药业科技发展有限公司。10种单味药均为浓缩颗粒剂,其1 g浓缩颗粒剂对应的原药材质量分别为大黄7 g、茵陈11 g、蛇床子21 g、薄荷11 g、苦楝皮12 g、盐小茴香21 g、连翘11 g、板蓝根11 g、马齿苋11 g、土茯苓11 g。
1.2 病原菌的分离与纯化
组织分离法[8]:切取病、健交界处的组织4~5 mm,用75%乙醇清洗1 min,再用无菌水冲洗3~4次,置于无菌滤纸上,用刀片从中间切开,切面贴向PDA平板进行培养。对于肉眼可见的霉菌菌丝,在超净工作台上直接用接种环挑取接种于PDA培养基上,置于20 ℃恒温培养箱中培养。然后挑取边缘菌丝再次分离,直至分离到单菌落。
将纯化的病原菌用打孔器打成直径为1 cm的圆饼,菌丝面朝上接种于PDA平板上,20 ℃培养,观察、记录菌丝生长情况,显微镜下观察菌丝形态及孢子产生情况。
1.3 病原菌的致病性测定
待接种健康猕猴桃果实消毒处理方式:用75%的乙醇喷洒猕猴桃果实表面,置于超净工作台中完全吹干。采用穿刺法接种:用无菌的牙签穿刺果皮,用1 cm的打孔器在培养5 d的PDA平板菌落边缘打孔,将菌丝面朝向果皮接种健康的猕猴桃。分离到的每种病原菌均接种3个待测猕猴桃品种,每个品种重复3次,每个品种每次接种5个果实。接种后置于20 ℃恒温培养箱中培养,观察并记录发病情况。待果实发病后,根据柯赫法则,再次从人工接种致发病的猕猴桃果实上分离病原菌进行培养,并与接种前所用病原菌进行对比。
1.4 病原菌形态学和分子生物学鉴定
病原菌形态学鉴定:将分离得到的致病菌株接种到PDA平板上,20 ℃恒温黑暗培养7 d,观察记录菌落生长情况,并在光学显微镜下观察其菌丝及产孢情况。
病原菌分子生物学鉴定:根据真菌基因组DNA提取试剂盒说明书提取分离病原菌基因组DNA,并以此为模板,应用ITS序列通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。扩增产物经1%琼脂糖凝胶电泳检测并纯化后,送至北京擎科生物科技有限公司西安分公司进行测序。所得序列在NCBI数据库中进行BLAST比对,下载不同地域来源的同源性较高的序列,用MEGA 4.0软件以邻近法构建系统发生树,分析其亲缘关系。
1.5 常用抗真菌中药室内抑菌效果测定
采用含药平板进行筛选,将10种抗真菌常用中药颗粒剂根据质量及浓缩倍数,加去离子水溶解,配成质量浓度为2.5 g/mL的溶液。将配好的颗粒剂溶液及PDA培养基分别灭菌。待培养基温度降至50~60 ℃时,分别用移液枪吸取不同体积的颗粒剂溶液加入到PDA培养基中,最终配制成含不同单味中药质量浓度为0.3 g/mL PDA培养基。待培养基完全冷却,用直径为1 cm的打孔器在菌落边缘打取大小相同的菌丝块,接种于含不同单味中药的培养基上,置于20 ℃恒温培养箱中培养。每个中药重复3 次,每次3个平板,以加入无菌水的PDA培养基作为对照(CK)。每隔24 h观察记录1次,采用十字交叉法测量菌落生长直径,计算各单味中药的抑制率。菌丝生长抑制率=(对照菌落生长直径-含中药培养基菌落生长直径)/对照菌落生长直径×100%。
1.6 数据分析
采用Excel 2010进行数据处理,并利用SPSS 22.0软件进行统计分析,应用Student-Newman-Keuls多重比较法进行显著性差异检验。
2 结果与分析
2.1 病原菌的形态学特征
经柯赫法则验证,从3个品种的猕猴桃病果中共分离得到5种菌株,依次编号为QD1、QD4、QD5、QD7和QD10,形态学鉴定初步将其归为以下4个属:QD1为根毛霉属[Mucor(Rhizomucor)]、QD4和QD7为链格孢属(Alternaria)、QD5为葡萄座腔菌属(Botryosphaeria)、QD10为间座壳属(Diaporthe)。
2.1.1 根毛霉属 根毛霉属(QD1)病原菌刚接种到PDA培养基上生长时,菌丝白色。20 ℃ 培养7 d后,菌丝上面长出大量小孢子。之后菌丝颜色逐渐加深为乳黄色,孢子卵圆形,大小为(1.7~2.3)μm×(2.5~2.9)μm。该病原菌极易侵染华优猕猴桃,接种10 d肉眼可见明显的发病症状:猕猴桃接种的地方有少量菌丝,从果皮上看无异常,但被侵染的猕猴桃果实部位表面变软。揭开果皮后,可见果实呈黄色腐烂状,果蒂也变黄并腐烂(图1)。

图1 根毛霉属(QD1)的形态特征及侵染猕猴桃的发病症状
2.1.2 链格孢属 链格孢属(QD4)在PDA培养基上为青灰色,菌丝为有隔菌丝,菌丝在生长过程中不产生孢子。发病的猕猴桃表面明显有灰白色菌丝,肉眼可见有黏性液体渗出果皮,果实有乙醇味,发病部位果肉内部结成一块,明显呈黄色(图2)。
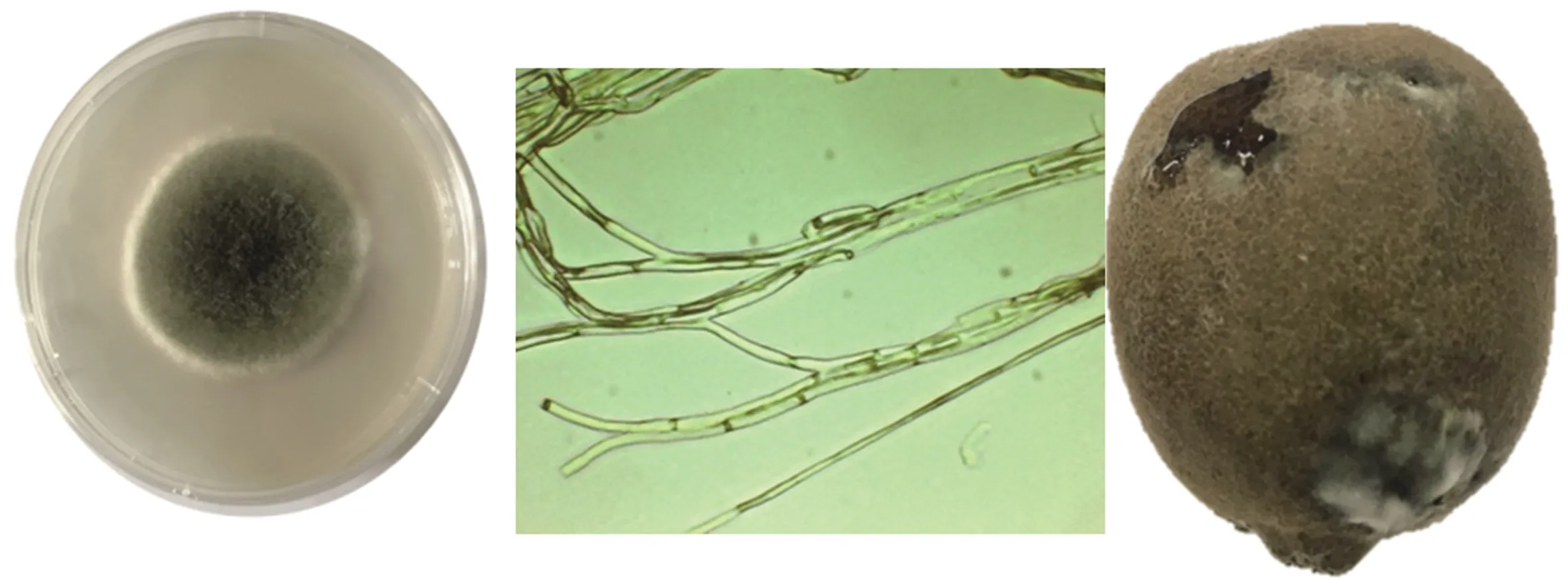
图2 链格孢属(QD4)的形态特征及侵染猕猴桃的发病症状
同样为链格孢属的QD7真菌在PDA培养基上生长菌丝为深灰色,20 ℃条件下生长7 d长满9 cm的平板。菌丝有隔,20 ℃生长5 d后菌丝上产生大量孢子。孢子呈梨形,大小为(2.3~3.6)μm×(4.7.5~8.9)μm。被侵染的猕猴桃表面有大量黑色菌丝,果肉内部变黄,腐烂变质(图3)。

图3 链格孢属(QD7)的形态特征及侵染猕猴桃的发病症状
2.1.3 葡萄座腔菌属 葡萄座腔菌属(QD5)病原菌在PDA培养基上生长1~5 d的菌丝为白色,从第5天开始,菌丝颜色逐渐加深,最终显示为灰绿色。显微镜观察,菌丝形态呈碎片状,不产生孢子。病原菌侵染猕猴桃的症状表现为被侵染处皱缩凹陷,果肉腐烂发黄(图4)。

图4 葡萄座腔菌属(QD5)的形态特征及侵染猕猴桃的发病症状
2.1.4 间座壳属 间座壳属(QD10)病原菌在PDA培养基上生长较缓慢,20 ℃条件下培养15~18 d长满整个平板。菌丝白色,紧贴培养基生长,不易与培养基分离,在培养基上呈同心圆分布。显微镜下菌丝较短小,不产生孢子。被病原菌侵染的猕猴桃表面无异样,但受感染部位明显变软,果肉发黄变质(图5)。
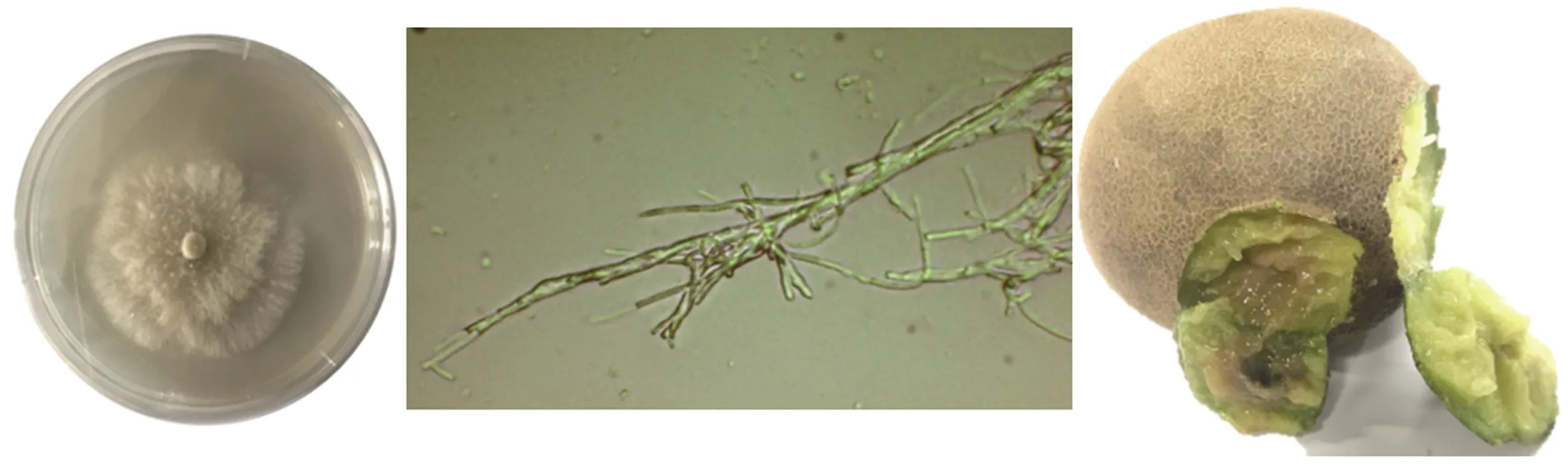
图5 间座壳属(QD10)的形态特征及侵染猕猴桃的发病症状
2.2 病原菌的分子生物学鉴定
以邻近法构建的系统发生树见图6。结合该5株病原菌形态学特征,将QD1病原菌鉴定为多变根毛霉菌[Mucorirregularis(Rhizomucorvariabilis)],QD4病原菌鉴定为黑斑病菌(Alternariabrassicae),QD5病原菌鉴定为葡萄球座菌(Botryosphaeriadothidea),QD7病原菌鉴定为链格孢菌(Alternariaalternate),QD10病原菌鉴定为间座壳菌(Diaportheeres)。
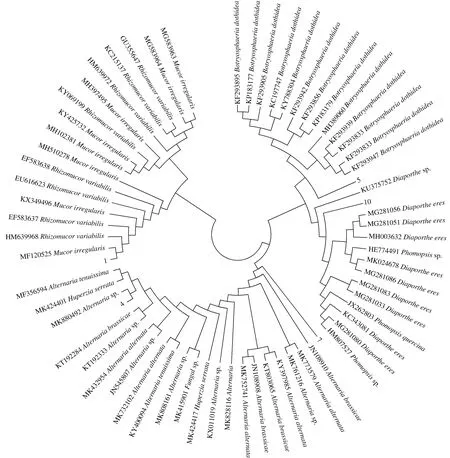
图6 基于ITS序列采用邻近法构建菌株QD1、QD4、QD5、QD7、QD10系统发生树
2.3 常用抗真菌中药室内抑菌效果
通过含中药的培养基培养不同菌株,5~10 d测得的抑菌效果(表1)显示,0.3 g/mL培养基的蛇床子、苦楝皮和连翘对几种猕猴桃病原菌的抑菌效果较好,这3种中药对QD7和QD10病原菌菌丝生长的抑制率均在90%及以上。除此之外,对QD1、QD4和QD5病原菌菌丝生长的抑制率也均在70%以上。相反地,总体来说茵陈、板蓝根、薄荷和土茯苓对这5种病原菌菌丝生长速率抑菌效果较差。
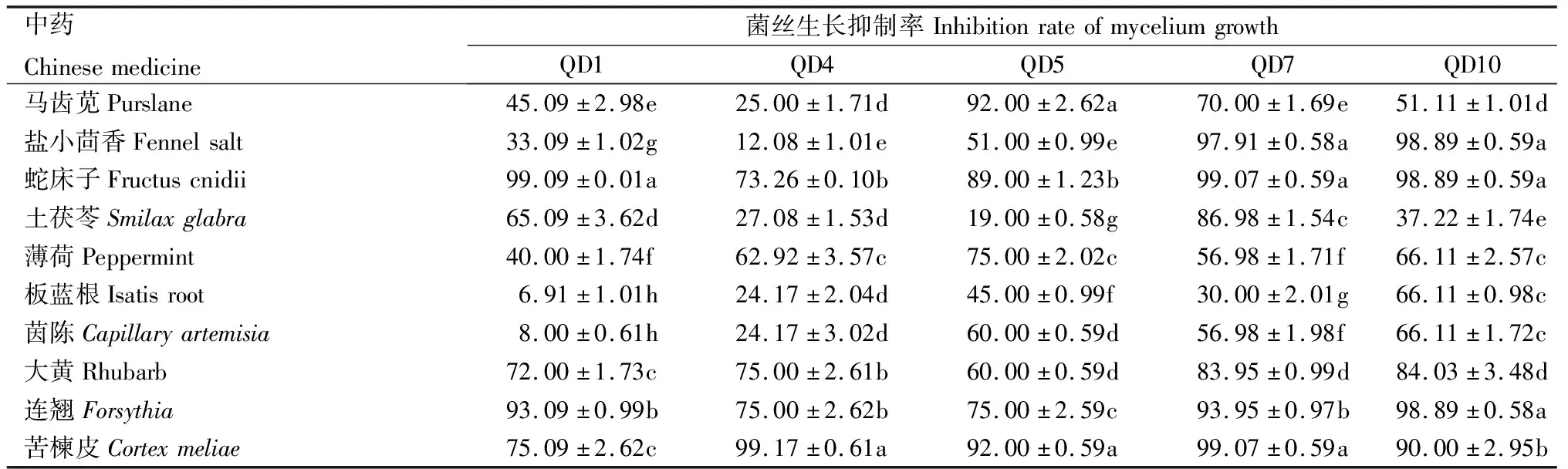
表1 不同中药对猕猴桃贮藏期常见病原菌菌丝的抑制率
3 结论与讨论
现阶段,从猕猴桃病果中分离出来的病原菌均为真菌性病害且种类繁多,段爱莉等[9]从贮藏期霉烂猕猴桃华优、海沃德和秦美果实中分离出的主要病原菌为青霉属(Penicilliumsp.),占总菌株的63.3%。本研究并未分离出青霉属真菌,这可能与贮藏进冷藏库时猕猴桃表面所携带的病原菌相关。与本研究分离出的QD10病原菌发病症状相同,Phomopsisactinidiae(Henn.)引起猕猴桃采后腐烂[10]。病斑大多最初发生在成熟果实茎端,从茎端逐渐扩散,发病部位开始变得柔软,剥去表皮后,发病组织颜色比周围健康组织更浅,呈淡绿色[10]。病原菌从果蒂端侵入而引起猕猴桃果实发病的原因,有可能与猕猴桃果树里面的内生菌有关。因此,在猕猴桃的栽培种植中,提高果树的抗病能力,是延长果实贮藏期的根本。
在病原菌的分离过程中发现,不同猕猴桃品种感染不同病原菌的发病率也有差别,总体来说,海沃德品种猕猴桃抗病原菌侵染的能力最强。徐香品种猕猴桃更容易被多变根毛霉菌[Mucorirregularis(Rhizomucorvariabilis)]和葡萄球座菌(Botryosphaeriadothidea)侵染,海沃德品种更易被链格孢菌(Alternariaalternata)侵染,华优品种则更容易被黑斑病菌(Alternariabrassicae)和间座壳菌(Diaportheeres)侵染,这可能与不同猕猴桃品种的含糖量有关。赵金梅等[1]从中华猕猴桃褐斑病发病果实中分离出链格孢菌,并发现海沃德比华优猕猴桃更易感病,这与本研究的结果刚好相反,这可能与猕猴桃栽培方式、采摘时间、贮藏条件有关系。YOUNG等[11]从采摘后的猕猴桃果腐病果中,也分离到了Botryosphaeria和Diaporthe,这与本研究分离到的QD5和QD10病原菌相同。
在猕猴桃采摘后病原菌防控方面的研究表明,猕猴桃经0.08 mol/L氯化钙[12]、500 GY电子束辐射[13]、5%的抗坏血酸[14]处理、肉桂酸精油熏蒸[15]、80%的富氢水[16]或香芹、茴香油体外处理[17]均可降低其贮藏期霉变率。另外,50%多菌灵可湿性粉剂1 000倍液对葡萄球座菌菌丝生长的抑制效果最好,抑制率高达91.97%[2],但这些方法仅限于研究层面,现阶段还没有具体应用。程小梅等[18]采用川穹等对贮藏期的猕猴桃进行病原菌防治,抑制率高达92.76%,但其仅针对青霉菌1种菌株作了相关研究。本研究从10种常见抗菌中药中筛选出了在猕猴桃贮藏过程中对常见病原菌防控效果较好的3种药剂(蛇床子、苦楝皮和连翘),这3种单味中药对大部分病原菌菌丝生长的抑制率可达70%以上。因此,采用中药防治猕猴桃贮藏过程中的病原菌,不仅符合现阶段人们对于高品质、无公害农产品的倡导和追求,且抑制效果较好,更易被果农接受,也更容易在猕猴桃的贮藏、保鲜中得到实际应用。后期将对筛选出的上述3种中药进行有效配伍,结合中药对猕猴桃果实细胞壁的软化作用,研究其抑制猕猴桃贮藏中常见病原菌的最佳配伍,以期对猕猴桃贮藏过程常见真菌进行切实有效的防控。
