猪伪狂犬病毒变异株HN1201 gB蛋白单克隆抗体的制备与鉴定
2020-10-17付朋飞杜永坤褚贝贝杨国宇
程 璇,付朋飞,杜永坤,褚贝贝,杨国宇,王 江
(河南农业大学/农业部动物生化与营养重点开放实验室,河南 郑州 450002)
伪狂犬病病毒(Pseudorabies virus,PRV)属于疱疹病毒科、α-疱疹病毒亚科、双链DNA病毒,基因组大小约150 kb,可引起猪和多种家畜发病,其中猪是该病原的主要宿主和传染源。PRV引起猪发病时主要表现为母猪繁殖障碍、发热,以及仔猪急性死亡等症状[1-4]。近年来,在我国很多地区暴发了猪伪狂犬病,给养猪业带来了巨大的经济损失。
PRV基因组编码70多个α-疱疹病毒同源性蛋白[5],有11种囊膜蛋白在病毒复制的各个阶段发挥作用,其中gB蛋白是PRV囊膜主要的保护性抗原糖蛋白,不仅能诱导动物机体产生中和抗体,而且对病毒的感染和复制过程是必需的[6-9]。gB蛋白由gBa(110~125 ku)、gBb(68~74 ku)、gBc(55~58 ku)3种糖蛋白以二硫键连接构成同源二聚体复合物,均来自gB基因编码的同一蛋白前体[10-13]。gBb和gBc由gBa水解而成,能诱导机体产生依赖补体和不依赖补体的2种中和抗体[1]。gB基因在疱疹病毒成员中为最保守的糖蛋白基因,gB蛋白免疫原性相对较好,且对于病毒的感染必不可少[14-15]。为此,制备 PRV gB蛋白单克隆抗体并研究其特异性,旨在为PRV鉴定与gB蛋白功能研究奠定基础。
1 材料和方法
1.1 主要材料及供试动物
PRV HN1201株、PRV QXX株、PRV Barth K61株、PK-15细胞、SP2/0骨髓瘤细胞、感受态细胞Top10、pCAGGS-HA质粒均由本实验室保存;聚偏二氟乙烯膜(PVDF)膜购自Millipore公司;HybGro杂交瘤细胞无血清培养基购自上海源培生物科技股份有限公司;β-丙内酯购自Solarbio公司;佐剂Quick Antibody-Mouse 5W购自北京博奥龙免疫技术有限公司;HAT/HT培养基、融合剂PEG1450、FITC标记山羊抗小鼠IgG(IgG-FITC)、商业化β-actin鼠源单克隆抗体等均购自Sigma公司;HRP标记山羊抗小鼠IgG购自北京鼎国昌盛生物技术有限责任公司;AEC酶底物试剂盒购自北京中杉金桥生物技术有限公司;蛋白质Marker购自Thermo Fisher公司;ProteinIso®Protein G Resin购自北京全式金生物技术有限公司;IgG抗体亚类鉴定试剂盒购自Sino Biological公司。
清洁级BALB/c小鼠购自郑州大学第一附属医院。
1.2 PRV HN1201株的增殖与纯化
铺PK-15细胞至T75瓶,待其生长至铺满瓶底,接种PRV HN1201病毒液(毒价107.5TCID50/0.1 mL)0.5 mL,24 h后约90%细胞病变,收毒并冻融3次,8 000 r/min离心10 min收集细胞上清,取10 mL上清经30%蔗糖层26 000 r/min离心2 h,弃上清,用0.5 mL无菌PBS重悬病毒沉淀,-80 ℃保存备用。
1.3 PRV HN1201株的灭活与小鼠免疫
取PRV HN1201株浓缩病毒液,加入β-丙内酯(终含量为0.2%)混匀后置4 ℃灭活48 h,佐剂Quick Antibody-Mouse 5W与浓缩病毒液按1∶1比例配制疫苗,腿部肌肉注射免疫7周龄BALB/c小鼠,免疫剂量为100 μL/只。21 d后加强免疫1次,免疫剂量及途径同首免;首免35 d后,采小鼠尾静脉血,Dot blot法检测血清抗体水平。Dot blot法:裁剪PVDF膜并标记,取3 μL浓缩病毒液,滴加于PVDF膜上并风干,5% BSA(1×TBST配制)室温封闭2 h。小鼠尾静脉采血,离心收集血清,用PBS将血清进行2倍系列稀释(2-1—2-11),稀释后血清滴加于病毒区,室温作用1 h,PBST洗膜后室温孵育HRP标记山羊抗小鼠IgG(1∶5 000)1 h,洗膜后显影观察。比较所有血清抗体水平,取抗体水平最高小鼠腹腔注射灭活病毒(100 μL/只)进行冲击免疫。
1.4 细胞融合
断颈处死冲击免疫3 d后的小鼠,无菌分离脾脏,常规方法制备小鼠脾脏细胞,按1∶10比例与SP2/0细胞混合,1 200 r/min离心10 min,弃上清;轻敲离心管使细胞混匀,置37 ℃水浴,滴加37 ℃预热的PEG-1450(1 mL/min,边加边混匀)1 mL,37 ℃作用90 s;3 min内加入14 mL 37 ℃预热DMEM,边加边摇,37 ℃静止5 min,缓慢补加DMEM至40 mL,1 000 r/min离心10 min,弃去上清,加适量预热HAT培养基,混匀后铺96孔板进行培养[16]。
1.5 单克隆抗体筛选
1.5.1 分泌PRV单克隆抗体的杂交瘤细胞筛选 IPMA试验筛选分泌PRV抗体杂交瘤细胞,铺PK-15细胞至96孔板,接种PRV HN1201(MOI=0.1),10 h后用预冷3% H2O2甲醇室温固定15 min;弃固定液,PBST洗2次,拍干,加5%脱脂奶37 ℃封闭1 h;弃封闭液,PBST洗5遍,拍干,加融合细胞分泌上清100 μL/孔,37 ℃孵育1 h;弃上清,PBST洗5遍,拍干,加1∶1 000稀释的HRP标记山羊抗小鼠IgG二抗,100 μL/孔,37 ℃孵育1 h;弃二抗,PBST洗5遍,拍干,加AEC显色液显色,显微镜观察并拍照,筛选出分泌PRV抗体的杂交瘤细胞株[11]。
1.5.2 分泌PRV gB蛋白单克隆抗体的杂交瘤细胞筛选及亚克隆 克隆PRV HN1201株gB基因并连接至pCAGGS-HA真核表达载体,获得表达PRV HN1201 gB蛋白的pCAGGS-HA-gB质粒,转染PK-15细胞,在1.5.1中筛选结果基础上,进一步用常规Western blot方法筛选分泌PRV gB蛋白抗体的单克隆细胞系。通过有限稀释法进行亚克隆纯化,筛选出分泌PRV gB蛋白抗体的阳性杂交瘤细胞,扩大培养并冻存。
1.6 腹水的制备及抗体纯化
取6~8 周龄BALB/c雌性小鼠腹腔注射0.3 mL弗氏不完全佐剂,7 d后腹腔接种长势良好的分泌PRV gB单克隆抗体的杂交瘤细胞,3×106个杂交瘤细胞/只,另设阴性对照组小鼠,腹腔注射SP2/0细胞(3×106个/只)。待小鼠腹部膨大且有波动感时采集腹水,10 000 r/min离心10 min 收集上清,用硫酸铵沉淀法和ProteinIso®Protein G Resin进行抗体纯化,加甘油(终含量50%)-20 ℃保存,并用SDS-PAGE凝胶电泳对纯化的抗体纯度进行鉴定。
1.7 单克隆抗体亚型鉴定
按照IgG亚类鉴定试剂盒说明书操作,对获得的单克隆抗体进行亚型鉴定。
1.8 单克隆抗体与不同PRV毒株反应特性的IFA鉴定
将不同PRV病毒株分别接种PK-15细胞,37 ℃、5% CO2条件下培养10 h,用预冷的含3% H2O2的甲醇进行固定,加入杂交瘤细胞上清,37 ℃作用1 h,洗涤后加入FITC标记山羊抗小鼠IgG(1∶1 000)二抗,37 ℃作用1 h,洗涤后于荧光共聚焦显微镜下观察拍照。同时设立SP2/0细胞培养上清和未接毒PK-15细胞作为阴性对照[17]。
1.9 抗体效价检测
取1.6步骤中纯化小鼠腹水所得抗体,并参照1.8中试验步骤对其进行IFA抗体效价检测。采用固定病毒-稀释腹水法(β法),对小鼠腹水抗体的PRV中和效价进行检测[18]。同时对杂交瘤细胞培养上清和腹水纯化抗体用于Western blot的最佳稀释比例进行探索。
2 结果与分析
2.1 灭活PRV HN1201株免疫小鼠血清抗体水平
小鼠首免后第35天,取尾静脉血分离血清,2倍梯度稀释后,Dot blot法检测血清PRV抗体水平,7只小鼠均分泌PRV抗体,其中3号小鼠抗体水平最高达到2-11,取3号小鼠用灭活PRV进行腹腔冲击免疫。
2.2 分泌PRV gB蛋白单克隆抗体杂交瘤细胞株的建立
将SP2/0细胞与小鼠脾脏细胞融合,经HAT培养基筛选后5~7 d即可明显观察到融合细胞增殖(图1),经IPMA和Western blot对多株融合细胞进行筛选,最终获得1株抗PRV gB蛋白单克隆抗体,并将其命名为3B-3。IPMA结果(图2)显示,制备的单克隆抗体可有效检测PRV HN1201株感染的PK-15细胞。PRV HN1201株感染PK-15细胞与pCAGGS-HA-gB质粒转染PK-15细胞的Western blot结果(图3)显示,单克隆抗体3B-3可特异检测PRV gB蛋白。
A:融合后5 d;B:融合后7 d
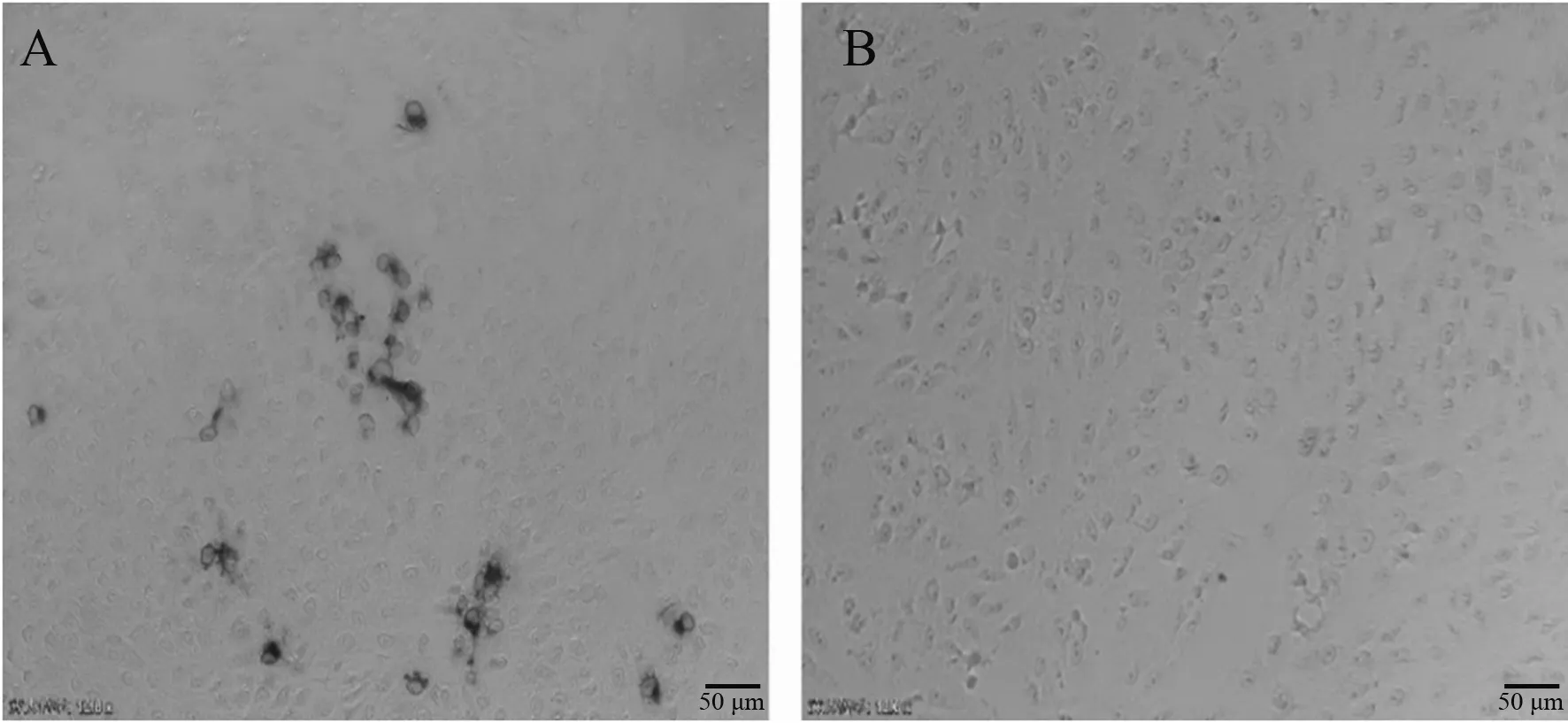
A:PRV HN1201株感染PK-15细胞;B:正常PK-15细胞
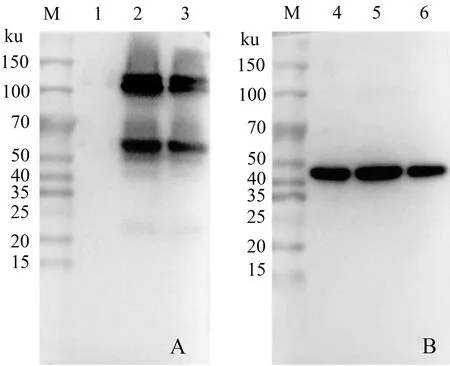
A:单克隆抗体3B-3的Western blot鉴定;B:β-actin Western blot鉴定。M:蛋白质Marker;1:PK-15细胞蛋白;2:感染PRV HN1201后PK-15细胞蛋白;3:转染pCAGGS-HA-gB质粒后PK-15细胞蛋白;4—6:β-actin
2.3 PRV gB蛋白单克隆抗体纯化效果及Ig亚型鉴定
单克隆抗体亚类鉴定结果表明,制备的单克隆抗体属IgG1型。纯化抗体经SDS-PAGE凝胶电泳,可于50 ku和25 ku左右见到2条明显的蛋白质条带(图4),分别为抗体的重链和轻链,条带大小与商业化β-actin鼠源单克隆抗体条带大小一致,且纯化效果较好。
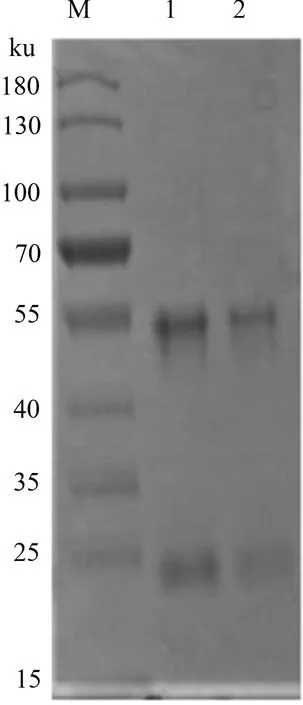
M:蛋白质Marker;1:腹水纯化后单克隆抗体;2:β-actin单克隆抗体
2.4 PRV gB蛋白单克隆抗体与不同PRV毒株反应特性的IFA鉴定
不同PRV病毒株分别接种PK-15细胞,固定细胞进行IFA试验,检测PRV gB蛋白单克隆抗体与不同PRV毒株的反应特性。结果显示,制备的单克隆抗体与不同PRV毒株均特异性反应,荧光主要集中于细胞核周围,并且与转染pCAGGS-HA-gB质粒所表达的PRV gB蛋白也反应,不与PK-15细胞发生反应(图5)。
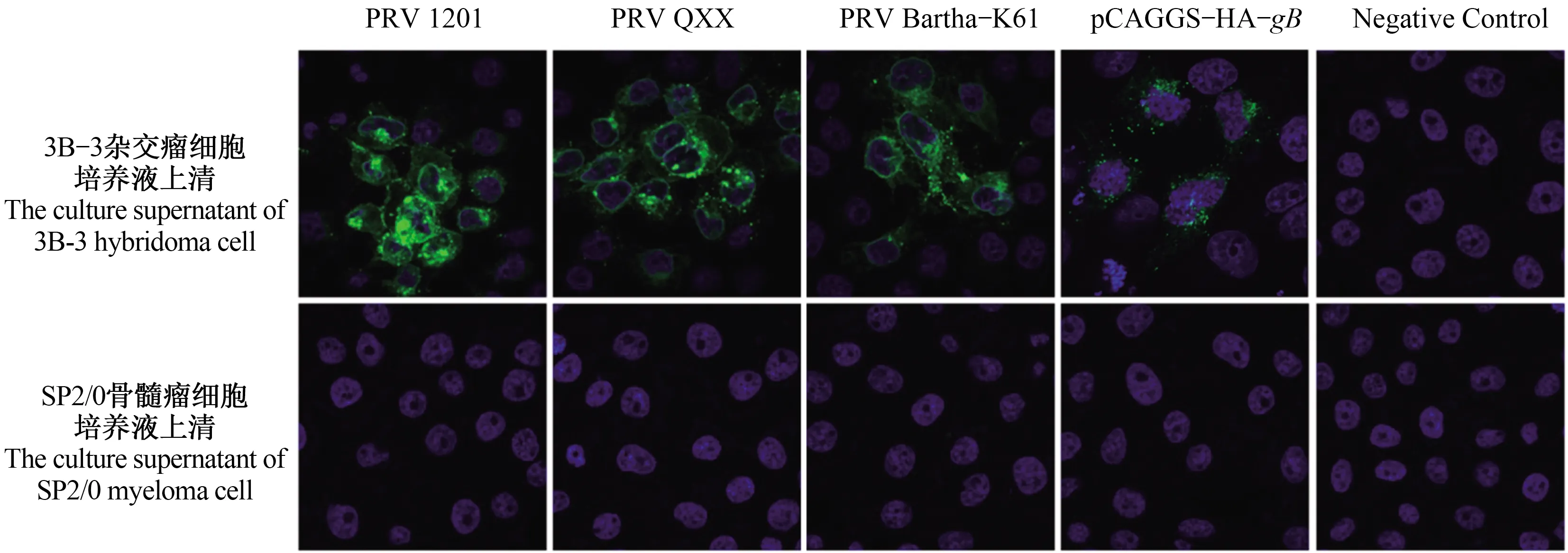
图5 IFA鉴定单克隆抗体与不同PRV毒株反应特异性
2.5 PRV gB蛋白单克隆抗体效价检测
将腹水纯化后的PRV gB蛋白单克隆抗体用PBS进行2倍系列稀释,作为一抗检测感染PRV HN1201的细胞,结果显示,所纯化抗体IFA检测效价为2-11(图6)。中和试验检测结果显示,小鼠腹水抗体的PRV中和效价为1∶25。杂交瘤细胞培养上清和腹水纯化抗体用于Western blot的最佳稀释比为1∶50和1∶5 000。
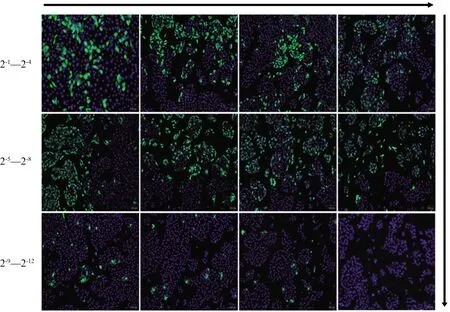
图6 IFA检测小鼠腹水纯化后PRV gB蛋白抗体效价
3 结论与讨论
PRV是影响我国乃至世界养猪业的主要病原体之一,动物感染PRV后,病毒可在神经节中长期潜伏,对整个猪群健康形成潜在威胁[19-21]。2011年国内猪群发生了由伪狂犬病毒变异株引起的猪伪狂犬病,至今已给我国养猪业造成了巨大经济损失,而且新PRV变异株毒力变强机制尚无确切定论,对于其临床检测及致病机制研究仍迫在眉睫[22-26]。
gB蛋白是PRV囊膜主要的保护性抗原糖蛋白,不仅可以刺激动物机体产生中和抗体,而且对病毒的感染和复制过程是必需的[27-31]。本研究以变异株PRV HN1201为抗原,将其浓缩纯化并灭活后免疫小鼠,取免疫后小鼠脾脏细胞与SP/20细胞融合,筛选出1株稳定分泌PRV gB蛋白抗体的单克隆杂交瘤细胞系。其他相关研究往往通过构建PRVgB原核表达质粒,诱导表达gB蛋白并纯化后免疫小鼠制备单克隆抗体,本研究以灭活全病毒为抗原进一步结合IPMA检测方法,利用抗体与病毒感染的细胞发生特异反应,有效避免了所制备的单克隆抗体仅仅与原核表达蛋白结合而无法识别PRV病毒的问题。同时,本研究采用适应无血清培养基的SP/20小鼠骨髓瘤细胞,整个杂交瘤细胞制备过程均无需添加胎牛血清,不仅节约成本更避免了因血清质量问题带来的试验失败。
本研究制备的杂交瘤细胞系所分泌抗体为IgG1亚型,腹水纯化抗体的IFA效价为2-11;细胞培养上清和腹水纯化抗体用于Western blot的最佳稀释比例为1∶50和1∶5 000;小鼠腹水抗体的PRV中和效价为1∶25。IPMA、IFA及Western blot试验结果显示,制备的单克隆抗体可特异性检测PRV gB蛋白,并可特异性识别多种PRV病毒株,这为PRV鉴定及其致病机制研究奠定了坚实基础。
