凝结芽孢杆菌发酵产L-乳酸的蛋白组学分析
2020-10-16周全兴刘冬梅许喜林
赵 珊 周全兴 刘冬梅 吴 晖 李 理 许喜林
(华南理工大学食品科学与工程学院 广州510640)
凝结芽孢杆菌属于革兰氏阳性菌,兼性厌氧,具有极强的耐酸、耐盐、耐高温能力,最适生长温度约45 ℃[1]。与一般乳酸菌相比,凝结芽孢杆菌对营养底物需求低,培养温度高,不易染杂菌,产物中乳酸含量高[2-3]。1989年,美国FDA 批准凝结芽孢杆菌用于饲料业;2004年,我国农业部发布第1126 号公告批准凝结芽孢杆菌产品用于畜牧业;2016年,国家卫计委把凝结芽孢杆菌列入《可用于食品的菌种名单》[4]。
同步糖化发酵(Simultaneous saccharification and fermentation,SSF)是一个糖化和发酵同时进行的过程,在碳水化合物被迅速发酵转化为乙醇的同时,糖化相关的酶促反应也在进行[5]。该技术在一定程度上可以提高产量,降低能耗,节约成本,并广泛应用于工业中[6]。赵国振等[7]以马铃薯淀粉为原料,经同步糖化发酵制备乳酸,产量高达196.99 g/L。Wingren等[8]分别以同步糖化发酵和传统分步糖化发酵2种方法生产乙醇,经核算,传统分步糖化发酵的生产成本比同步糖化发酵高35.1%。
乳酸有2种手性异构体,分别为L-乳酸和D-乳酸。其中,只有L-乳酸能被人体代谢。高光学纯度的L-乳酸可用于高端食品、生物、医疗和化工等行业,筛选能发酵产高光学纯度L-乳酸的菌种,探索先进的发酵技术及其理论成为当下研究的热点[9]。近年来,研究发现凝结芽孢杆菌可用于发酵产L-乳酸。Zhou等[10]使用凝结芽孢杆菌同步糖化发酵甘蔗渣亚硫酸盐浆,可获得110 g/L 的L-乳酸。Wang等[11]使用凝结芽孢杆菌发酵白米糠,可得117 g/L 的L-乳酸。此外,嗜热凝结芽孢杆菌可以以污泥为营养物发酵18 h,获得99.6 g/L的L-乳酸[12]。
蛋白组学技术是研究生物体分子变化的一种方法,可以全面了解细胞、组织、器官和体液中所有的蛋白质及其相互作用[13]。目前,通过同位素相对标记与绝对定量(Isobaric tags for relative and absolute quantitation,iTRAQ)技术可以对蛋白质进行定性、定量分析[14]。季青等[15]采用iTRAQ 蛋白组学技术研究大肠癌和肝癌术后肝肾阴虚证血浆的差异表达蛋白质,筛选出用于诊断的生物标志物。宋春花等[16]对志贺菌敏感株与基因转移耐多药株全菌蛋白质进行组间比较,寻找到细菌耐多药相关蛋白质。
目前,已有许多关于凝结芽孢杆菌利用不同有机物质生产L-乳酸的研究,然而均没有从分子生物学角度分析其代谢机制。本研究首先采用不同碳源凝结芽孢杆菌BCS13002 同步糖化发酵生产L-乳酸,然后,利用蛋白组学技术分析3种碳源条件下(葡萄糖、玉米淀粉糊化液和玉米淀粉液)凝结芽孢杆菌BCS13002 发酵产L-乳酸差异的原因,旨在为工业上提高L-乳酸的产量提供一定的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株 凝结芽孢杆菌(Bacillus coagulans)BCS 13002,由华南理工大学食品质量与安全实验室从发酵蔬菜中分离得到,已于2013年4月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC),保藏编号为CGMCC No.7431。
1.1.2 材料和试剂 MnSO4·H2O、MgCl2·6H2O、NaOH,分析纯级,天津市福晨化学试剂厂;耐高温α-淀粉酶(酶活力≥70 000 U/mL)、葡萄糖淀粉酶(酶活力≥130 000 U/mL),广州裕立宝生物科技有限公司;DTT 二硫苏糖醇、IAM 碘乙酰胺、氨水、三乙基碳酸氢铵缓冲液、PBS,美国Sigma 公司;胰蛋白酶,北京华利世科技有限公司;十二烷基硫酸钠SDS、丙酮,国药集团化学试剂有限公司;蛋白质富集大/小容量试剂盒Protein Enrichment Large/Small-Capacity Kit,美国伯乐Bio-Rad 公司;BCA 蛋白浓度测定试剂盒(增强型)、SDSPAGE 凝胶配制试剂盒、考马斯亮蓝染色液(常规法)、蛋白质阶梯(非预染),上海碧云天生物技术有限公司;乙腈、甲醇、甲酸,赛默飞世尔科技(中国)有限公司。
1.1.3 试剂溶液及培养基的配制
1)发酵培养基:无水葡萄糖46 g,蛋白胨10 g,酵母浸膏25 g,MgCl2·6H2O 0.4 g,MnSO4·H2O 0.7 g,溶解于1 L 纯净蒸馏水中,pH 6.8,混合均匀,于121 ℃,0.1 MPa 条件下灭菌20 min。
2)为比较不同碳源凝结芽孢杆菌BCS 13002 发酵产L-乳酸的差异,按如下方案设置3组比较试验。培养基按发酵培养基配制,每组分别使用不同碳源替代无水葡萄糖,具体配制如下:
第1 组:碳源为46 g/L 无水葡萄糖。
第2 组:碳源为6.25%的玉米淀粉糊化液(所产生葡萄糖的量与第1 组相当,即按葡萄糖终质量浓度46 g/L 折算,需玉米淀粉87.6 g/L)。具体操作如下:取玉米淀粉8.76 g 加入10 μL 耐高温α-淀粉酶(酶活力≥70 000 U/mL),70 ℃搅拌水浴20 min,制成玉米淀粉水解液,加入32 μL 耐高温葡萄糖淀粉酶(酶活力≥130 000 U/mL)。
第3 组:碳源为6.25%的玉米淀粉液(所产生葡萄糖的量与第1 组相当,即按葡萄糖终质量浓度46 g/L 折算,需玉米淀粉87.6 g/L)。
将上述3 组碳源分别与5%凝结芽孢杆菌BCS13002种子活化液一同接入装有2 L 无糖发酵培养基的5 L 全自动发酵罐中,于45 ℃,120 r/min 同步糖化发酵72 h,期间以8 mol/L NaOH作为中和剂调节pH 为6.5~7.0。发酵结束后,将培养液搅拌充分但不起泡沫,取适量样品,于3 000 r/min,4 ℃条件下离心15 min,弃上清液,加入适量无菌PBS 溶液,用移液枪反复吹打数次混匀,于3 000 r/min,4 ℃条件下离心15 min 后得到菌泥,每个样品重复3~5 次。取清洗干净的菌泥,分装入1.5 mL 离心管中,封口膜封口,浇淋液氮冷冻,保存于-40 ℃冰箱,备用。
1.2 仪器与设备
冷冻离心机,德国艾本德公司;超声波细胞破碎仪,江苏波场智能科技股份有限公司;垂直电泳槽,上海天能科技有限公司;Biostat Aplus 5L 自动发酵罐系统,德国布朗公司;高效液相色谱仪,美国沃特世公司;纯水仪,密理博中国有限公司;恒温混匀仪,合肥艾本森科学仪器有限公司;softmax pro 酶标仪,美国美谷分子公司;全自动数码凝胶图像分析系统,上海天能科技有限公司;串联质谱仪,美国赛默飞公司。
1.3 试验方法
1.3.1 蛋白质的提取 参照Goeminne等[17]的方法提取蛋白质:液氮研磨组织至粉末状,称取一定量研磨后样品,加入苄基三苯基氯化磷(BPP)溶液,室温涡旋振荡10 min;加入适量Tris-饱和酚,室温涡旋振荡10 min 后离心;取酚相,加入BPP溶液,室温涡旋振荡10 min 后离心;取酚相加入适量预冷乙酸铵-甲醇溶液,-20 ℃过夜沉淀蛋白;4 ℃离心30 min,弃上清;向沉淀中加入预冷丙酮混匀后4 ℃离心20 min,弃上清;沉淀用裂解液溶解;4 ℃离心5 min,取上清液得到蛋白质。
1.3.2 蛋白质烷基化和酶解 参照Randall等[18]的方法进行烷基化,参照Trusek-Holownia等[19]的方法进行酶解:取蛋白质样品100 μg,用裂解液补充体积到100 μL;加入终浓度10 mmol/L TCEP,在37 ℃下反应60 min;加入终浓度40 mmo/L 碘乙酰胺(Iodoacetamide),于室温下避光反应40 min;每管各加入预冷的丙酮(丙酮:样品体积比=6∶1),-20 ℃沉淀2 min,10 000 r/min 离心20 min,取沉淀;用100 μL 100 mmol/L TEAB 充分溶解样品;按照质量比1∶25(酶∶蛋白质)加入胰蛋白酶在37℃条件下酶解过夜。
1.3.3 对样品进行iTRAQ 标记 参照Randall等[18]的方法对酶解后的样品进行iTRAQ 标记,加标流程如下:胰蛋白酶消化后,用真空泵抽干肽段;用0.5 mol/L TEAB 复溶肽段;取出iTRAQ 试剂恢复到室温,离心后加入异丙醇,经涡旋、离心后,每100 μg 多肽加入一管iTRAQ 试剂,室温孵育2 h;加入50 μL 超纯水,室温放置30 min;将每组中等量标记产物混合于一管中,真空浓缩仪抽干。每组样品有2 个生物学重复。
1.3.4 高pH-RPLC 分离 用HPLC上样缓冲液复溶1.3.3 节中真空浓缩的多肽样品,采用反相C18 柱进行高pH 液相分离。分离条件如下:色谱仪器为Waters UPLC;A 相为水(氨水、甲酸调至pH 10);B 相为100% 甲酸铵溶液(CAN);紫外检测波长为214 nm/280 nm;流速为400 μL/min;时间为90 min。根据峰型和时间共收取40 个馏分,合并成10 个馏分,真空离心浓缩后备用。
1.3.5 液相-质谱分析 参照Sun等[20]的方法分析用质谱上样缓冲液溶解1.3.4 节中的真空浓缩样品。质谱条件如下:数据采集软件为Thermo Xcalibur 4.0(Thermo,USA);Thermo-C18(4.6 mm×250 mm,5 μm);色谱仪器为EASY-nLC 1200;质谱仪器为Q-Exactive(Thermo,USA);色谱分离时间为120 min;A 相为含有0.1%甲酸的2% ACN;B 相为含有0.1%甲酸的80% ACN;流速为300 μL/min。MS 扫描范围(m/z)350~1300,采集模式DDA,一级质谱分辨率70 000,碎裂方式HCD,二级分辨率17 00,动态排除时间18 s。
1.3.6 序列数据库搜索和数据分析 经过HPLC-MS/MS 分析,得到了所有的样品组肽片段信息,经R 语言汇编后登录Uniprot 分类数据库进行信息解读。查询数据库使用的软件为Proteome Discoverer TM Software 2.1。查询数据时将图像文件提交至该软件服务器,选择已建立的数据库,进行数据库搜索,具体的质谱上样与相关生物学信息分析,由上海美吉生物医药科技有限公司完成。
把各样本鉴定得到的蛋白质进行交叉对比,使用R 语言中的t 检验函数计算样本间差异的显著性。本研究设定的显著差异表达蛋白质筛选标准为:差异基因阈值<0.67 倍或>1.5 倍,其中P<0.05 的差异蛋白质定义为显著差异,P<0.01 的差异蛋白质定义为极显著差异。
1.3.7 生物信息学分析 通过GO(Gene Ontology,http://www.geneontology.org/)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG,http://www.genome.jp/kegg/)数 据库分析,确定可能富集具有特定生物学特性的差异表达蛋白质。同时,通过差异蛋白质GO 功能显著性富集分析软件Goatools(https://github.com/tanghaibao/GOatools)和差异蛋白质KEGG 显著性富集分析软件KOBAS(http://kobas.cbi.pku.edu.cn/home.do)对差异蛋白进行功能显著性富集分析和蛋白质富集分析。
2 结果与分析
2.1 不同碳源条件下凝结牙孢杆菌发酵产L-乳酸的差异
图1 为凝结芽孢杆菌在3种不同碳源条件下发酵产L-乳酸的量及其光学纯度。由图1a可知,第2 组的L-乳酸含量最高,可达27.75 g/L,高于第1 组(14.23 g/L),而第3 组几乎没有L-乳酸的产生。由图1b可知,凝结芽孢杆菌BSC13002 发酵产生的L-乳酸光学纯度可达99.5%。
2.2 凝结芽孢杆菌BSC13002 蛋白质组数据总体描述
蛋白质组学全谱分析是在蛋白质水平上全面认识有机体生理、病理等过程,目前iTRAQ 技术已广泛的应用于蛋白质组学研究领域[21]。通过蛋白质组全谱的GO 富集分析(图2a)进行蛋白质功能注释,并通过KEGG 分类分析这些蛋白质的相关代谢途径(图2b)。其中,GO 富集分析可分为生物过程、细胞组成和分子功能;KEGG 途径可分为新陈代谢、遗传信息加工、环境信息加工、细胞过程、生物体系统等不同的分支。由图2a,2b可知,差异表达蛋白质主要参与碳水化合物代谢、氨基酸代谢、辅因子和维生素代谢、膜转运、翻译及脂质代谢,差异表达蛋白质数量分别为206,170,95,81,79,75。绝大部分差异表达蛋白质与代谢途径相关,部分差异表达蛋白质与处理环境信息相关的通路、信号转换、跨膜转运有关,这可能是由于碳源差异导致了菌体中蛋白质的适应性表达,即不同碳源对菌体整体代谢情况造成了不同影响。
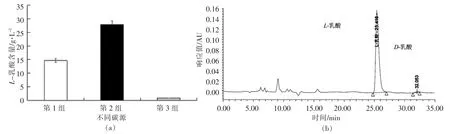
图1 不同碳源条件下凝结芽孢杆菌发酵产L-乳酸的量及L-乳酸纯度Fig.1 The amount of L-lactic acid produced by fermentation of B.coagulans under different carbon source conditions and the purity of L-lactic acid
2.3 差异表达蛋白质总体分析
通过分析差异表达蛋白质可以比较不同生物体在不同时间或不同状态下蛋白质表达的变化,其具有重要的实践意义[22]。在3种不同碳源条件下凝结芽孢杆菌共鉴定出454种差异表达蛋白质(上调蛋白质差异倍数>1.2,下调蛋白质差异倍数<0.8,P<0.05)。由图3a,3b可知,第1 组Vs 第2组中有43种蛋白质上调,21种蛋白质下调;第1组Vs 第3 组中有170种蛋白质上调,175种蛋白质下调;第2 组Vs 第3 组中有141种蛋白质上调,154种蛋白质下调。此外,第1 组Vs 第3 组与第2 组Vs 第3 组有217种差异共表达蛋白质,而第1 组Vs 第2 组与第2 组Vs 第1 组有22种差异共表达蛋白质,第1 组Vs 第2 组与第1 组Vs第3 组仅有11种差异共表达蛋白质。


图2 凝结芽孢杆菌GO 功能分类及KEGG 代谢途径Fig.2 GO function classification and KEGG metabolic pathway of B.coagulans
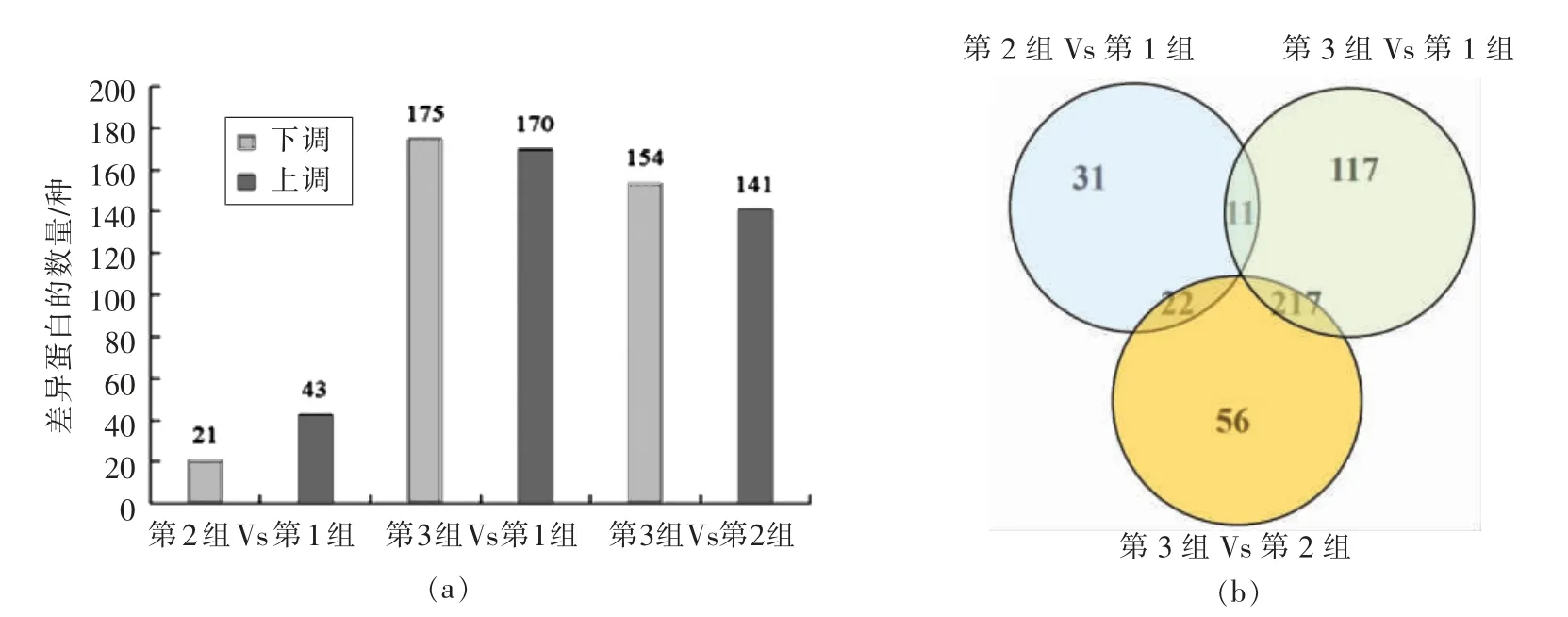
图3 3种不同碳源条件下凝结芽孢杆菌差异表达蛋白质的数量及差异表达蛋白质的维恩图Fig.3 The number of differentially expressed proteins of B.coagulans under three different carbon sources and the Venn diagram of differentially expressed proteins
2.4 差异表达蛋白质代谢途径分析
几乎所有的代谢反应都是在酶的催化作用下进行的,多种酶构成了酶体系,以催化得到目标产物[23]。通过比较3种不同碳源条件下产L-乳酸的KEGG 代谢途径,发现差异表达蛋白质主要导致糖酵解/糖异生、三羧酸循环、丙酮酸代谢、碳代谢、果糖代谢、HIF-1 信号传导、泛酸和辅酶A 生物合成、双组分调节等代谢途径不同。由2.1 节可知,第1 组、第2 组和第3 组的L-乳酸产量不同。由图4a 第1 组Vs 第2 组的KEGG 代谢途径可知,双组分调节系统、泛酸和辅酶A 生物合成、果糖代谢等途径对L-乳酸的产量量具有重要的影响。因此,可以通过这些代谢途径比较和分析第1组和第2 组凝结芽孢杆菌BCS 13002 发酵产物中L-乳酸差异的原因。由图4b可知,第2 组Vs第3 组中有显著差异的代谢途径是糖酵解/糖原异生、三羧酸循环、丙酮酸代谢、碳代谢。由图4c可知,第1 组Vs 第3 组中差异显著的代谢途径是糖酵解/糖原异生、三羧酸循环、碳代谢和HIF-1信号通路。由此,可以发现,糖酵解/糖异生和三羧酸循环在图4b 和图4c 的KEGG 代谢途径中都有重要的影响作用。
2.5 第1 组Vs 第2 组产L-乳酸的代谢差异途径
由2.1 节可知,第2 组的L-乳酸含量要高于第1 组。导致这种现象的原因可能有以下2 个:一是参与糖酵解/糖异生和三羧酸循环的差异表达蛋白质对L-乳酸的产生起显著作用;二是其它代谢途径影响第1 组和第2 组中丙酮酸及L-乳酸的产生。图5a,图5b,图5c 分别为双组分调节、泛酸和辅酶A 生物合成及果糖代谢途径的反应过程。由图5a所示的双组分调节途径可知,下调蛋白质为响应调节受体蛋白(SpoOF),差异倍数为0.49,SpoOF可促进凝结芽孢杆菌BCS13002 孢子膜的形成,使得第2 组的发酵程度高于第1 组。
由图5b所示的泛酸和辅酶A 的生物合成过程可知,上调蛋白质为二羟酸脱水酶(EC:4.2.1.9)和泛酸-β-丙氨酸连接酶(EC:6.3.2.1),差异倍数分别为1.58,1.53。其中,二羟酸脱水酶可催化反应:2,3-二羟基-3-间乙基丁酸盐↔H2O+3-甲基-2-氧代丁醇[24]。与第1 组相比,第2 组中的3-甲基-2-氧代丁酸酯的产量进一步提高,3-甲基-2-氧代丁酸酯将进一步转化为缬氨酸。此外,泛酸-β-丙氨酸连接酶可促进第2 组中的(R)-泛酸的生成,且该酶属于连接酶,可作为酸-D-氨基酸连接酶形成碳氮键[25],最终会促进并转化为辅酶A。缬氨酸和辅酶A 都可促进三羧酸循环中丙酮酸的产生,丙酮酸又可在糖酵解/糖异生途径中转化为L-乳酸。由图5c所示的果糖代谢过程可知,下调蛋白质是PTS 果糖转运蛋白亚基(EC:2.7.1.69),差异倍数为0.42,该酶可催化化学反应:蛋白质Npi-磷酸-L-组氨酸+糖↔蛋白组氨酸+糖磷酸[26],该酶促进了D-果糖-1-磷酸的产生,与L-乳酸的形成无关,但反过来可加速D-果糖的消耗,最终导致第2 组中L-乳酸的含量较高。
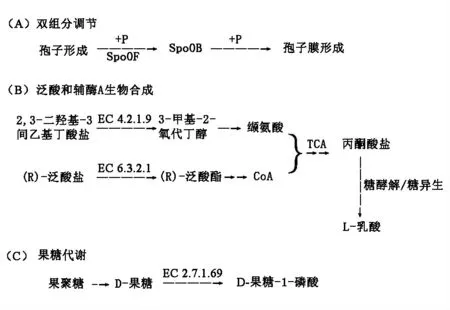
图5 第1 组Vs 第2 组差异表达蛋白质主要涉及的KEGG 代谢途径反应过程Fig.5 The metabolic pathway of KEGG involved in the differential expression protein between group 1 and group 2
总之,这些差异表达蛋白质的表达情况可在一定程度上说明第2 组的L-乳酸含量较第1 组高(P<0.05)的原因。就碳源的成本而言,第2 组的材料成本为(3.00±0.14)元/kg,低于第1 组(6.00±0.37)元/kg,并且第2 组的L-乳酸产量高于第1组,该数据具有一定的工业应用价值。
2.6 第2 组Vs 第3 组中差异表达蛋白质的糖酵解/糖异生和三羧酸循环代谢
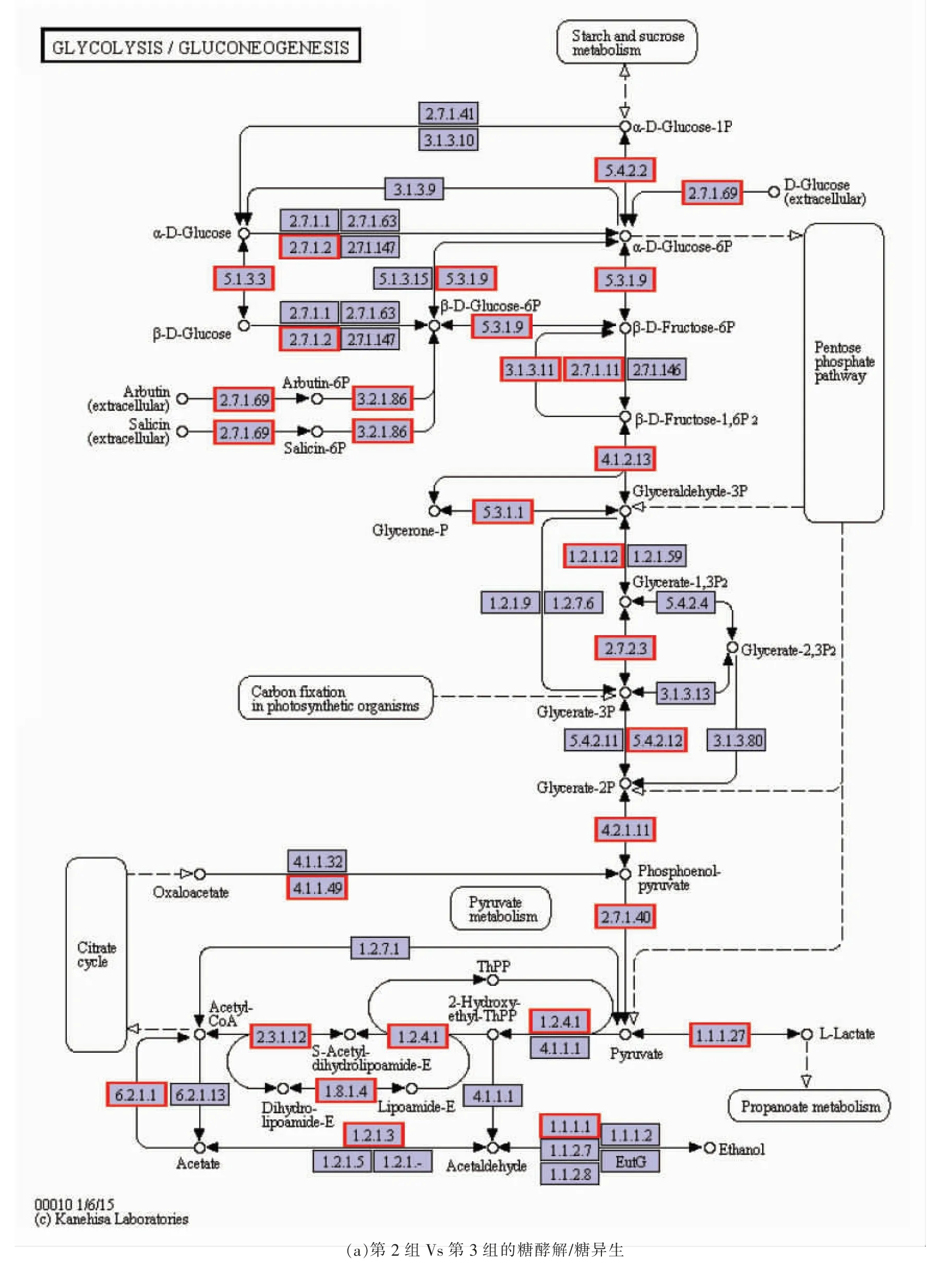
图6a,6b 为第2 组Vs 第3 组中差异表达蛋白质的糖酵解/糖异生和三羧酸循环代谢途径,通过KEGG 数据库对不同碳源条件下的凝结芽孢杆菌BCS13002 代谢通路进行分析。
糖酵解/糖异生在维持葡萄糖稳态中起重要作用,可参与碳水化合物的降解与合成[27]。由图6a可知,与第2 组相比,第3 组的糖酵解/糖异生代谢中差异表达蛋白质在直接或间接地催化不同底物产生不同靶生物中起主导作用。第2 组的蔗糖-异麦芽糖酶酶活性强于第3 组(P<0.05),该酶可催化第2 组中的糊精形成葡萄糖,而对第3 组中的淀粉并无催化作用。
图6a 中影响糖酵解/糖异生途径的主要上调蛋白质是果糖-1,6-二磷酸酶(EC:3.1.3.11)和丙酮酸脱氢酶(EC:1.2.4.1),差异倍数分别为2.97,4.73,此外,还包括丙酮酸脱氢酶E1 组分α 亚基、脱氢酶E1 组分、特定的TPP 依赖性乙炔脱氢酶、丙酮酸脱氢酶E1 组分β 亚基,差异倍数分别为2.15,4.34,2.60,4.85,作为抑制剂的果糖-1,6-二磷酸酶可防止β-D-果糖-1,6-二磷酸转化为其它物质[28]。与第3 组相比,第2 组中的丙酮酸脱氢酶可减弱丙酮酸对2-羟基-乙基-Thpp 的抑制作用,使得第2 组中的丙酮酸含量较高[29]。主要下调蛋白质是葡萄糖-6-磷酸异构酶(EC:5.3.1.9)、磷酸甘油酸激酶(EC:2.7.2.3)、磷酸甘油酸变位酶(EC:5.4.2.12)、磷酸丙酮酸水合酶(EC:4.2.1.11)、丙酮酸激酶(EC:2.7.1.40)和L-乳酸脱氢酶(EC:1.1.1.27),这些酶的差异倍数分别为0.64,0.59,0.59,0.51,0.55,0.52。其中,葡萄糖-6-磷酸异构酶催化葡萄糖-6-磷酸转化为果糖6-磷酸,即与第3 组相比,第2 组中果糖6-磷酸的产量更高[30]。磷酸甘油酸激酶作为糖酵解/糖异生的关键酶,对催化三磷酸腺苷(ATP)的形成起着至关重要的作用[31]。磷酸丙酮酸水合酶是一种多功能糖酵解酶,可催化2-磷酸-D-甘油酸脱水形成磷酸烯醇丙酮酸[32],该酶导致第2 组中磷酸烯醇丙酮酸的产量高于第3组。丙酮酸激酶在调节细胞代谢中起重要作用,其可在糖酵解/糖异生中催化磷酸烯醇丙酮酸和ADP 转化为丙酮酸和ATP[33]。相比于第3 组,第2组中丙酮酸可被L-乳酸脱氢酶催化产生更多的L-乳酸[34]。此外,甘油醛-3-磷酸脱氢酶是一种同工酶,可作为1,3-二磷酸甘油酸和甘油醛-3-磷酸相互转化的催化物质。综上所述,在糖酵解/糖异生代谢途径中,可充分说明第2 组的L-乳酸含量高于第3 组。
三羧酸循环是微生物生命活动中物质和能量代谢的主要途径,其主要有2 个功能:能量的产生和前体的合成[35]。由图6b可知,与第2 组相比,第3 组三羧酸循环中的差异表达蛋白质均发生下调,主要包括柠檬酸(Si)-合酶(EC:2.3.3.1)、苹果酸脱氢酶(EC:1.1.1.37)、苹果酸脱氢酶(EC:1.1.5.4)、磷酸烯醇丙酮酸羧激酶(ATP)(EC:4.1.1.49)及丙酮酸脱氢酶(EC:1.2.4.1),差异倍数分别为2.72,2.51,2.61,2.05,4.73。其中,柠檬酸(Si)-合成酶在细胞代谢中起重要作用并可催化三羧酸循环:乙酰-CoA+H2O+草酰乙酸→柠檬酸盐+CoA-SH[36],在第2 组中的柠檬酸含量高于第3组。苹果酸脱氢酶通过将NAD+还原为NADH,可逆地催化苹果酸氧化成草酰乙酸[37],该反应使得第2 组草酰乙酸的含量较第3 组高。苹果酸脱氢酶可催化化学反应:(S)-苹果酸+醌↔草酰乙酸+还原醌[38],该反应也导致第2 组草酰乙酸含量的增加。磷酸烯醇丙酮酸羧激酶可催化化学反应:ATP+草酰乙酸↔ADP+磷酸烯醇丙酮酸+CO2[39]。由上可知,在丙酮酸合成中由于柠檬酸(Si)-合成酶、苹果酸脱氢酶和苹果酸脱氢酶的共同催化作用,使得第2 组中的草酰乙酸的含量远大于第3组。然而,在草酰乙酸转换为磷酸烯醇丙酮酸的过程中,第3 组磷酸烯醇丙酮酸羧激酶的丰度是第2 组的2.36 倍,简而言之,第2 组中磷酸烯醇丙酮酸的形成率较低,但草酰乙酸含量的影响大于磷酸烯醇丙酮酸羧激酶催化生成磷酸烯醇丙酮酸的的影响。从三羧酸循环中生成磷酸烯醇丙酮酸只是作为磷酸烯醇丙酮酸的一个途径,并不起主导作用。总之,在丙酮酸的合成过程中,第2 组磷酸烯醇丙酮酸的总含量高于第3 组。同时,丙酮酸脱氢酶可抑制丙酮酸转化为乙酰辅酶A。因此,在三羧酸循环中,第2 组中丙酮酸的含量较第3 组多。
综上可知,在糖酵解/糖异生和三羧酸循环代谢中,第2 组丙酮酸的含量、L-乳酸脱氢酶的酶活性均高于第3 组,第2 组中糊精可经酶的催化形成乳酸,而第3 组中的淀粉并不能形成乳酸。因此,第2 组L-乳酸的含量较第3 组高。
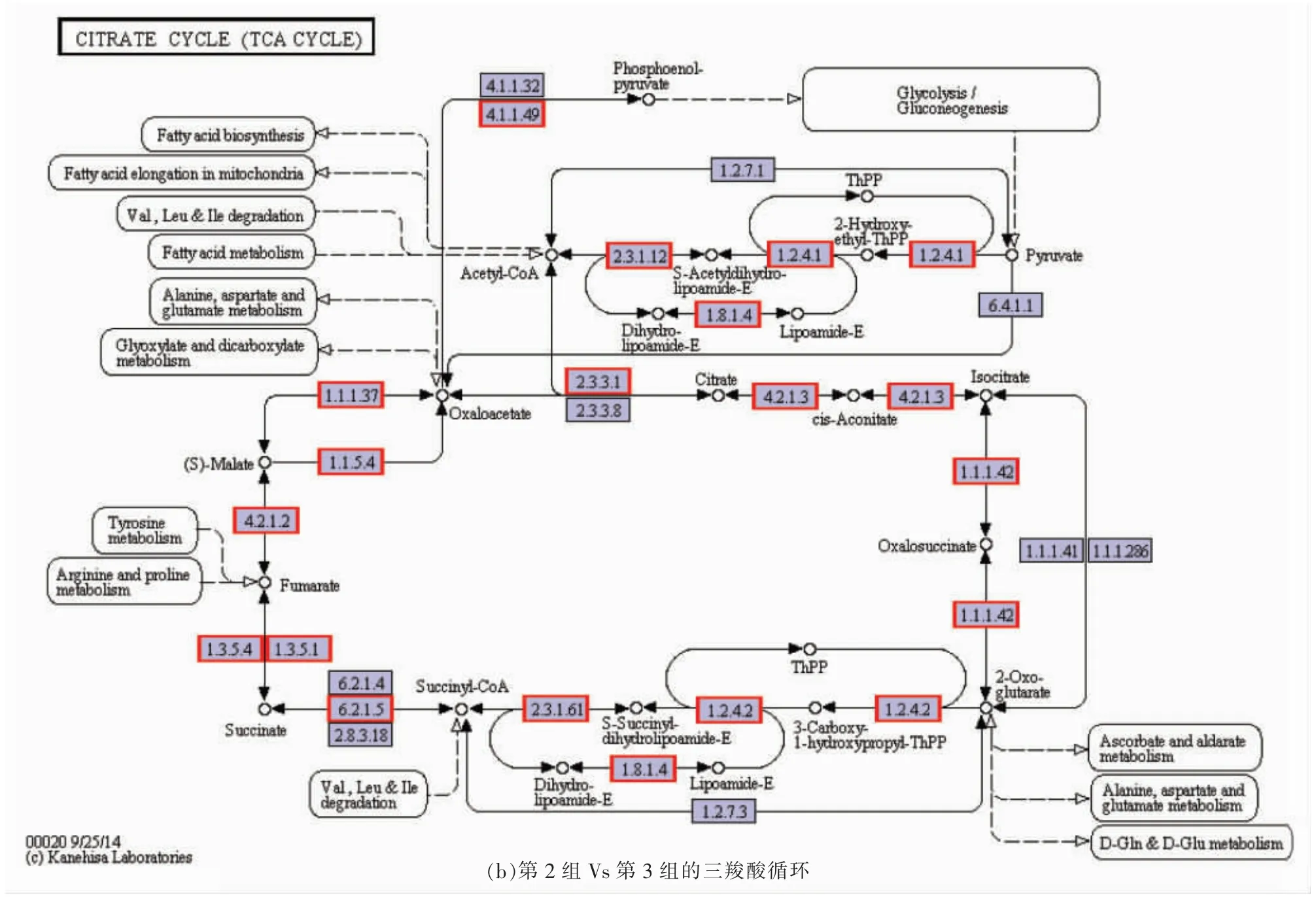
图6 第2 组Vs 第3 组差异表达蛋白质的糖酵解/糖异生和三羧酸循环代谢Fig.6 Glycolysis/gluconeogenesis and TCA cycle metabolism of differential expressionproteins in group 2 Vs group 3
2.7 第1 组Vs 第3 组中差异表达蛋白质的糖酵解/糖异生和三羧酸循环代谢途径
由2.1 节可知,与第3 组相比,第1 组的L-乳酸含量较高。从蛋白质组谱图(图3)可知凝结芽孢杆菌BCS13002 在第1 组和第3 组代谢途径中存在许多对生产L-乳酸产量起至关作用的差异表达蛋白质。其中,糖酵解/糖异生和三羧酸循环代谢中差异表达蛋白质的数量最多。
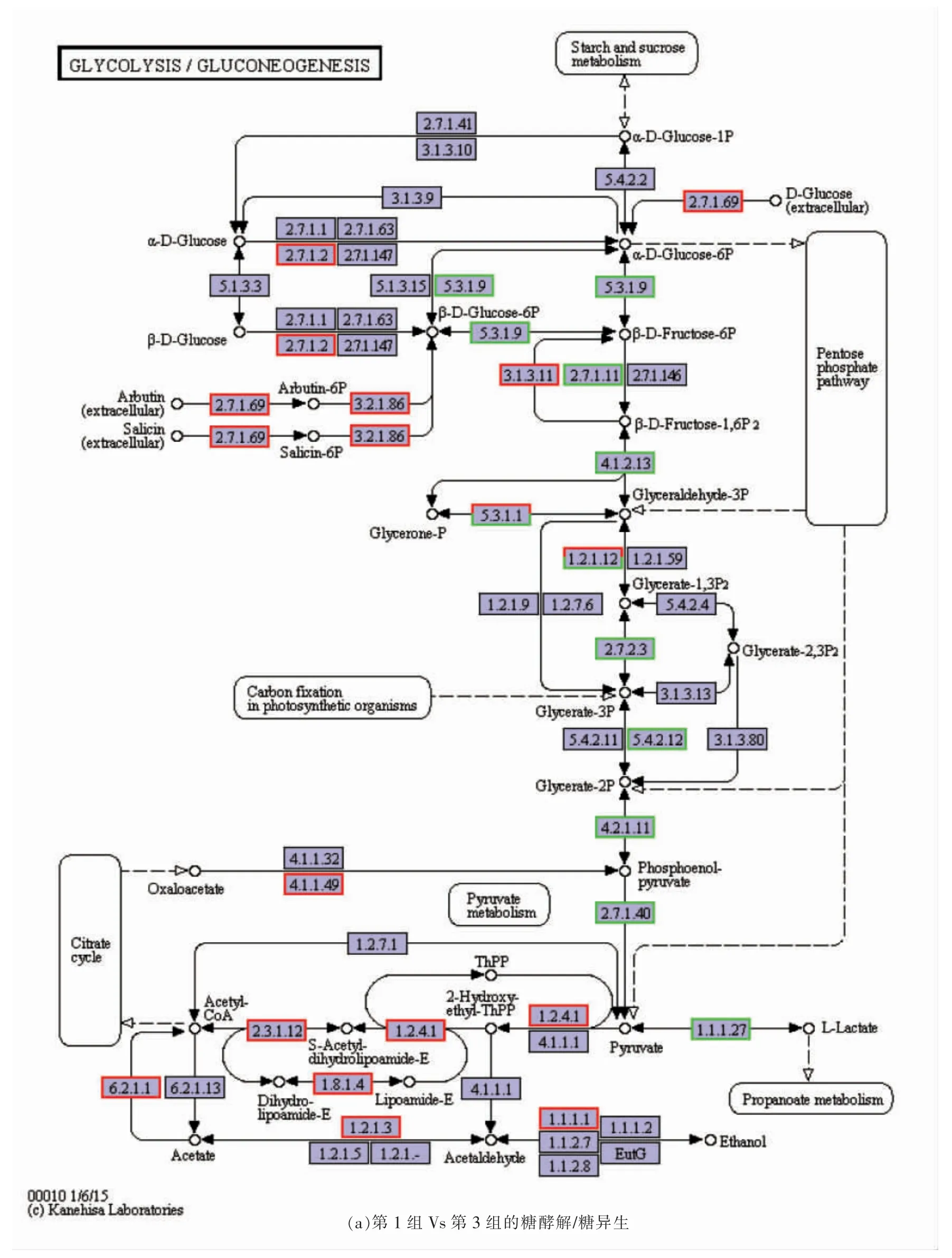
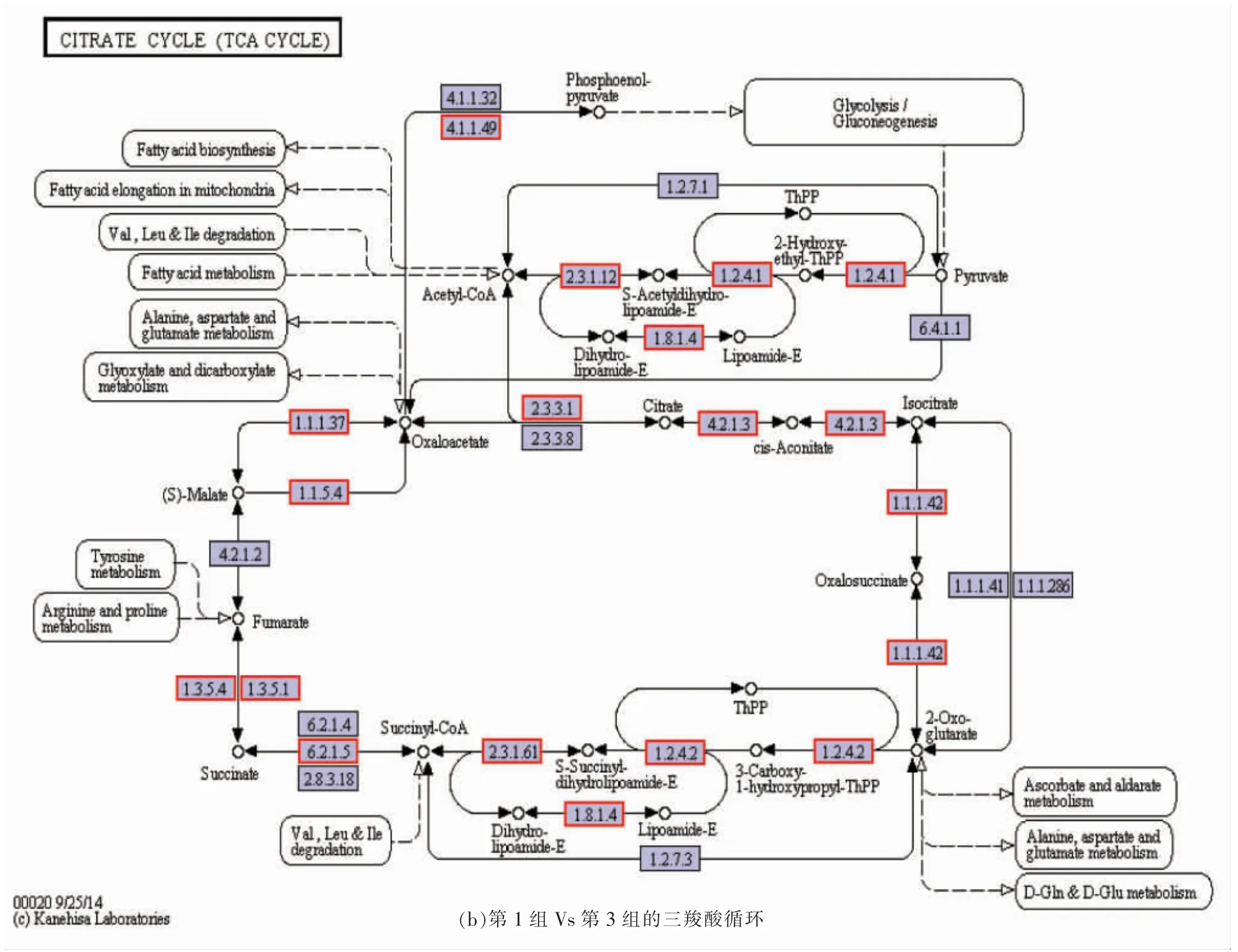
图7 第1 组Vs 第3 组差异蛋白的糖酵解/糖异生和三羧酸循环代谢Fig.7 Glycolysis/gluconeogenesis and TCA cycle metabolism of differential expression proteins in group 1 Vs group 3
由图7a可知,糖酵解/糖异生途径中存在大量上调和下调的蛋白质。与第1 组相比,第3 组中上调的蛋白质包括果糖-1,6-二磷酸酶(EC:3.1.3.11)、丙酮酸脱氢酶(EC:1.2.4.1),差异倍数分别为3.34,5.46。丙酮酸脱氢酶含有丙酮酸脱氢酶E1 组分α 亚基、脱氢酶E1 组分,特定的TPP 依赖性乙炔脱氢酶、丙酮酸脱氢酶E1 组分β 亚基,差异倍数分别为2.38,4.82,5.45,2.65。与第1 组相比,第3 组中下调的蛋白质为葡萄糖-6-磷酸异构酶(EC:5.3.1.9)、磷酸甘油酸激酶(EC:2.7.2.3)、磷酸甘油酸变位酶(2,3-二磷酸化酶)(EC:5.4.2.12)、磷酸丙酮酸水合酶(EC:4.2.1.11)、丙酮酸激酶(EC:2.7.1.40)、L-乳酸脱氢酶(EC:1.1.1.27),差异倍数分别为0.55,0.52,0.36,0.45,0.52,0.42。此外,同工蛋白酶是磷酸丙糖异构酶(EC:5.3.1.1)与甘油醛-3-磷酸脱氢酶(EC:1.2.1.12),2种酶的上调和下调的倍数分别为1.68 和0.40,2.99 和0.51。
图7b所示为三羧酸循环,其主要上调蛋白质是柠檬酸盐(Si)-合成酶(EC:2.3.3.1)、苹果酸脱氢酶(EC:1.1.1.37)、苹果酸脱氢酶(EC:1.1.5.4)、磷酸烯醇丙酮酸羧激酶(ATP)(EC:4.1.1.49)、丙酮酸脱氢酶(EC:1.2.4.1),差异倍数分别为3.09,2.93,2.85,2.36,5.46。
由上可知,第1 组和第3 组之间的糖酵解/糖原异生和三羧酸循环代谢的差异与第2 组和第3组之间的糖酵解/糖异生和三羧酸循环代谢的差异相似。因此,可知糖酵解/糖异生和三羧酸循环代谢对L-乳酸的产生具有显著影响。
3 结论
通过研究3种碳源凝结芽孢杆菌BCS13002同步糖化发酵对L-乳酸产量的影响,发现可以用玉米淀粉糊化液代替葡萄糖同步糖化发酵生产L-乳酸,其具有成本低,产量高的优点。此外,通过蛋白组学分析,发现L-乳酸产量差异的生物学机制是凝结芽孢杆菌BCS13002 在3种碳源下蛋白质表达水平不同,并且其中的部分差异表达蛋白质所属的代谢途径与L-乳酸含量差异相关,这些途径主要为糖酵解/糖异生、三羧酸循环、HIF-1 信号通路、丙酮酸代谢、碳代谢、泛酸和辅酶A 生物合成、果糖代谢、双组分调节,其中最重要作用的代谢途径为糖酵解/糖异生和三羧酸循环。本研究对工业上使用玉米淀粉糊化液代替葡萄糖发酵生产L-乳酸提供了一定的理论基础,具有重要的工业实用价值。
