基于iTRAQ技术研究锰离子缺乏对植物乳杆菌的影响
2020-10-16李昆太
程 新 董 英 李昆太
(1 江西省农业微生物资源开发利用工程实验室 南昌330045 2 江西农业大学生物科学与工程学院 南昌330045 3 江苏大学食品与生物工程学院 江苏镇江212013
植物乳杆菌是一种常见于奶油、肉类及蔬菜发酵制品中的乳酸菌,能通过胃定植于肠道发挥有益作用[1]。由于其具有较好的产酸及益生功能,因此在食品发酵、工业乳酸发酵以及医疗保健等领域都有着广泛的应用[2]。长期以来,通过优化培养基或培养条件等方式提高菌体发酵密度,降低生产成本的研究不断出现[3-5]。
由于乳酸菌缺乏合成某些生长因子和代谢关键酶,因此在培养的过程中需要添加复合氮源和某些生长因子。其中,金属离子是影响乳酸菌生长与代谢的重要因素[6]。课题组前期工作表明,锰离子的存在不仅影响乳酸菌的生长,而且对乳酸菌发酵活力至关重要[7]。当培养基中缺乏足够浓度的锰离子时,培养出的乳酸菌密度下降,菌体在转接后发酵能力显著降低,而这一过程可能与培养基中锰离子缺乏,影响乳酸菌的胞内代谢有关[8],目前其机理尚不清楚。
蛋白质组学分析(Proteomics analysis)已成为对乳酸菌的细胞应激反应或其能量代谢途径研究的有力工具[9]。本研究在前期工作基础上,以自行筛选的植物乳杆菌为研究对象,采用iTRAQ 技术研究锰离子缺乏对植物乳杆菌代谢的影响,为提高乳酸菌发酵剂生产水平提供参考。
1 材料与方法
1.1 材料
菌种:植物乳杆菌(Lactobacillus plantarum)DY-2,课题组自行分离鉴定。
MRS 培养基(g/L):葡萄糖20,植物蛋白胨10,牛肉浸膏8,无水乙酸钠5,磷酸氢二钾2,酵母粉4,柠檬酸钠2,七水硫酸镁0.58,四水硫酸锰0.25,吐温1 mL。
菊芋浸汁培养基,配方见参考文献[8]。
裂解液缓冲液的配制:8 mol/L 尿素、30 mmol/L HEPES、1 mmol/L PMSF、2 mmol/L EDTA、10 mmol/L DTT。
1.2 培养方法及样品收集
保藏于-20 ℃的植物乳杆菌菌种用MRS 液体培养基活化8 h(活菌数大约1.8×109CFU/mL),按2%接种量接种于优化后的菊芋浸汁发酵培养基(MnSO4·4H2O 添加量为0.5 g/L),以不添加锰离子的优化菊芋浸汁培养基为对照(锰离子质量浓度低于0.001 g/L),发酵温度34 ℃,发酵时间20~24 h,在不同时间点(6,9 h)取样放入-80 ℃保存。每个样品设置2 个重复。
1.3 样品制备
将冷冻的样品取出,直接加入适量裂解液,加入蛋白酶抑制剂(PMSF 或Cocktail)使其终浓度为1 mmol/L,用移液器吹打至分散状态。冰上超声破碎,功率80 W,超声0.8 s,关闭0.8 s,共3 min。加入5 倍体积的预冷丙酮振荡混合,-20 ℃沉淀2 h或过夜。4 ℃,12 000×g 离心10 min,收集沉淀。加入适量体积的预冷丙酮振荡混合,4 ℃,12 000×g离心15 min,收集沉淀,重复该步骤1 次。常温下干燥后,溶解于样品裂解液中,充分溶解蛋白。将溶液在室温下12 000×g 离心15 min,取上清,并再次离心取上清,充分去除不容性杂质。上清液即为组织的总蛋白溶液,分装后储存于-80 ℃备用。蛋白浓度测定参考Bradford等[10]的方法。
1.4 蛋白还原烷基化及酶解
参考FASP 方法[11]酶解蛋白。蛋白定量后每个样品各取100 μg,采用5 倍体积预冷丙酮进行沉淀,-20 ℃放置1 h,充分沉淀蛋白。4 ℃,12 000 r/min离心10 min,取沉淀真空冷冻干燥。采用50 μL iTRAQ 试剂盒中的溶解缓冲液充分溶解蛋白沉淀,加入4 μL 还原剂,60 ℃反应1 h。加入2 μL半胱氨酸阻断试剂室温反应10 min,将还原烷基化后的蛋白溶液加入10 K 的超滤管中,12 000 r/min 离心20 min,弃掉收集管底部溶液。加入100 μL 溶解缓冲液,12 000 r/min 离心20 min,弃掉收集管底部溶液,重复3 次。更换新收集管,在超滤管中加入50 μL 质量浓度为50 ng/μL 的测序级胰蛋白酶溶液,37 ℃反应12 h。12 000 r/min 离心20 min,收集酶解后肽段,在超滤管中再加入50 μL溶解缓冲液,12 000 r/min 离心20 min,收集管底溶液并与前次溶液合并。
1.5 蛋白标记及质谱预试验
从冰箱中取出iTRAQ 试剂,平衡到室温;将iTRAQ 试剂离心至管底;用150 μL 异丙醇溶解i-TRAQ 试剂。取50 μL 样品(100 μg 酶解产物)转移到新的离心管中,加入iTRAQ 试剂后室温反应2 h;加入100 μL 水终止反应;混合所有标记样品,涡旋振荡,离心至管底;真空冷冻干燥样品,留作iTRAQ 分离鉴定。
1.6 反向色谱-TripleTOF 分析
将冻干的多肽样品重新溶解于Nano-RPLC Buffer A 中。在线Nano-RPLC 液相色谱在Eksigent nanoLC-UltraTM2D 系统(AB SCIEX)进行,溶解后的样品以2 μL/min 的流速上样到C18 预柱上(100 μm×3 cm,C18,3 μm,150 Å),然后保持流速冲洗脱盐10 min。分析柱为C18 反相色谱柱(75 μm×15 cm C18,3 μm 120 Å,ChromXP Eksigent),试验所用梯度为70 min 内流动相B 由5%升高至35%。质谱采用TripleTOF5600 系统(AB SCIEX)结合纳升喷雾III 离子源(AB SCIEX,USA),喷雾电压为2.5 kV,气帘气压为30 PSI,雾化气压为5 PSI,加热器温度为150 ℃,质谱扫描方式为信息依赖的采集工作模式下(Information Dependent Analysis,IDA),一级TOF-MS单张图谱扫描时间为250 ms,每次IDA 循环下最多采集35 个电荷为2+到5+且单秒计数大于150的二级图谱,每次循环时间固定为2.5 s,碰撞室能量设定适用于所有前体离子碰撞诱导解离(CID),动态排除设置为18 s。
1.7 蛋白定性和定量
数据处理采用含Paragon algorithm 算法的Protein Pilot Software v.5.0(AB SCIEX,USA)软件进行,试验使用数据库为植物乳杆菌数据库,数据库来源于NCBI。
2 结果与分析
2.1 质谱检测与差异表达蛋白鉴定结果
经过iTRAQ 分析后,以5% FDR 来计算,共匹配到本地谱图(Spectra)41 801 个,鉴定到特有肽段(Unique Spectra)序列8 188 个,鉴定到蛋白质(Protein)966 个,这些蛋白的功能涉及到细胞代谢、能量代谢、应激反应、信号转导及未知蛋白等各个方面。当蛋白的丰度比即差异倍数达到1.3倍以上(或0.7 倍以下)且经统计检验的P<0.05时,定义该蛋白为两样品间的差异蛋白。本次试验差异蛋白的基本情况如表1所示。
2.2 发酵6 h 差异蛋白的GO 及KEGG 分析
乳酸菌在发酵6 h 后进入对数生长期,此时菌体代谢非常旺盛。经过蛋白质组学分析,共检测出56 个差异蛋白,其中下调蛋白25 个,上调蛋白31 个。
在25 个下调差异蛋白中,与核糖体结构相关的蛋白(ribosomal protein)有7 个,其中30S 核糖体蛋白S20 下降至对照组的0.275 倍,50S 核糖体蛋白L27 下降至对照组的0.562 倍,30S 核糖体蛋白S11 下降至对照组的0.673 倍。由于核糖体蛋白主要参与蛋白质的合成过程,说明锰离子缺乏的情况下,乳酸菌蛋白合成途径会受到一定抑制。与代谢相关的酶类有5 个[其中与精氨酸合成密切相关的精氨酰琥珀酸裂解酶(argininosuccinate lyase)下调幅度超过1 倍],主要参与蛋白质或氨基酸代谢;与复制、转录、复制过程相关的蛋白也有5 个;而与信号传导相关的丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase)和双组分组氨酸蛋白激酶(two component system histidine protein kinase)在锰离子缺乏的情况下表达均出现了下降趋势。
在上调的31 个差异蛋白中,与复制、转录、翻译过程相关的蛋白共有8 个,其中3 个蛋白(酶)与DNA 的修复过程有关[A/G 特异性腺嘌呤糖基化酶(A/G-specific adenine glycosylase),ATP 依赖性核酸酶亚基B(ATP-dependent nuclease subunit B)以及调控蛋白 recX(regulatory protein recX),分别上调1.401,1.456 和1.367 倍],同时还有2 个与应激反应相关的蛋白[蛋白酶HtpX 同源物(Protease HtpX homolog)和广谱应激蛋白UspA 家族(universal stress protein UspA family)]表达量也显著上升(分别为1.52 和1.55 倍),说明在锰离子缺乏的情况下,乳酸菌的代谢出现了异常现象。
为了更好地了解锰离子缺乏对乳酸菌代谢的影响,将56 个差异表达蛋白进行GO(Gene Ontology)富集分析和KEGG 代谢通路分析,结果如下。

图1 发酵6 h 差异蛋白GO 功能注释结果Fig.1 GO function annotation results of differentially expressed proteins after fermentation for 6 h
以显著性检验的P 值为指标对富集结果进行排序,其中差异蛋白参与的生物学过程中最为显著的过程分别为翻译(translation,8 个基因)、错配修复(mismatch repair,3 个基因)、细胞移动(cell motility,2 个基因)、温度应激响应(response to stimulus,2 个基因)和精氨酸合成代谢(arginine biosynthetic process,2 个基因)。而从分子功能角度,排名前五的分别是核糖体结构(structural constituent of ribosome,8 个基因)、氨甲酰基-磷酸合成酶(carbamoyl-phosphate synthase,3 个基因)、核糖体RNA 结合(rRNA binding,6 个基因)、小核糖体亚基rRNA 结合(small ribosomal subunit rRNA binding,3 个基因)和丁二胺跨膜转运蛋白活性(putrescine transmembrane transporter activity,2个基因)。
Pathway 的综合分析可以使我们对生物学网络和生物学过程进行整体分析,对于弥补蛋白质组和转录组学检测分析技术的局限性有很大帮助[12-13],使用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)Pathway 数据库对发酵6 h 的乳酸菌胞内差异蛋白进行通路富集,结果发现在α=0.05 的显著水平下,只有核糖体(ribosome)的代谢通路产生了显著性变化,而丙氨酸-天冬氨酸盐-谷氨酸盐代谢通路(Alanine,aspartate and glutamate metabolism)在α=0.1 的水平下差异显著(P=0.070)。

表2 发酵6 h 后差异表达蛋白的Pathway 分析Table 2 Pathway analysis based on differentially expressed proteins after fermentation for 6 h
综合上述分析结果可以看出,锰离子缺乏会对蛋白质合成产生显著的抑制作用,影响乳酸菌的蛋白质代谢。同时,在锰离子缺乏的情况下,乳酸菌处于不正常的生长状态,细胞内与错配修复和应激反应相关的蛋白质含量显著上升。
2.3 发酵9 h 差异蛋白的GO 及KEGG 分析
发酵9 h 后,植物乳杆菌发酵进入对数生长末期,在此阶段共检测出78 个差异蛋白,其中上调蛋白40 个,下调蛋白38 个。
Daly等[14]认为耐辐射球菌细胞内高浓度的锰离子能保护其细胞内的蛋白质不受氧化,从而使其存活率提高。在培养基中缺乏锰离子的情况下,乳酸菌胞内锰离子转运蛋白(manganese transport protein)的表达量提高了4 倍左右,是胞内蛋白中表达量提高最为显著的蛋白之一,这说明在缺乏锰离子的情况下,乳酸菌必须过量地表达该蛋白以加快锰离子的运输。参与复制、转录、翻译过程的蛋白共有5 个出现了上调,其中3 个蛋白(酶)与DNA 的修复过程有关,同时还有2 个与应激反应相关的蛋白表达量也显著上升,这一结果与发酵6 h 的规律相一致,说明锰离子缺乏会导致乳酸菌的代谢处于不正常状态。
与核糖体结构相关的蛋白有3种下调,而与转录、复制、翻译相关的酶和蛋白有12种下调,其中大多属于转录或翻译的调控因子。
为了更好地了解锰离子缺乏对乳酸菌代谢的影响,将78 个差异表达蛋白进行GO 富集分析和KEGG 代谢通路分析,结果如下。
从GO 分析的结果来看,差异蛋白参与的生物学过程中最为显著的过程分别为脂肪酸合成(fatty acid biosynthetic process,6 个基因)、金属离子运输(metal ion transport,3 个基因)、锰离子运输(manganese ion transport,2 个基因)、镉离子运输(cadmium ion transport,2 个基因)、温度应激响应(response to temperature stimulus,2 个基因)和脂肪酸代谢(fatty acid metabolic process,3 个基因)。从分子功能角度,排名前五的分别是乙醇脱氢酶(NAD)活性[alcohol dehydrogenase(NAD)activity,8 个基因]、二氢叶酸合酶活性(dihydrofolate synthase activity,2 个基因)、四氢叶酸聚谷氨酸合酶活性(tetrahydrofolylpolyglutamate synthase activity,2 个基因)、脂肪酸合成过程中ACP 磷酸泛素附着位点结合(ACP phosphopantetheine attachment site binding involved in fatty acid biosynthetic process,2 个基因)和3-辛烯基-4-羟苯酸盐羧酸分解酶活性(3-octaprenyl-4-hydroxybenzoate carboxy-lyase activity,2 个基因)。
使用KEGG Pathway 数据库对发酵9 h 的乳酸菌胞内差异蛋白进行通路富集分析,结果如表3所示。从富集结果可以看出,发酵9 h 后,多条与胞内代谢相关的通路产生了显著变化,除了奈和氯烷烃降解通路外,丙酮酸代谢、酪氨酸代谢、脂肪酸降解、糖异生和糖酵解途径等通路均产生了明显的变化。
与发酵6 h 的样品相比,发酵进行到平台期时,差异蛋白主要参与胞内的碳、氮及脂肪酸等代谢通路,说明其影响主要集中在胞内代谢方面。
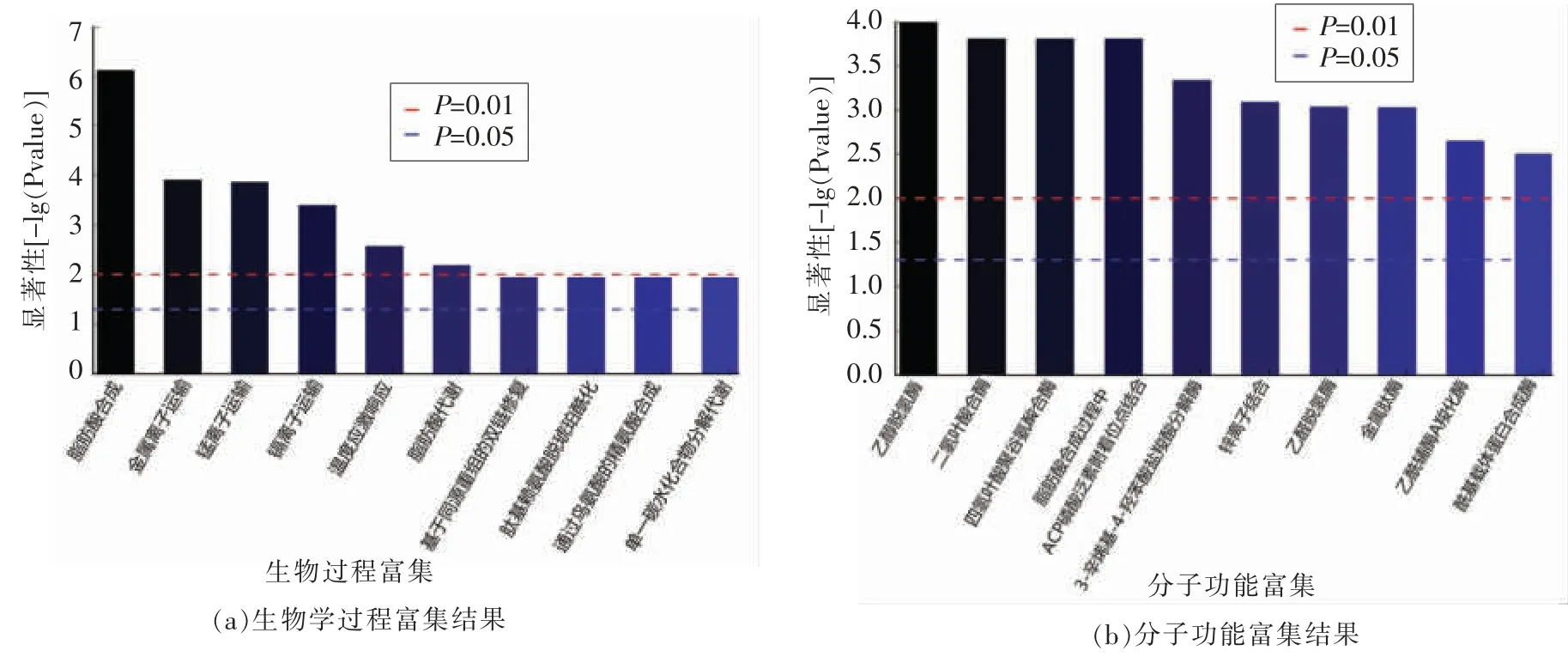
图2 发酵9 h 差异蛋白GO 功能注释结果Fig.2 GO function annotation results of differentially expressed proteins after fermentation for 9 h
2.4 共有差异蛋白分析
研究在整个发酵过程中持续性表现出差异的蛋白更加有助于考察锰离子对乳酸菌代谢的影响。统计发酵6 h 和9 h 的共有差异蛋白,结果如表4所示。2 个发酵时间点共有16种蛋白均表现出显著性差异,其中有6种蛋白在缺乏锰离子的情况下持续下调,7种蛋白在缺乏锰离子的情况下持续上调,A/G 特异性腺嘌呤糖基化酶(A/Gspecific adenine glycosylase)和rRNA 甲基化酶(rRNA methylase)在发酵6 h 因锰离子的缺乏而下调,但发酵9 h 后又产生上调趋势;未知蛋白(hypothetical protein)lp_0158 在发酵6 h 随锰离子缺乏而下调,但在发酵9 h 后又产生上调趋势。
UspA 家族蛋白主要参与生物体的应激反应,一般在微生物生长受到抑制或细胞受损的情况下会大量表达[15-16],从表4 中可以看出,该蛋白在发酵6 h 和发酵9 h 都属于上调幅度最大的蛋白之一,特别是在发酵9 h 的表达量增加了近5 倍,说明锰离子的缺乏造成细胞状态的严重不正常;同时胞内参与DNA 修复过程的ATP 依赖性核酸酶表达量也持续上升,再次说明锰离子缺乏对乳酸菌的DNA 复制乃至整个菌体都可能造成严重的损伤。
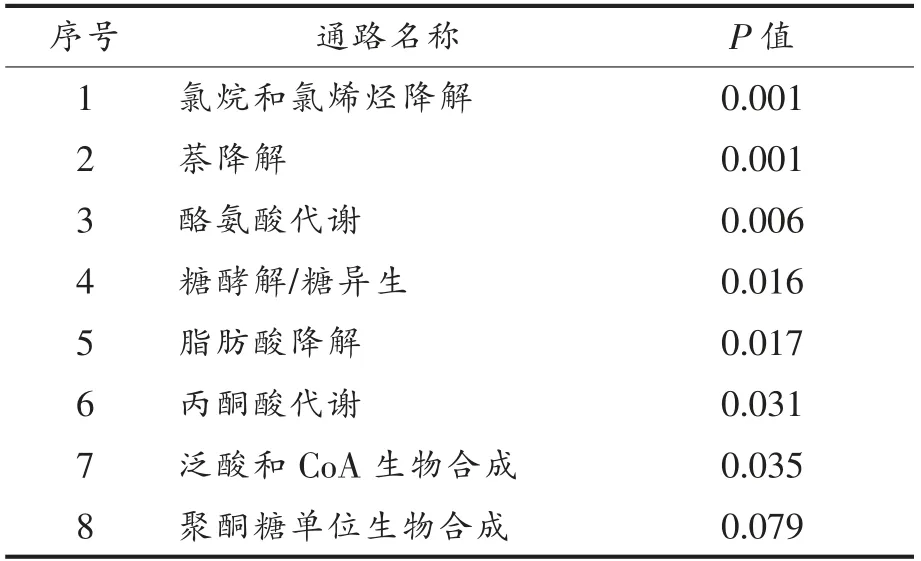
表3 发酵9 h 后差异表达蛋白的Pathway 分析Table 3 Pathway analysis based on differentially expressed proteins after fermentation for 9 h
A/G 特异性腺嘌呤糖基化酶主要起到DNA的N-端糖基化功能,参与DNA 的修复过程[17],这个酶在发酵初期随着锰离子的缺乏而上调,但在发酵后期又出现下调趋势,但此时ATP 依赖性核酸酶等同样参与修复的蛋白表达量上升,说明DNA 的修复途径可能在发酵后期发生改变。而rRNA 甲基化酶主要参与RNA 的甲基化过程,是一种参与基因表达微调控的酶[18-19],与多种胁迫环境的产生密切相关[20]。本研究结果表明植物乳杆菌胞内rRNA 甲基化酶在发酵6 h 随着锰离子的缺乏而表达上调,而在发酵9 h 时又产生下调趋势。
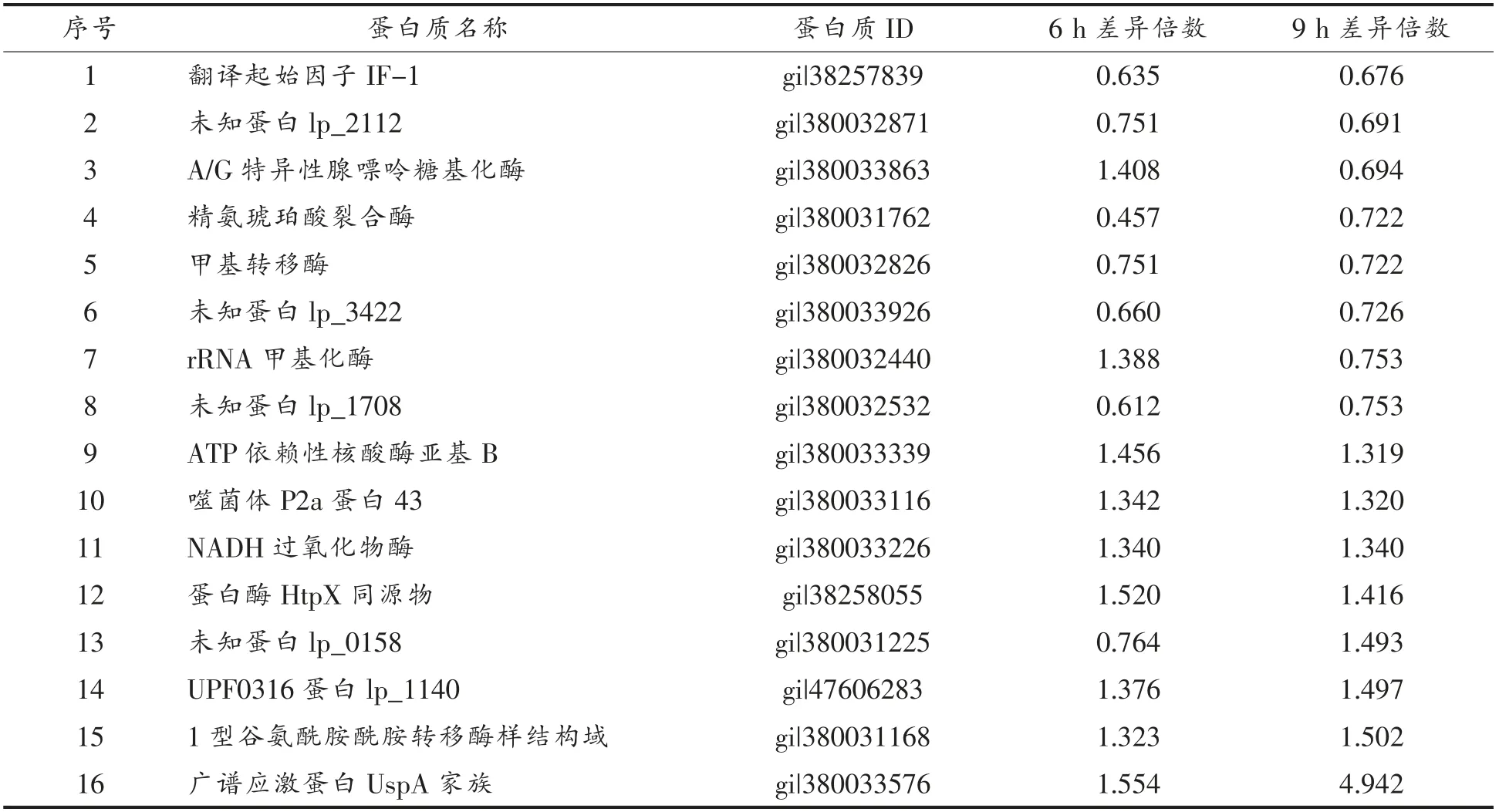
表4 发酵6 h 和9 h 后共有差异蛋白Table 4 Identification of the common differential proteins after fermentation for 6 h and 9 h
在发酵过程中因锰离子缺乏而持续上调的已知功能蛋白还包括NADH 过氧化物酶等3种蛋白,其中NADH 过氧化物酶主要参与生物体内氧化-还原平衡,UPF0316 蛋白lp_1140是生物体细胞膜的结构蛋白之一,1 型谷氨酰胺酰胺转移酶样结构域主要参与谷氨酰胺的代谢,是微生物体内重要的氨基酸代谢蛋白之一。
在发酵过程中随着锰离子缺乏而持续下调的蛋白有6种,其中功能确定的共有3种,精氨琥珀酸裂合酶、甲基转移酶和翻译起始因子IF-1。其中精氨琥珀酸裂合酶主要参与精氨酸的合成代谢,甲基转移酶主要参与核酸的甲基转移,翻译起始因子IF-1 则是翻译过程的起始因子。
为了更好地考察这些差异蛋白在微生物体内参与的代谢通路,对共同差异蛋白进行KEGG Pathway 分析,显著水平在α=0.1 的代谢通路如表5所示。

表5 共有差异表达蛋白的Pathway 分析Table 5 Pathway analysis based on differentially expressed proteins
从表5 中可以看出,在α=0.1 的水平上,锰离子的添加对丙酮酸代谢通路的影响均极显著。与此同时,锰离子添加对丙酸代谢、丁酸甲酯代谢和丙氨酸-天冬氨酸盐-谷氨酸盐代谢通路等代谢途径也有显著影响。这些途径与丙酮酸代谢通路一样,都是生物体内重要的基础代谢途径,而且这些代谢通路之间都存在密切关联,说明锰离子对乳酸菌胞内代谢通路起到重要的调节作用,而且这一影响的范围不仅局限于胞内葡萄糖代谢途径[8],还会对氨基酸、有机酸等物质的合成与代谢产生重要影响。
从代谢通路分析中还可以看出,碱基切除修复和同源重组2 个与DNA 复制相关的代谢通路均发生了较为显著的变化,锰离子的存在有助于提高菌体对氧化等外界损伤的耐受性,提高菌体的抗逆性,这一点与以往的文献报道是一致的。
3 讨论
锰是生命体必需元素,是具有多种重要生理功能的酶的组成部分,如锰超氧化物歧化酶、锰过氧化氢酶、精氨酸酶、丙酮酸羧化酶等[21]。Martin等[22]的研究表明,适当的锰稳态对肺炎链球菌的细胞生长至关重要;Kubicek等[23]的研究表明,在锰的存在下,黑曲霉细胞生长会增加,但糖消耗减少,酸生成急剧减少,而在锰离子缺乏的情况下,黑曲霉胞内除了柠檬酸合成酶以外,其它三羧酸循环的关键酶以及细胞的合成代谢均会产生抑制,而这种抑制与糖消耗的速率显著相关。但过量的锰离子对细胞也有相当大的毒害作用,细胞内的谷氨酸(Glu)会由于锰离子过量累积而明显增高,细胞外谷氨酰胺(Gln)明显降低,影响“谷氨酸-谷氨酰胺循环”,导致对生物体的伤害[24]。课题组前期研究结果表明,在锰离子缺乏的情况下,乳酸菌发酵活力会受到显著的影响,同时与三羧酸循环相关的酶活均会受到一定的抑制[8]。而本研究结果进一步表明,在发酵进行至对数生长期时,锰离子缺乏会造成核糖体结构蛋白合成通路显著受到抑制,而这可能与包括RNA 聚合酶在内的许多酶活性需要锰离子参与有关[25]。而当发酵进行至对数生长末期时,锰离子缺乏主要影响乳酸菌的碳、氮等代谢通路。丙酮酸代谢、脂肪酸降解等多条代谢通路会由于锰离子的缺乏而受到显著影响。
锰离子的存在对于生物体的抗氧化系统及应激反应系统至关重要[26]。当微生物处在胁迫环境(如酸胁迫、胆盐胁迫等)下时,应激蛋白质通常被诱导表达,并在基因和蛋白质的表达和修复过程中起着至关重要的作用[27]。Horsburgh等[28]的研究表明,适当浓度锰离子的存在改善了各种微生物耐受氧化应激的能力,在外界胁迫的条件下,细胞会大量运输锰离子进入细胞内,从而激活其抗氧化系统的活性。而这种效应主要是由于其金属化单核酶的能力相关,而非通过清除过氧化物来保护过氧化物应激细胞[29]。从本研究结果可以看出,乳酸菌胞内与DNA 修复和应激反应相关的蛋白表达量随着锰离子的缺乏而显著升高,说明此时菌体处于不正常生长状态。
综上所述,本研究利用iTRAQ 技术比较分析了锰离子缺乏对植物乳杆菌蛋白表达的影响,试验结果表明,锰离子缺乏主要影响乳酸菌胞内蛋白的合成代谢,同时会使乳酸菌处于不正常的生理状态,DNA 修复系统和与应激反应相关的蛋白表达量会显著上升。而这一状态与乳酸菌的生理代谢之间的细致关联则有待进一步研究。
