高产类胡萝卜素的蛹虫草固体发酵体系研究
2020-10-16左泽红叶志伟简锦辉林俊芳郭丽琼
左泽红 叶志伟 简锦辉 万 华 林俊芳 郭丽琼* 云 帆
(1 华南农业大学食品学院 广州510642 2 华南农业大学数信学院 广州510642 3 广东省微生态制剂工程技术研究中心 广州510642 4 广州市澳键丰泽生物科技股份有限公司 广州510530)
蛹虫草是一种珍贵的药用真菌,富含多种生物活性物质,如虫草多糖、虫草酸、虫草素和腺苷等[1],具有抗癌、抗肿瘤、抗炎症、免疫调节、抗氧化和抑菌等多种药理作用[2]。研究表明,蛹虫草呈黄色或橙黄色是因为体内类胡萝卜素的积累[3]。类胡萝卜素是由类异戊二烯单位组成的碳氢化合物及其氧化衍生物的总称,同样具有抗炎、抗癌以及抗氧化等功效[4]。现今发现的类胡萝卜素绝大部分是脂溶性类胡萝卜素,人体难以直接吸收利用且大部分遇光和热不稳定[5-6]。蛹虫草中的类胡萝卜素有叶黄素[7]、玉米黄素[8]和北虫草黄素[9],前2 者属于脂溶性类胡萝卜素,而后者具有很强的亲水性,并且其含量占蛹虫草中总类胡萝卜素含量的86.7%。与传统类胡萝卜素相比,其理论上具有更强的生理活性,能更好地被人体吸收并且生物利用度更高。固体发酵技术具有成本低,易于管理,后处理设备少等优点,是一种经济、环保、有效的生产方式[10],广泛应用于各种生物活性成分的生产,然而,通过固体发酵技术生产类胡萝卜素的方式还未曾报道。本研究采用固体发酵技术,通过筛选出的蛹虫草菌株建立了一套蛹虫草高产类胡萝卜素固体发酵体系,为今后开发利用蛹虫草中水溶性类胡萝卜素提供科学数据。
1 试验材料
1.1 试验菌株
蛹虫草菌种CM04,保藏于广东省微生物制剂工程技术研究中心;CM09,购自北京吉蕈园科技有限公司;CM10,购自宁阳县海鑫生物科技有限公司。
1.2 试验试剂
琼脂、葡萄糖、磷酸二氢钾、蛋白胨、硫酸镁、无水乙醇,购自广州成硕生物工程有限公司。
1.3 仪器与设备
2 试验方法
2.1 蛹虫草培养方法
1)活化 将斜面或-80 ℃保存的原始菌株接种到PDA 固体平板培养基上,25 ℃恒温遮光培养至菌丝长满培养皿,然后光照使其转色,得到活化的菌种。
2)种子液的制备 在活化好长满黄色菌丝的平板上,取3~4 块黄豆粒大小的菌丝块接种于PDA 液体培养基中,在25 ℃、150 r/min 条件下振荡培养4~5 d,待长满菌丝球后可用于接种。
3)固体发酵 在组培瓶中加入按培养基配方准确称取的各类谷物,加自来水充分搅拌均匀,121 ℃高压灭菌40 min,冷却至室温后接种25%的蛹虫草种子液,25 ℃暗培养7 d,打开光照,20℃继续培养7 d 促使其转色,产生类胡萝卜素。
2.2 蛹虫草类胡萝卜素的提取及测定
将长满蛹虫草黄色菌丝的培养基质于55 ℃下烘48 h,粉碎后过30 目筛。称取一定量的样品,按料液比1∶20 加入60%的乙醇作为提取剂,25℃浸提过夜,8 000 r/min 离心10 min,上清液即类胡萝卜素粗提取液,在波长470 nm 处测吸光值,类胡萝卜素含量根据式(1)计算。

式中,A——吸光度;V——60%乙醇用量/mL;D——提取液稀释陪数;E——消光系数(0.16);W——样品干重/g。
2.3 固体发酵培养基的优化
以大米为对照培养基配方CK,以蛹虫草生长最适C/N 比20∶1 为原则,以大米、小麦、大豆、麸皮和玉米为培养料,根据各谷物原料的碳氮比[11],设计各培养基配方(见表1),以类胡萝卜素的含量为响应值确定最佳发酵培养基配方。
2.4 固体发酵条件的优化
蛹虫草的生长分为2 个阶段:第1 阶段是黑暗培养阶段,此阶段不需要光,因为光会抑制菌丝生长;第2 阶段是光照培养阶段,只有在光的作用下才能转色,产生类胡萝卜素或长出子实体。本试验根据蛹虫草的具体生长情况,分2 个阶段优化蛹虫草产类胡萝卜素的发酵条件。
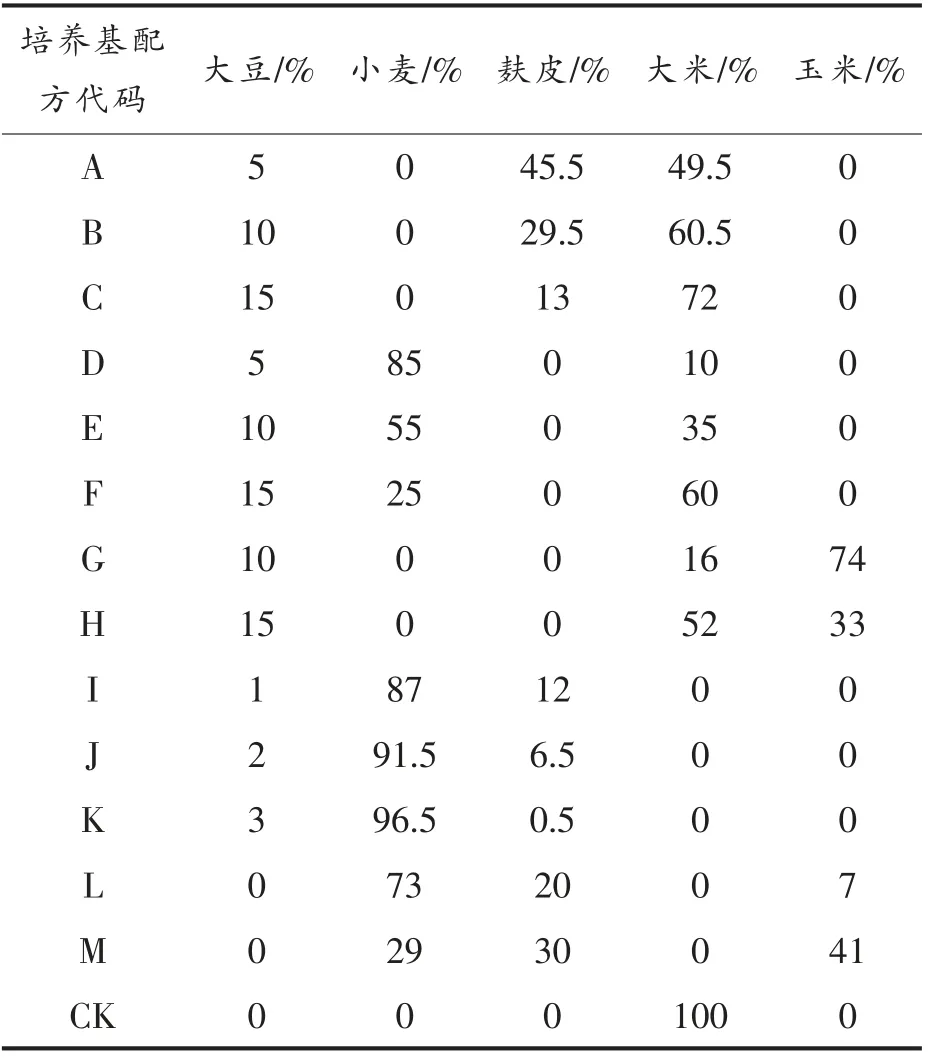
表1 各培养基配方的原料组成Table 1 Raw material composition of each medium
2.4.1 第1 阶段不同发酵条件对蛹虫草产类胡萝卜素的影响 以小麦(73%)、麸皮(20%)、玉米(7%)为培养基配方,研究不同基质颗粒度(0,10,30,50,70 目)、初始含水量(33%,50%,60%,67%,71%)、pH 值(4,5,6,7,8)、接种量(5%,15%,25%,35%,45%)、黑暗培养时间(5,7,9,11,13,15 d)、黑暗培养温度(20,22,25,28,30 ℃)、装料量(10,15,20,2,30 g)等条件对蛹虫草CM10 产类胡萝卜素的影响。其中,确定蛹虫草初始发酵条件为:基质装料量20 g,培养基质颗粒度0 目(即不粉碎过筛),初始含水量60%,培养基自然pH 值,接种量25%,黑暗培养时间7 d,黑暗培养温度25℃,光照温度20 ℃,光照时间7 d。固体发酵时,改变其中某一因素,待发酵结束后测定类胡萝卜素含量,根据单因素结果研究各因素对蛹虫草产类胡萝卜素的影响。
还有一些矛盾的产生是由于工作责任的划分,我所在的设备科室一向工作内容是设计石油天然气现场的各种梯子平台等,然而实际上一些梯子与平台并不完全适合于我们设备专业单独完成,有的需要土建专业的配合,但是由于专业科室之间相互不信任的情况,这种类似的问题得不到有效合理的支持,一些设计可能需要较长时间的沟通,并召开多次会议,得到相关部门裁决的支持,才能得到有效的配合。这些工作都大大增加了一个正常设计工程的工作量,大量人力物力耗费在无意义的内部争议中,降低了工作效率。
2.4.2 响应曲面法(RSM)优化类胡萝卜素发酵条件 在单因素试验的基础上,确定基质颗粒度、初始含水量和黑暗培养时间的范围,以类胡萝卜素的含量为响应值,通过响应面曲面分析优化发酵条件,试验因素水平见表2。

表2 发酵条件Box-Behnken 因素和水平Table 2 Box-Behnken factors and levels of fermentation conditions
2.4.3 第2 阶段不同发酵条件对蛹虫草产类胡萝卜素的影响 第2 阶段影响蛹虫草产类胡萝卜素的主要因素是光照温度和光照时间,因此,在第1阶段最优条件的基础上研究了蛹虫草在不同光照温度(20,22,25,28 ℃)下随光照时间增加时类胡萝卜素含量的变化。
2.5 数据处理
使用Origin 8.5 软件处理数据和作图,使用IBM SPSS Statistics 21 软件分析数据的显著性,使用Design Expert 8.0 软件进行多元回归和方差分析。
3 结果与分析
3.1 发酵培养基
蛹虫草CM04,CM09,CM10 在各培养基配方中类胡萝卜素的产量如表3所示。蛹虫草CM04在配方D 中类胡萝卜素产量最高,达到199 μg/g,相对于对照组CK(110 μg/g),类胡萝卜素产量明显提高;蛹虫草CM09 在配方L 中类胡萝卜素产量最高,达到201 μg/g,是对照组CK(51 μg/g)产量的4 倍;蛹虫草CM10 在配方L 中类胡萝卜素产量最高,达到285 μg/g,是对照组CK(95 μg/g)产量的3 倍。最终选取蛹虫草CM10 和其最优培养基配方L(小麦73%、麸皮20%、玉米7%)优化蛹虫草固体发酵条件。

表3 蛹虫草CM04,CM09,CM10 在各培养基中产类胡萝卜素含量Table 3 Carotenoid content of Cordyceps militaris CM04,CM09 and CM10 in each medium
3.2 优化的固体发酵条件
3.2.1 第1 阶段不同发酵条件下菌株类胡萝卜素产量
1)使用L 培养基配方,在保持基质装料量20 g,初始含水量60%,自然pH,接种量25%,黑暗培养时间7 d,黑暗菌丝培养温度25 ℃,光照温度20 ℃,光照时间7 d等条件不变的情况下,基质粒度对蛹虫草CM10类胡萝卜素产量的影响如图1a所示。当基质粒度为10 目时,类胡萝卜素产量达到最大值。0 目时虽然菌丝生长较快,但对基质的利用有限,如玉米等颗粒度较大的基质很难被利用。基质粒度超过30 目,达到50 目和70 目时,培养基易结块,菌丝不能完全吃透,只能在培养基表面生长,类胡萝卜素产量也随之降低。最终,选取10 目作为最佳基质粒度。
2)使用L 培养基配方,在保持基质装料量20 g,基质粒度0 目(即不粉碎过筛),自然pH,接种量25%,黑暗培养时间7 d,黑暗菌丝培养温度25 ℃,光照温度20 ℃,光照时间7 d等条件不变的情况下,基质初始含水量对蛹虫草CM10类胡萝卜素产量的影响如图1b所示。随着基质初始含水量增加,类胡萝卜素产量先增后减。当含水量为50%时,类胡萝卜素的产量达到最大值。一般来说,水分不足,基质过于干燥,导致菌丝生长不良;水分过高,由于重力作用,培养基质颗粒密度小的易粘成团,影响发酵,故过高或过低的基质初始水分含量均会导致类胡萝卜素产量量降低[12]。最终选取50%作为基质最佳初始含水量。
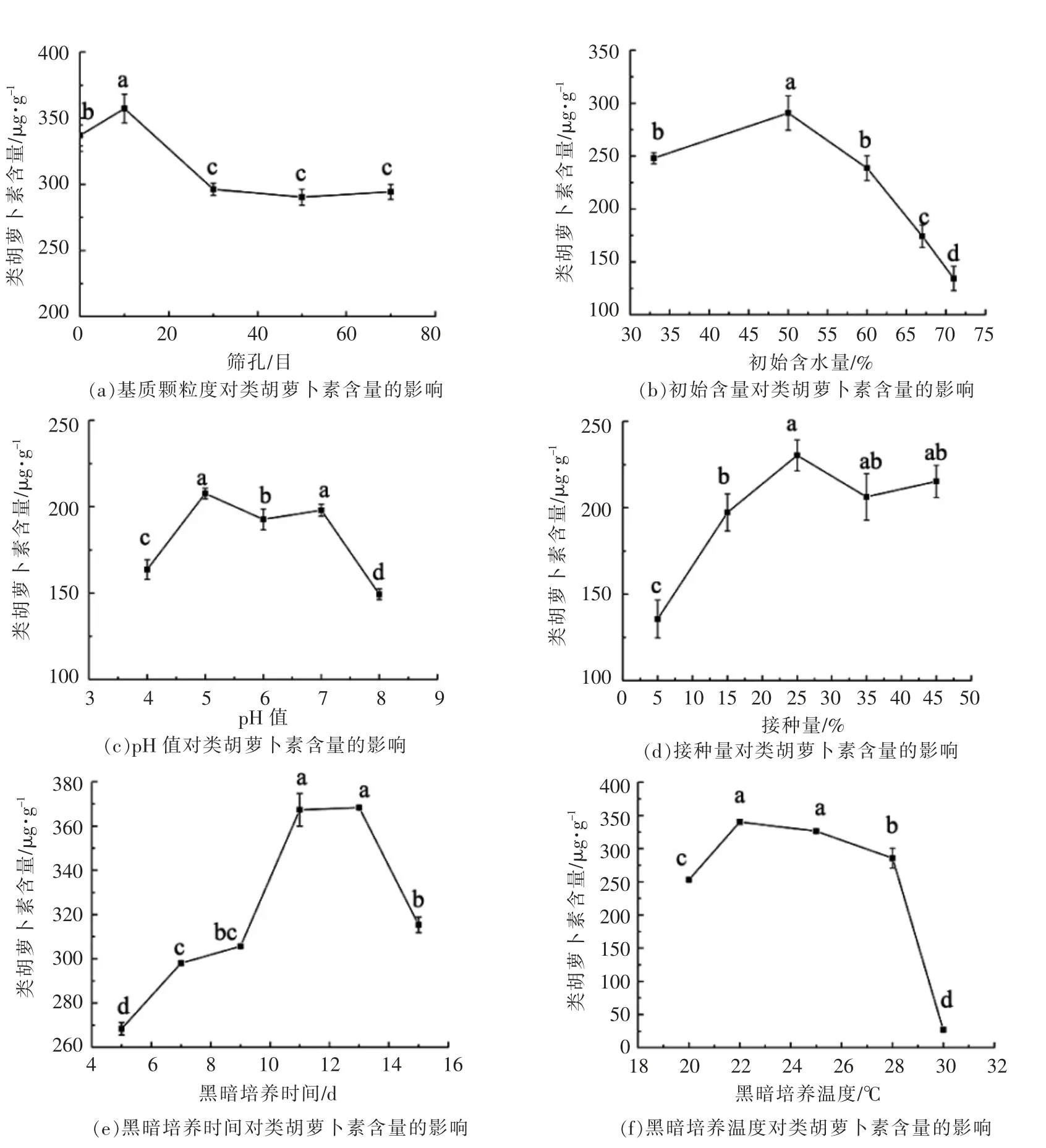
图1 第1 阶段不同发酵条件对蛹虫草类胡萝卜素产量的影响Fig.1 Effects of different fermentation conditions on the carotenoid yield of Cordyceps militaris in first stage
3)使用L 培养基配方,在保持基质装料量20 g,基质粒度0 目,初始含水量60%,接种量25%,黑暗培养时间7 d,黑暗菌丝培养温度25℃,光照温度20 ℃,光照时间7 d等条件不变的情况下,基质初始pH 对蛹虫草CM10类胡萝卜素产量的影响如图1c所示:当pH 为4 或8 时,类胡萝卜素产量相对较低。当pH 为5 和7 时,类胡萝卜素产量达到最大值。pH 为6 时虽与pH 值为5 和7 差异显著,但也仅比二者少8%和3%。在不调节pH 值的情况下,培养基的自然pH 处于6~7 之间。Xie等[13]的研究表明蛹虫草在固体培养时菌丝生长最适pH 为6.2。故综合考虑,蛹虫草固体发酵产类胡萝卜素过程中无需调节基质初始pH,保持自然pH 即可。
4)使用L 培养基配方,在保持基质装料量20 g,基质粒度0 目,初始含水量60%,自然pH,黑暗培养时间7 d,黑暗培养温度25 ℃,光照温度20 ℃,光照时间7 d等条件不变的情况下,接种量对蛹虫草CM10类胡萝卜素产量的影响如图1d所示。当接种量从5%增加到25%时,类胡萝卜素的产量随之增加。当接种量大于25%时,类胡萝卜素的产量呈下降趋势,可能是因为接种量过大,菌丝过快生长,使得基质难以提供充足的营养供发酵后期生产类胡萝卜素。最终选取25%作为最佳接种量。
5)使用L 培养基配方,在保持基质装料量20 g,基质粒度0 目,初始含水量60%,自然pH,接种量25%,黑暗培养温度25 ℃,光照温度20℃,光照时间7 d等条件不变的情况下,菌丝黑暗培养时间对蛹虫草CM10类胡萝卜素产量的影响如图1e所示。随着黑暗生长时间的增加,类胡萝卜素的产量也不断增加。当菌丝黑暗生长到13 d时,类胡萝卜素产量达到最大值。若继续增加黑暗培养时间,类胡萝卜素的产量开始下降,可能是因为此时菌丝已到衰亡期,分泌次级代谢产物类胡萝卜素的能力急剧下降。根据显著性分析结果可知,黑暗培养11 d 和13 d 的类胡萝卜素产量没有显著性差异,因此为减少培养时间,选取11 d 作为最适菌丝黑暗培养时间。
6)使用L 培养基配方,在保持基质装料量20 g,基质粒度0 目,初始含水量60%,自然pH,接种量25%,黑暗培养时间7 d,光照温度20 ℃,光照时间7 d等条件不变的情况下,菌丝黑暗生长温度对蛹虫草CM10类胡萝卜素产量的影响如图1f所示。当温度为22 ℃时,类胡萝卜素的产量达到最大值。随着温度逐渐升高,类胡萝卜素的产量也逐渐降低,并且在30 ℃时达到最低值,此时菌丝生长受到抑制。最终,选取22 ℃为菌丝最佳黑暗生长温度。
7)使用L 培养基配方,在保持基质粒度0目,初始含水量60%,自然pH,接种量25%,黑暗培养时间7 d,黑暗培养温度25 ℃,光照温度20℃,光照时间7 d等条件不变的情况下,装料量对蛹虫草CM10类胡萝卜素产量的影响如表4所示。当装料量为15 g 时,类胡萝卜素的单位产量最高。随着装料量增加,类胡萝卜素单位产量逐渐降低。虽然装料量为15 g 时类胡萝卜素的单位产量最高,但此时收集的样品总量不多,而根据类胡萝卜素理论总量,得出装料量为25 g 时类胡萝卜素总量最高。最终,选取25 g 为最适装料量。

表4 不同装料量条件下蛹虫草类胡萝卜素的产量Table 4 The yield of carotenoid of Cordyceps militaris under different loadings conditions
3.2.2 响应面Box-Behnken 设计优化的试验结果根据表5 试验结果,采用Design-Expert 8.0 软件进行回归分析,得到响应面二次多元回归方程:Y = 286.20 - 7.12A- 16.75B + 9.13C - 14.25AB -8.50AC+6.25BC-28.85A2-36.10B2-15.85C2。对该模型进行方差分析,结果如表6所示。模型F=4.78,P=0.0256<0.05,说明模型显著;失拟项P=0.2996>0.05,说明模型失拟项不显著;决定系数R2=0.8601,说明模型与实际情况拟合程度较好;显著的模型项为B、A2、B2(P<0.05);因素F 关系为F(B)>F(C)>F(A),说明3 个因素对蛹虫草类胡萝卜素产量的影响由大到小依次为基质初始含水量、黑暗菌丝培养时间和基质颗粒度。根据软件分析得到第1 阶段蛹虫草固体发酵产类胡萝卜素的最佳培养条件为:基质颗粒度为10 目,基质初始含水量为47.88%,黑暗培养时间为12.49 d。结合实际情况,确定下一步最佳固体发酵条件为:基质颗粒度10 目,基质初始含水量48%,黑暗培养时间12 d。

表5 响应面Box-Behnken 设计优化分析方案和试验结果Table 5 Optimization analysis scheme and test results of response surface Box-Behnken design

表6 回归方程的方差分析Table 6 Analysis of variance of regression equation
采用软件Design-Expert 进行二次多元回归拟合,得到的响应面图及等高线图(图2)。由图2a可知:黑暗培养时间一定时,响应曲面的等高线稀疏和坡度缓和,表明类胡萝卜素含量受基质粒度和初始含水量交互作用的影响最弱。从图2b可知:当初始含水量一定时,响应曲面的等高线较密集和坡度较陡,表明类胡萝卜素含量受黑暗培养时间和基质粒度交互作用最强。从图2c可知:当基质粒度一定时,响应曲面的等高线稀疏,表明类胡萝卜素含量受黑暗培养初始含水量交互作用的影响较弱。

图2 各因素对蛹虫草类胡萝卜素产量影响的响应面图及等高线图Fig.2 Response surface and contour plot showing the effects of various factor on the carotenoids yields of Cordyceps militaris
3.2.3 第2 阶段蛹虫草固体发酵产生类胡萝卜素的发酵条件 使用第1 阶段优化的培养条件,即L 培养基配方,基质装料量25 g,基质颗粒度10目,初始含水量48%,自然pH,接种量25%,黑暗培养时间12 d,黑暗培养温度22 ℃,蛹虫草CM10 在第2 阶段固体发酵产类生胡萝卜素的结果如图3所示。当光照温度为25 ℃时,培养14 d的菌株类胡萝卜素产量达最大值;而在14 d 以后,光照温度为25 ℃时类胡萝卜素产量略有降低,可能是因为此时底物主要被用于蛹虫草子实体的生长。根据本试验结果,选取最适光照温度为25 ℃,最适光照时间为14 d,此时类胡萝卜素产量最高,即346 μg/g。

图3 不同光照温度下光照时间对蛹虫草类胡萝卜素产量的影响Fig.3 Effects of light time on carotenoid yields of Cordyceps militaris at different light temperatures
4 讨论
类胡萝卜素是一类具有多种生物学功能的色素,作为食品添加剂和营养增补剂广泛应用于食品及医疗保健行业中。类胡萝卜素的来源主要有3种形式:植物提取、化学合成和微生物发酵。化学法合成的类胡萝卜素生物活性低且存在质量安全隐患;植物中提取的类胡萝卜素虽然生物活性高,但是提取工艺复杂、产率低;微生物发酵产生的类胡萝卜素产量高、安全性好,是生产类胡萝卜素的最好方法。目前,国内外利用微生物发酵生产类胡萝卜素的菌株有红酵母、三孢布拉霉、分支细菌和短杆菌等,均采用液体发酵的方式,而液体发酵成本高,对设备的要求高。与之相比,固体发酵原料低价易得,工艺简单,成本低。Liu等[14]以茶籽(52.48%)、豆渣(29.38%)和米糠(18.54%)为固体发酵基质,将粗糙脉孢菌和植物乳杆菌混合发酵74.9 h,通过HPLC 在发酵后的基质中鉴定出15种类胡萝卜素。谢爱娣[15]以红酵母菌株D 为发酵菌种,确定了固体发酵生产类胡萝卜素的最佳培养基组分为m啤酒糟︰m豆粕︰m麸皮=1︰3︰2,含水量为60%,添加K2HPO4和MgSO4的质量浓度分别为2.00 g/L 和0.50 g/L;最佳培养条件为豆粕20目,麸皮和啤酒糟混合筛分,装量为20 g/250 mL三角瓶,接种龄为24 h,接种量为15%,自然pH,温度25 ℃培养96 h,在该最优条件下所得类胡萝卜素产量为32 mg/kg。本研究利用可食用的谷物作为培养基,通过筛选出的蛹虫草菌株建立了一套蛹虫草高产类胡萝卜素固体发酵体系,最终产量为346 μg/g。与谢爱娣[15]的研究相比,产量提高了10 倍,并且本研究所选用培养基未添加任何化学试剂,绿色安全,成本低,具有可行性。
光照条件是蛹虫草产类胡萝卜素的一个必要条件。Shrestha等[16]曾报道光是决定蛹虫草菌丝体密度、质地和色素的关键因素,黑暗条件下菌丝体不会产生色素。付鸣佳[3]发现蛹虫草在光照培养下菌落呈橙黄色是由于菌丝中类胡萝卜素的积累所致。影响蛹虫草类胡萝卜素生物合成的光照条件包括光质、光强、光照时间和光照温度等。张金艳[17]研究了光照强度对蛹虫草生产类胡萝卜素的影响,发现随着光照强度的不断增加,蛹虫草类胡萝卜素的产量也随之提高。Dong等[18]的研究发现相较于蓝光和红光,粉光(1/3 蓝光+2/3 红光)更显著促进蛹虫草子实体中类胡萝卜素的积累。本文只研究了光照时间和光照温度对蛹虫草类胡萝卜素产量的影响,并未深入研究光强和光质的影响。在本研究的基础上,通过增加光强或改变光质提高蛹虫草类胡萝卜素的产量,还有待深入研究。
目前,关于蛹虫草类胡萝卜素的提取研究多集中于子实体和菌丝体上,且大多使用丙酮和石油醚等不可食用的有机溶剂[19-20],而关于蛹虫草固体发酵菌粉中类胡萝卜素的提取尚未见报道。本试验采用乙醇浸提法提取蛹虫草固体发酵菌粉中的类胡萝卜素,粗提液经波长扫描后具有类胡萝卜素特征吸收峰,说明浸提出来的物质是类胡萝卜素。本方法简单、实用,提取溶剂乙醇绿色、安全,易被消费者接受。
