CTA联合MRA在颅内动脉瘤诊治中的应用价值*
2020-10-16四川大学华西广安医院神经外科四川广安638500
四川大学华西广安医院神经外科(四川 广安 638500)
王海全 吕光淘 胡海斌周 辉 黄小龙
颅内动脉瘤是一种颅内动脉管壁异常膨出的脑血管疾病,发病率约为3%,是造成自发性蛛网膜下腔出血(SAH)的首位原因,在颅内动脉瘤破裂出血后,会引发脑梗死、血管痉挛等高致残性疾病,超过50%的患者长期遗留神经功能障碍,严重影响患者的身体健康与生活质量[1-2]。颅内动脉瘤起病隐匿,发病原因尚不清楚,临床诊断主要依据术前影像检查结果。多年来数字减影血管造影(DSA)作为颅内动脉瘤筛查与诊断的金标准被广泛应用于颅内动脉瘤的诊断和治疗中,但其具有创伤大、检查时间长、合并症多等缺点[3],临床亟需无创性、诊断准确性能与DSA相当的诊断方法。经颅多普勒超声(TCCS)、磁共振血管造影(MRA)和三维计算机断层血管造影(CTA)等技术是颅内动脉瘤诊断的常规方法[4],当前对MRA和CTA在颅内动脉瘤诊断中的应用价值研究较多,但MRA联合CTA诊治颅内动脉瘤的研究相对少见。因此,本研究分析了MRA联合CTA在颅内动脉瘤诊断中的应用情况,为颅内动脉瘤临床诊断方式的选择提供参考依据。
1 资料与方法
1.1 一般资料 选取本院2017年2月至2019年5月收治的高度疑似颅内动脉瘤患者68例,其中,男41例,女27例,年龄范围35~59岁,平均年龄为(48.73±8.72)岁;所有患者入院后经DSA或手术诊断确诊为颅内动脉瘤。主要临床表现:头痛、呕吐70例,头痛伴意识障碍8例,动眼神经麻痹2例;Hunt-Hess分级:Ⅰ级29例,Ⅱ级27例,Ⅲ级19例,Ⅳ5例;合并其他疾病:糖尿病21例,高血压15例。根据检查方式的不同将患者分为CTA组(38例)和CTA+MRA组(30例)。纳入标准:(1)符合颅内动脉瘤的临床诊断标准[5],且经相关实验室检查、手术及介入检查确诊为颅内动脉瘤;(2)年龄≥18岁;(3)影像学资料及检查结果完整清晰;(4)患者及其家属自愿参加本次研究,签署知情同意书。排除标准:(1)存在既往动脉瘤史;(2)CTA或MRA检查不耐受者。
1.2 检查方法 CTA检查:患者取仰卧位,采用64排螺旋CT(Somatom Definition,德国西门子)对患者进行薄层立体容积扫描。穿刺肘正中静脉后使用ulrich高压注射器注射60~80mL的碘海醇溶液(注射速度4mL/s),扫描范围上下宽径60~120mm,扫描延迟时间10~16s,原始图像的采集在25~30s内完成。完成后采用3D Virtuoso进行三维重建,通过容积重建(VR)、多平面重建(MPR)和曲面重建(CPR)等技术进行血管成像后处理。
MRA检查:利用1.5T Intera全身磁共振成像仪对患者行常规横轴位及矢状位T1WI和T2WI检查;采用3D-TOF MRA扫描,具体扫描参数如下:TE6.9ms,TR25ms,反转角20°,扫描时间7~8min;30 mL钆喷酸葡胺以3mL/s经高压注射器从肘静脉穿刺注入;原始图像通过最大密度投影(MIP)、MPR和VR等技术进行重建,重建体素大小0.312mm,显示病灶位置、大小及形态。
1.3 图像分析 所有CTA及MRA图像均由2名经验丰富的放射科主任医师采用双盲对照分析获得,由1名神经外科医生评估是否存在动脉瘤。分析过程中如有不同意见,经协商后达成一致。记录动脉瘤的位置、大小及类型,对动脉瘤的平均横径和瘤颈宽度进行测量,每个数据测量3次,取平均值。诊断以DSA或手术结果为“金标准”[6],对不同检查方式的检查结果诊断真实性进行分析。
1.4 统计学处理 采用SPSS 20.0统计软件对数据进行分析。计数资料以n(%)表示,组间对比行χ2检验;计量资料以(χ-±s)表示,行t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组不同检查方式的动脉瘤位置及数目比较 68例患者经DSA或手术证实动脉瘤共75个,分布位置及数目为:前交通动脉瘤7个,后交通动脉瘤15个,大脑中动脉瘤28个,颈内动脉瘤11个,基地动脉瘤4个。CTA和CTA+MRA诊断结果如表1所示,CTA+MRA诊断符合率为90.67%(68个/75个)高于CTA的77.33%(58个/75个),差异有统计学意义(χ2=4.960,P=0.026)。
2.2 两组不同检查方式的动脉瘤类型比较 由表2可知,对于不同类型的动脉瘤,CTA和CTA+MRA诊断结果比较,差异无统计学意义(P>0.05)。
2.3 两组不同检查方式动脉瘤的横径和颈宽比较 由表3可知,CTA检测动脉瘤平均直径与CTA联合MRA检测比较,差异有统计学意义(P<0.05);两组不同检查方式检测动脉瘤体颈宽结果比较,差异无统计学意义(P>0.05)。
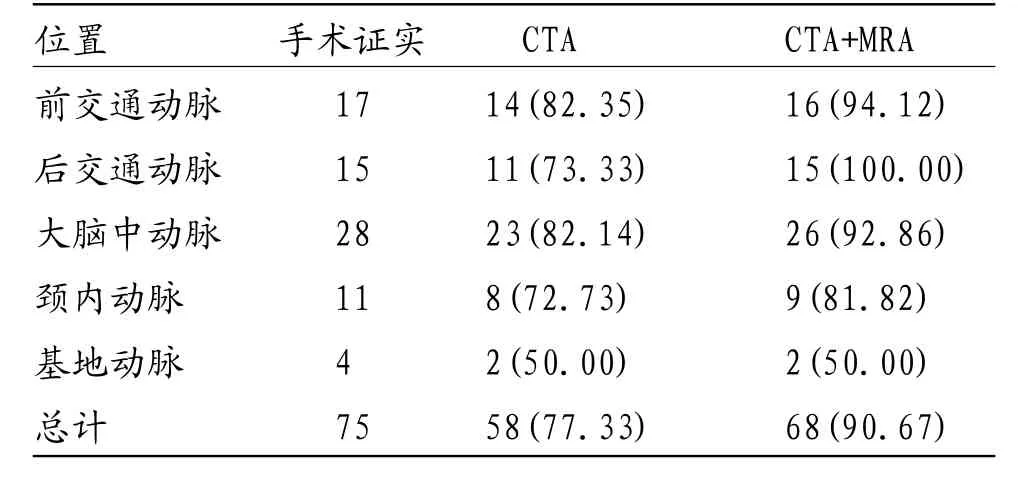
表1 两组不同检查方式的动脉瘤位置及数目比较(n,%)
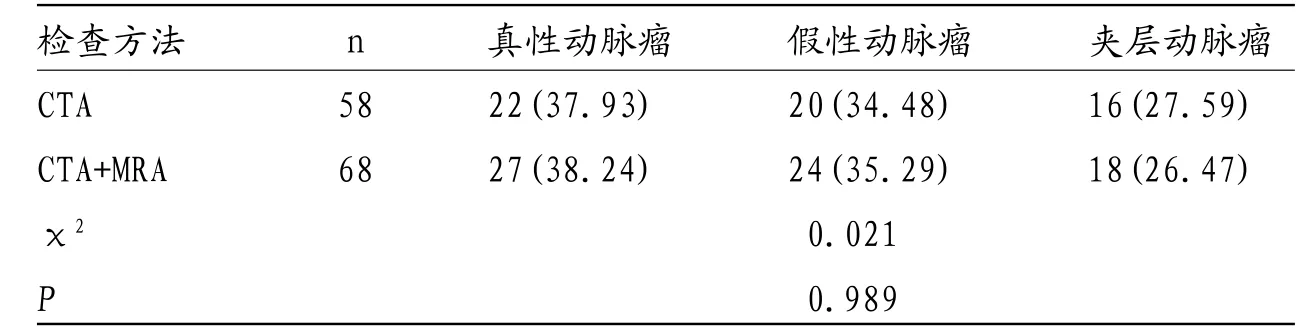
表2 两组不同检查方式的动脉瘤类型比较(n,%)
表3 两组不同检查方式动脉瘤的横径和颈宽比较
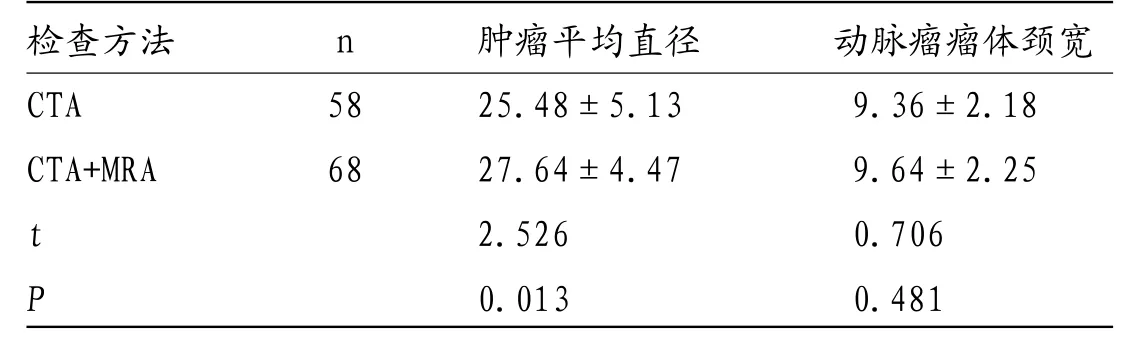
表3 两组不同检查方式动脉瘤的横径和颈宽比较
检查方法 n 肿瘤平均直径 动脉瘤瘤体颈宽CTA 58 25.48±5.13 9.36±2.18 CTA+MRA 68 27.64±4.47 9.64±2.25 t 2.526 0.706 P 0.013 0.481
表4 两组不同检查方式动脉瘤的横径和颈宽比较

表4 两组不同检查方式动脉瘤的横径和颈宽比较
检查方法 n <10mm 10~25mm >25mm CTA 58 21(36.21) 30(51.72) 7(12.05)CTA+MRA 68 36(51.47) 25(36.76) 7(10.29)t 4.176 2.848 0.100 P 0.041 0.091 0.752
2.4 两组不同检查方式对不同体积动脉瘤的检查结果比较75患者经DSA检测出<10mm动脉瘤39个,10~25mm动脉瘤27个,>25mm动脉瘤9个。由表4可知,CTA对不同体积动脉瘤的检查结果与CTA联合MRA检测比较,差异无统计学意义(P>0.05),但在<10 mm动脉瘤的检查方面,CTA联合MRA要优于CTA(P<0.05)。
3 讨 论
颅内动脉瘤是一种致残率和病死率极高的颅内血管病变,临床上对颅内动脉瘤进行早期确诊与治疗对预防动脉瘤破裂、提高患者生存率具有重要价值[7]。当前,DSA为诊断颅内动脉瘤的“金标准”,但由于DSA在分辨动脉瘤的三维形态和空间关系方面存在一定局限性,临床上仍存在漏诊、误诊的情况[8]。CTA和MRA为无创性脑血管成像方法,具有可多方位成像、强大后处理功能而允许任意角度观察血管病变的特点,其临床价值在医学界受到广泛关注与认同。
颅内血管病变的检查目的主要为探明动脉瘤,明确动脉瘤的具体位置、起源及其三维形态和空间关系,指导手术治疗[9],在反映动脉瘤三维形态和空间关系方面,CTA和MRA独具优势。李建等[10]研究了3D-CTA在SAH早期影像诊断中的应用,发现3D-CTA在SAH患者病因诊断准确性方面与3D-DSA相仿,但在颅内动脉瘤的检出率上3D-CTA要高于3D-DSA,具有检查快速、安全性高、无侵袭性等优点。林志军[11]将MRA与CTA应用在腹部内脏动脉瘤的诊断中,发现CTA与MRA在疾病诊断方面具有良好一致性,两种方法均为内脏动脉瘤的有效诊断方法。本研究将CTA联合MRA检查应用在颅内动脉瘤的诊断中,研究结果显示CTA诊断符合率为77.33%,低于CTA联合MRA的诊断符合率90.67%,提示CTA联合MRA检查能提高颅内动脉瘤的诊断准确率。有研究表明,CTA和MRA诊断动脉瘤均依赖于后期图像重建与处理,MIP技术能清晰显示细小血管分支,但容易造成微小动脉瘤的漏诊;MPR能较清晰地显示动脉瘤的形态及结构,对瘤体是否有血栓形成等能准确显示;VR可直观显示瘤体的大小、形态和空间结构等信息,让医师可以从多角度关注动脉瘤的具体情况,为动脉瘤的治疗提供依据[11-12]。本研究CTA和MRA检查均采用了MIP、MPR和VR等技术,结果显示CTA联合MRA测量动脉瘤直径显著高于CTA的测量结果,其原因可能与MRA的分辨率较低,易受颅内微细小血管网血流速度、方向和流量的影响有关[13]。研究结果显示,对于不同类型和不同体积动脉瘤的诊断,CTA和CTA联合MRA检查在诊断结果方面比较,差异无统计学意义,但在<10mm动脉瘤检查方面,CTA联合MRA检出率更高,提示CTA联合MRA对微小动脉瘤的检出能力高于CTA。MRA图像观察角度有限,易受血流速度、类型等因素的影响,一些微小动脉瘤可能难以被显示或被其他血管遮挡,影响其检出率[14],CTA联合MRA诊断能在MRA的基础上提高对微小动脉瘤的检出率,使微小动脉瘤的检出情况更接近DSA检查。
综上所述,CTA联合MRA诊断能提高颅内动脉瘤的诊断符合率,在<10mm动脉瘤的诊断方面效果较好,是颅内动脉瘤的有效检查方法。
