fruitless在桔小实蝇求偶和交配行为中的作用
2020-10-15陈瑶瑶钟国华
陈瑶瑶, 古 枫, 钟国华,*, 易 欣,*
(1.华南农业大学农学院, 农业农村部华南作物有害生物综合治理重点实验室, 广州 510642;2.华南农业大学农学院, 天然农药与化学生物学教育部重点实验室, 广州 510642)
求偶是指交配前雌雄一方为了获得配偶而尽力展现及动作而使另一方做出选择的整个过程(Koganezawaetal., 2016)。而与多数昆虫一样,实蝇也是一类具有求偶行为的昆虫,实蝇通过聚集形成求偶场,且雄成虫间相互竞争以吸引雌成虫;接着雌成虫选择具有最佳求偶行为的雄成虫并与之进行交配(de Aquino and Joachim-Bravo, 2014; Ekanayakeetal., 2017)。在实蝇中,求偶行为通常被划分为几个关键阶段:(1)雄成虫保卫其求偶场避免其他雄成虫侵入,并通过嗅觉、视觉和听觉以吸引雌成虫;(2)雄成虫附近的单个雌成虫降落求偶场并爬向雄成虫;(3)雄成虫感受到雌成虫并进行一次或多次交配的尝试(Robinson and Hooper, 1989)。因此,在昆虫的求偶过程中,雌性和雄性昆虫具有不同的行为表现,被称为性别二态现象(Greenspan and Ferveur, 2000)。这些行为信息受到一系列性别相关基因调控,并表现为受性别二态型神经系统调控。
在众多可以调控交配行为的基因中,fruitless(fru)基因是其中最特殊的一个。fru突变会造成果蝇求偶歌与求偶行为的异常,甚至直接影响交配,导致其不育(Leeetal., 2001; Rideoutetal., 2007)。更有趣的是,fru突变会使得雄性果蝇丧失辨别两性的能力,直接导致的行为便是fru突变的雄成虫聚集在一起形成雄-雄交配链,产生激烈的雄-雄交配行为(Ryneretal., 1996)。研究证明,在果蝇中,fru基因编码转录因子,其中一种可变剪接异构体在雄性性别调控通路中起决定雄性求偶行为的作用(Yamamoto, 2008)。近年来分子生物学的发展使人们对求偶交配行为的调控有了更深层次的了解,特别是针对模式昆虫果蝇和家蚕的研究为我们了解昆虫求偶交配行为的内在机制提供了丰富的数据信息。但昆虫求偶交配行为机制丰富多样,不同昆虫通过不同基因调控求偶和交配行为。桔小实蝇Bactroceradorsalis作为一种对果蔬具有毁灭性影响的重要农业害虫,fru对其求偶交配行为的调控机制尚不明确。
桔小实蝇作为双翅目中重要的经济害虫,对其的研究可为双翅目昆虫以及其他农业昆虫提供重要的参考价值和丰富的数据信息。本研究对NCBI数据进行分析查找,对筛选注释为fru的基因进行克隆验证和鉴定,并对序列蛋白结构域等特征进行分析,最后采用RNAi技术探究该基因是否对桔小实蝇的求偶交配行为发挥作用,从而进一步了解该基因的功能以及桔小实蝇的求偶交配行为。
1 材料与方法
1.1 供试昆虫
本研究所用桔小实蝇在大小为30 cm×30 cm×30 cm的尼龙纱网养虫笼饲养于人工气候培养箱内,并建立室内种群。成虫饲养温度27±0.5℃,光照强度60%,相对湿度70%±5%,光周期14L∶10D。成虫饲料配方为蔗糖∶酵母=3∶1(m/m),蔗糖用粉碎机打成粉末称重,加入相应比例的酵母粉,充分混匀。配制好后放于室温备用,并保证饲料不超过30 d。
用新鲜橙汁倒入布满孔的70 mL离心管中,并将其放入羽化20 d成虫养虫笼中,诱集成虫产卵。8 h后将离心管取出,通过纱布用清水将卵冲洗干净后置入放有饲料的幼虫养虫盒中,并置于人工气候培养箱。幼虫饲料配方:香蕉1 500 g、鲜玉米1 500 g、酵母粉150 g、蔗糖150 g、纤维素150 g、苯甲酸钠6 g、盐酸12 mL、蒸馏水1 250 mL,充分混匀,放入4℃冰箱备用,保证饲料不超过30 d。在羽化3 d内,将雌雄分开饲养,于羽化9 d后进行后续实验。
1.2 桔小实蝇头部RNA的提取和cDNA第1链的合成
摘取桔小实蝇羽化10 d已交配的成虫头部,用液氮将桔小实蝇头部组织速冻,后用自动研磨仪将组织磨碎,并使用Trizol Reagent(TaKaRa)提取组织RNA,于30 μL的无核酸酶水溶解。提取后用1.2%的琼脂糖凝胶检测RNA的质量,并于Spectrophotometer(Thermo Nano DropTM2000c; Santa Clara, 美国)测定RNA的纯度及浓度。根据TaKaRa公司的反转录试剂盒Prime Script RT Reagent Kit with gDNA Eraser合成cDNA第1链,并按照说明书去除基因组DNA。将合成好的cDNA于-20℃储存备用。
1.3 桔小实蝇fru基因的cDNA克隆
NCBI上获得桔小实蝇fru基因cDNA全长序列(GenBank登录号: LOC105224493),并采用Primer Premier 5.0设计两端引物Q-Fru-F和Q-Fru-R(表1),以桔小实蝇头部cDNA为模板进行PCR扩增。PCR扩增体系(50 μL): Buffer 5 μL, dNTPs 5 μL, Mg2+3 μL, KOD酶1 μL, 正反向引物(10 μmol/L)各1.5 μL, cDNA模板1 μL, ddH2O 32 μL。PCR反应条件: 94℃预变性3 min; 98℃ 10 s, 55℃ 30 s, 68℃ 1.45 min, 35个循环;12℃保存。PCR产物用2%琼脂糖凝胶电泳分离并进行胶回收,将回收得到的DNA片段克隆到pMD19-T Vector载体上:DNA片段7 μL, pMD19-T Vector载体 0.3 μL, Solution I 3 μL, 4℃过夜。将混合体系转化到大肠杆菌EscherichiacoliDH5α感受态细胞中,加1 mL LB培养基放置摇床37℃ 180 r/min培养1 h,于超净工作台中取100 μL菌液涂布在含有Ampicilin/X-gal/IPTG的LB固体培养基上,在37℃培养箱中倒置培养12~16 h。蓝白斑筛选后挑取阳性单克隆在1 mL LB液体培养基(含Ampicilin)中培养12~16 h,将培养得到的菌液送往广州擎科生物技术有限公司进行DNA测序。用Megalign软件将测序成功的片段拼接获得桔小实蝇fru基因全长cDNA,将得到的全长序列与NCBI官网上的预测序列进行比对验证。

表1 本研究中所用引物序列
1.4 桔小实蝇fru基因序列分析
将克隆获得的fru基因所编码的氨基酸序列在SMART(http:∥smart.embl-heidelberg.de/)蛋白预测网站上,预测桔小实蝇FRU蛋白的分子量和等电点。在NCBI官网上获得黑腹果蝇Drosophilamelanogaster、冈比亚按蚊Anophelesgambiae的fru编码的氨基酸序列,同时在SilkDB 数据库中获得家蚕Bombyxmorifru编码的氨基酸序列,将其放在SMART蛋白预测网站上,预测蛋白的结构。并用软件DNAMAN进行比对,分析fru基因在进化上是否具有保守性。黑腹果蝇D.melanogaster、冈比亚按蚊A.gambiae、家蚕B.morifru基因的GenBank登录号分别为NM_00127783, AY785361和BGIBMGA006492-TA。
1.5 荧光定量PCR(RT-qPCR)检测
根据桔小实蝇fru序列,用软件Primer Premier 5.0设计引物。其中内参为Tublin和EF1a,RT-qPCR所用引物序列见表1。
RT-qPCR反应体系(10 μL): SYBB Green Supermix 5 μL, 正反向引物(10 μmol/L)各0.5 μL, ddH2O 3.5 μL, cDNA 0.5 μL。反应程序: 94℃预变性3 min; 95℃变性10 s, 58℃退火10 s, 72℃延伸30 s, 40个循环;溶解程序: 95℃ 10 s; 65℃ 5 s; 95℃ 5 s。每个处理设置3个生物学重复,每个样品设置3个技术重复,按照上述体系进行实验。
1.6 dsRNA的合成及注射
RNAi基因片段的T克隆:用Primer Premier 5.0设计合适桔小实蝇fru基因dsRNA特异性片段PCR扩增的特异性引物,其具体引物见表1。用带T7启动子的引物进行交叉PCR扩增,将带有T7启动子的PCR原液按照1.3节的方法进行T克隆,将测序正确的阳性菌液取50 μL在10 mL LB液体培养基(加Ampicilin)于37℃ 180 r/min摇床上培养12~16 h,将培养好的菌液按照质粒小提试剂盒提取质粒,放于-20℃备用。
dsRNA的合成:对抽提的重组质粒用EcoRI(TaKaRa)进行酶切,获得线性化质粒。以线性化质粒为模板,采用T7 RiboMAXTMExpress RNAi System Protocol试剂盒体外合成增强绿色荧光蛋白GFP基因和桔小实蝇fru的dsRNA。合成结束将其稀释10倍用1.2%的琼脂糖电泳分析合成的dsRNA的质量,后用Spectrophotometer测定dsRNA的浓度及纯度,并置于-80℃超低温冰箱备用。
显微注射dsRNA:取出保存的dsRNA,重新确定浓度,并显微注射仪将其注射到羽化9 d的桔小实蝇雄成虫腹部(本实验室前期研究表明在羽化9 d时,桔小实蝇求偶交配频率达到最大值),注射量为1 μg/头(dsGFP和dsfru),每个处理共注射100头雄成虫。在注射后48和72 h取样,于体视镜下摘取桔小实蝇雄成虫头部,采用RT-qPCR检测干扰效率。将样品用液氮速冻后于-80℃超低温冰箱备用。
交配行为测定方法:在注射后72 h,将干扰的雄成虫与未干扰的雌成虫置入直径8 cm、高20 cm并放有水盒和饲料的圆柱盒子中进行配对,然后仔细观察2 h内雌雄求偶交配行为并统计交配频率和交配持续时间。
1.7 数据分析
RT-qPCR实验每个处理设置3个生物学重复,且每个样品设置3个技术重复;依据RT-qPCR检测结果应用2-△△CT法计算基因相对表达量。行为学实验每个处理设置10个生物学重复(圆柱盒子),每个生物学重复含10个雌雄试虫配对。实验结果用Excel表统计,采用单因素方差分析(one-way ANOVA)及Bonferroni事后检验进行差异显著性分析,并用GraphPad Prism 5.0作图。
2 结果
2.1 桔小实蝇fru的全长克隆
依据数据库NCBI中的fru序列信息,克隆获得桔小实蝇的fru全长序列,经比对测序结果与NCBI官网上的预测序列相一致。序列全长为2 865 bp,编码954个氨基酸。将该基因所编码的氨基酸序列在SMART(http:∥smart.embl-heidelberg.de/)蛋白预测网站上,预测了桔小实蝇FRU蛋白的分子量、等电点和特殊结构域:即桔小实蝇FRU蛋白序列中含有一个BTB(Broad-complex, Tramtrack and Bric-a-bric)结构域和两个锌指(zinc finger)结构域(图1)。其中FRU蛋白的等电点为6.01,蛋白分子量大小为104.1 kD。
根据蛋白预测网站发现,黑腹果蝇D.melanogaster、冈比亚按蚊A.gambiae、家蚕B.mori的FRU蛋白序列在N端亦存在BTB结构域和C端是两个锌指结构域。经过序列对比发现,它们的N端非常保守,同源性为87.76%(图1: A)。然而在两个锌指结构域中,桔小实蝇和冈比亚按蚊的同源性较高,黑腹果蝇与家蚕的同源性较高(图1: B和C)。因此,fru基因非常保守,BTB结构域和锌指结构域是该基因的特点。

图1 昆虫物种间FRU功能域的序列比对
2.2 fru基因在桔小实蝇成虫不同组织中的表达情况
嗅觉、味觉在求偶性信息素识别的过程中至关重要,而主要行使嗅觉功能的是触角、下颚须等组织。在本研究中,我们解剖羽化后9 d的雄成虫脑、下颚须和触角等感官组织,采用RT-qPCR检测这些组织中fru基因的表达量。结果表明:桔小实蝇中的fru基因在成虫触角、下颚须和脑中均有表达。这些感官组织分布在头部,因此在本研究中我们选取头部作为主要检测对象(图2)。
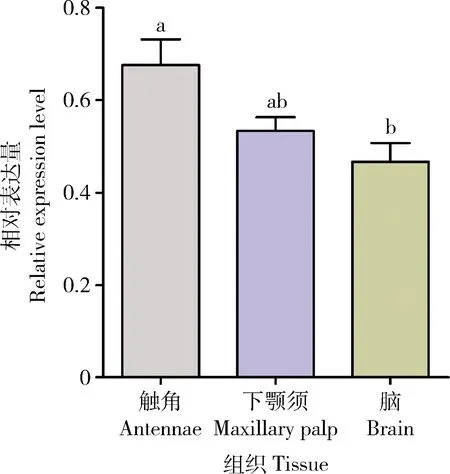
图2 fru基因在桔小实蝇9日龄雄成虫不同组织中的表达谱
2.3 fru在桔小实蝇雄成虫不同交配状态下的表达差异检测
RT-qPCR检测在桔小实蝇雄成虫交配前和交配后4 h之内fru基因的表达量差异,结果表明,相较于未交配雄成虫,fru在桔小实蝇雄成虫头部中的表达量在与雌成虫交配后显著上升(P<0.001)(图3)。

图3 fru基因在不同交配状态下桔小实蝇雄成虫头部中的相对表达量
2.4 RNAi干扰效率检测
RT-qPCR检测结果表明,与空白对照组(注射DEPC水)和阴性对照组(注射dsGFP)相比,注射了dsfru的处理组中fru基因的表达水平显著下降(P<0.05);与空白对照组和阴性对照组相比,处理组中fru基因表达水平在注射后48 h分别下降了51.66%和47.82%(图4: A),在注射后72 h分别下降了72.16%和73.65%(图4: B),因此后续行为学实验选择在干扰后72 h统计交配结果。
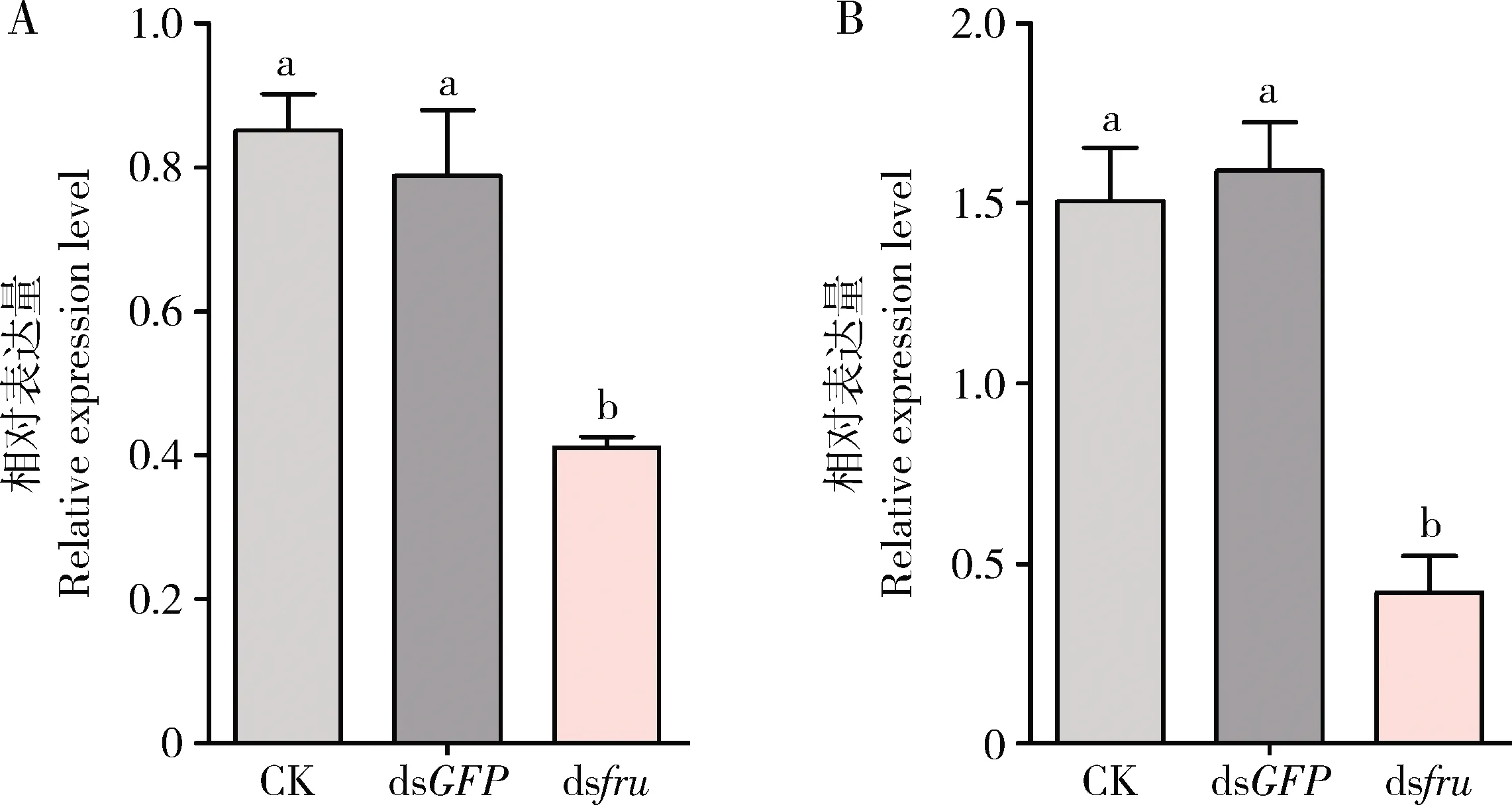
图4 RNAi后48 h(A)和72 h(B)桔小实蝇成虫fru基因的相对表达量
2.5 RNAi探究fru在求偶行为中的功能
据我们观察可知,桔小实蝇的求偶行为可以分为以下几个步骤:当雄性发现一个较为感兴趣的雌性时,跟随其后。接近雌性桔小实蝇时,雄性保持翅靠近腹部,并震动翅膀,持续几秒到几分钟。而雌性会被雄性的振翅(求偶歌)所吸引,较少与振翅时间短(少于30 s)的雄性交配。雌性被雄性的求偶歌所包围时,较为平和,雄性会趁机舔舐雌性的生殖器,取悦雌性。待时机成熟时,雄性会爬上雌性背部尝试交配(未遂交配)。受到求偶歌和舔舐的影响,雌性会打开阴道板开始交配。
将已注射dsfru、DEPC水和dsGFP的雄成虫分别与未进行注射的雌成虫进行配对。结果表明(图5),注射了dsfru的处理组相对于空白对照组(注射DEPC水)和阴性对照组(注射dsGFP)交配所花费的时间大幅度提高。在对照组中,在60 min后超过60%的雄成虫进入交配阶段,且交配频率达到最大值。但是注射了dsfru的处理组,在90 min后雌雄交配频率达到了最大值,仅有不到40%的雄成虫进入交配阶段,且直到观察结束(120 min)一直在该交配频率上下浮动。该结果表明,当fru基因表达量下调时会直接导致桔小实蝇的交配行为受到抑制,具体表现为求偶时间延长(比空白对照组延长了25~35 min),交配成功率下降(比空白对照组下降了17%~22%),说明fru基因在桔小实蝇的求偶交配行为中发挥着重要作用。
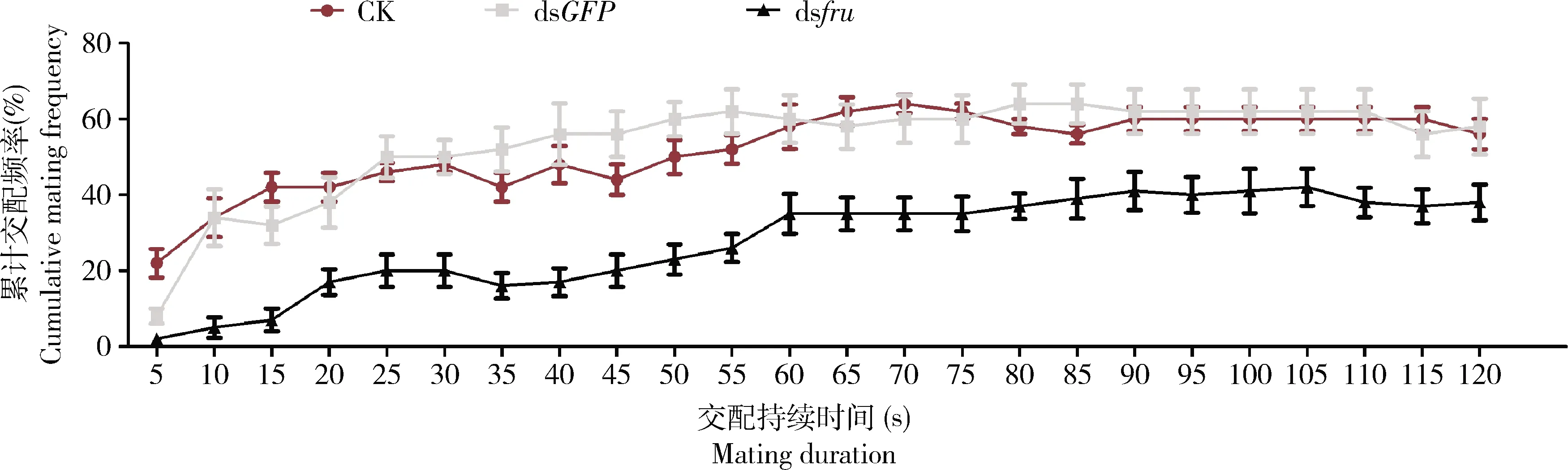
图5 RNAi干扰fru对桔小实蝇成虫交配频率和交配持续时间的影响
3 讨论
在果蝇中,fru基因编码转录因子,其中一种可变剪接异构体在雄性性别调控通路中参与雄性求偶行为,而其他可变剪接异构体则不具有性别特异性(Salveminietal., 2010; Satoetal., 2019)。在雄性果蝇中,fru基因前体发生剪接,将位于2号外显子上的雌性特异性调节区切除,加上雄性特异性5′剪接位点和位于3号外显子的3′剪接位点,编码BTB结构域。因此,雄性特异性FRU蛋白在BTB结构域上游具有雄性特异的、长101个氨基酸的N末端。且有研究表明这个FRU蛋白在雄性的求偶行为中也是必要的(Telonis-Scottetal., 2009; Itoetal., 2016),这与本研究结果一致。所有报道的FRU蛋白亚型都含有一个BTB结构域,这个结构域可以行使二聚体化的功能,同时在C末端具有ZnF结构与作为DNA结构识别区,表明FRU蛋白可能作为转录因子调控下游基因的表达(Vernes, 2014)。且进化分析表明桔小实蝇fru基因序列与果蝇等昆虫在N端非常保守,预示着该基因在各个昆虫中行使类似的功能。
fru在果蝇的性取向、求偶和交配行为中都发挥着十分重要的作用。在果蝇中,fru基因的突变可以导致雄性果蝇的许多交配和求偶行为的改变(Gaileyetal., 2005; Watanabe, 2019)。除此之外,雄性对配偶辨别跟嗅觉、味觉、视觉等感器接受外界信号息息相关:当果蝇的触角、下颚须嗅觉组织被剥夺时,与对照组相比,雄性求偶频率显著下降(Liuetal., 2008)。且据报道,fru神经元在味觉、视觉、嗅觉等区域都有分布(Leeetal., 2000)。本研究结果与前期研究一致,在桔小实蝇中,fru基因在触角、下颚须、脑组织中均有所表达(图2),因此嗅觉系统可能与fru基因实现相互作用,并在桔小实蝇交配行为中发挥着一定的作用。且所涉及参与交配行为的组织主要分布在头部,因此在本研究中我们选取头部作为主要检测对象。fru基因在桔小实蝇雄成虫不同交配状态下头部的相对表达量并不相同,相较于未交配雄成虫,fru基因在桔小实蝇雄成虫头部中的表达量在与雌成虫交配后显著上升(图3),因此说明fru基因可能参与桔小实蝇的雄性求偶交配行为。
在果蝇中,当FruM完全缺失或者表达下调时,雄蝇表现出对雌蝇求偶下降,对同性雄蝇强烈追逐以及交配失败等行为异常。且研究表明人为地在雌性中表达FruM能够使雌蝇展现出追逐、求偶歌等求偶现象(Villellaetal., 1997; Zhouetal., 2015; Shirangietal., 2016),说明FruM是求偶行为某些步骤形成的充分调控因素。因此,FruM被称为果蝇求偶的开关分子(Satoetal., 2019; Wuetal., 2019)。在果蝇中,约有1 500个神经元可表达FruM,fruP1Gal4在视觉、嗅觉、味觉以及腹神经索区域都有分布(Leeetal., 2000; Stockingeretal., 2005)。因此,激活fruP1Gal4能够诱导雄成虫在没有求偶对象的情况下展现所有的求偶步骤,而失活fruP1Gal4神经元则使雄成虫求偶下降甚至完全消失(Manolietal., 2005)。与全变态昆虫不一样的是,在双斑蟀Gryllusbimaculatus中,该基因的表达并未呈现性别二态型,说明fru在半变态昆虫中可能不直接参与求偶和性决定等交配行为(Watanabe, 2019)。因此,fru在果蝇求偶和交配行为中的重要作用不言而喻,但在其他昆虫中的功能作用以及参与形式还有待进一步挖掘和揭示。本研究结果阐明了fru参与了桔小实蝇雌雄交配的行为中,RNAi引起的fru基因表达量的降低(图4)会导致桔小实蝇求偶时间延长以及交配成功率的下降(图5)。与本研究结果一致,在家蚕中,使用RNAi降低fru基因的表达量后,只有20%的家蚕在10 min内完成交配,与对照组中10 min内80%的家蚕均已完成交配差异显著(Zheng, 2016),表明fru基因在家蚕求偶行为中发挥着重要作用。且作者还进一步采用免疫沉淀筛选出4类潜在与FRU蛋白存在相互作用的蛋白(Zheng, 2016),为进一步研究FRU蛋白的功能提供了基础。但是fru基因在家蚕中的不同剪切形式,对其功能的调控是否相同,且该基因是否是调控交配的必要条件亦不清楚。本研究结果也表明fru表达与桔小实蝇交配行为紧密相关,为揭示该基因在非模式昆虫中的功能和绿色防控桔小实蝇提供了有力证据,但fru基因(或FRU蛋白)具体以何种形式参与到这些行为中,还需进一步的实验进行研究与验证。
