小分子热激蛋白基因HaHSP19.8在棉铃虫抗逆反应中的作用
2020-10-15魏纪珍刘少凯刘晓光梁革梅杜孟芳安世恒
魏纪珍, 王 凯, 刘少凯, 刘晓光, 梁革梅, 杜孟芳,*, 安世恒
(1.河南农业大学植物保护学院, 省部共建小麦玉米作物学国家重点实验室, 郑州 450002;2.中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
热激蛋白(heat shock protein, HSP)因响应热刺激而得名,但它的快速合成也响应其他多种环境因子的压力,其中包括温度、重金属、滞育和杀虫剂等(Huang and Kang, 2007; Yangetal., 2016)。热激蛋白常作为分子伴侣参与调控多种分子功能,例如蛋白质的折叠、组装、分泌和降解等,来维持压力和非压力下的体内平衡(Hartl and Hayer-Hartl, 2002; Nollen and Morimoto, 2002)。根据氨基酸的同源性和分子量大小,热激蛋白可以分为5类: HSP90,HSP70,HSP60,HSP40和sHSPs(Feder and Hofmann, 1999)。小分子热激蛋白是普遍存在的独立于三磷酸腺苷(adenosine triphosphate, ATP)的分子伴侣,在几乎所有的生物中,它们可以阻止蛋白质在压力应激下的聚集(Bepperlingetal., 2012)。小分子热激蛋白分子量12~42 kD不等,各小分子热激蛋白的同源性较低,与其他的热激蛋白相比,其唯一的特征是保留了保守的α-晶体结构域(α-crystallin domain, ACD)(Kriehuberetal., 2010; Bashaetal., 2012)。另外,被命名为生命必需的致死蛋白[protein lethal(2)essential for life-like, l(2)efl]也属于小分子的热激蛋白家族(Kurzik-Dumke and Lohmann, 1995)。
科学家们在对杀虫剂的胁迫或抗性的研究中发现,昆虫体内热激蛋白广泛地响应杀虫剂的诱导,甚至参与到昆虫对杀虫剂的抗性中。吡虫啉处理后,褐飞虱NilaparvatalugensHSP70基因的表达显著上调,干扰该基因会使褐飞虱抵御杀虫剂的抗性增强(Luetal., 2017)。黑腹果蝇Drosophilamelanogaster取食杀虫剂后,HSP26和HSP60基因会显著上调(Doganlar and Doganlar, 2015)。苏云金芽孢杆菌Bacillusthuringiensis(Bt)是目前广泛应用的生物源杀虫剂,靶标昆虫的热激蛋白在抵御Bt的压力中作用也被逐步被研究。其中在棉铃虫Helicoverpaarmigera、亚洲玉米螟Ostriniafurnacalis和棉铃象Anthonomusgrandis中,HSP被报道能与Bt蛋白结合(Chenetal., 2010; Nakasuetal., 2010; Xuetal., 2013)。蛋白质组学研究表明,Cry1Ac处理后,棉铃虫幼虫HSP70基因的表达量降低(Yuanetal., 2011)。取食Cry11Aa后,埃及伊蚊Aedesaegypti的HSP90基因的表达量降低,干扰HSP90会使埃及伊蚊对Cry11Aa的抗性增强(Cancino-Rodeznoetal., 2012)。云杉夜蛾Choristoneurafumiferana取食亚致死剂量的Cry1Ab后,HSP90基因的表达量显著上调(Meunieretal., 2006)。小菜蛾PlutellaxylostellaHSP70被报道可能是Cry1Ac的结合蛋白,HSP70基因表达量的下调参与了小菜蛾对Cry1Ac的抗性(Xiaetal., 2016)。
棉铃虫属鳞翅目(Lepidoptera)夜蛾科(Noctuidae)实夜蛾属Helicoverpa,是一种世界性分布的重要农业害虫,危害棉花、玉米、蔬菜等300多种作物(Wu and Guo, 2005; Wu, 2007)。近些年来,对转Cry1Ac棉花的普遍推广,虽然有效地防治了棉铃虫的危害,但田间棉铃虫对转基因棉花的抗性水平也在显著地增加(Zhangetal., 2012; Anetal., 2014; Jinetal., 2015)。且随着我国棉花种植结构的调整,Bt棉花主要集中在新疆地区大面积种植(陆宴辉等, 2018),缺少合理的庇护所,可能会引起棉铃虫对Bt棉花抗性的快速发展。为达到长期有效的防治效果,需要对棉铃虫抵御Bt的机理和Bt的作用机制进行深入的研究。我们前期通过对抗感Cry1Ac棉铃虫的转录组数据分析发现,一些小分子的热激蛋白表现出显著差异(Weietal., 2018)。本研究中,我们鉴定得到了棉铃虫的一个小分子热激蛋白sHSP19.8,其可能参与到棉铃虫对Cry1Ac抗性机制;通过RACE和PCR克隆了该小分子热激蛋白sHSP19.8的基因序列,通过qRT-PCR技术分析了棉铃虫受温度和Cry1Ac处理后该基因的表达情况,同时分析了该基因在抗、感Cry1Ac棉铃虫各发育阶段和5龄幼虫各组织中的表达谱,为明确HSP19.8在棉铃虫生长发育、抵抗外界压力和对Cry1Ac抗性机制中的作用奠定理论基础。
1 材料与方法
1.1 供试棉铃虫
本研究采用的Cry1Ac敏感棉铃虫为LF品系,该品系棉铃虫于2005年采集于河北省廊坊市棉田,幼虫饲喂棉铃虫人工饲料,成虫饲喂10%的糖水,一直在室内人工饲养,未接触任何杀虫剂(梁革梅等, 1999)。室内饲养环境温度为27±2℃,相对湿度75%±10%,光周期为14L∶10D。本研究中采用的Cry1Ac抗性棉铃虫LF120品系来源于LF品系,经MVPII[Dow AgroSciences,一种含有Cry1Ac原毒素的商品化杀虫剂(Welchetal., 2015)]梯度筛选(5, 10, 20, 30, 60和120 μg/mL Cry1Ac前毒素每毫升饲料)后,分离出LF120的抗Cry1Ac品系(Caoetal., 2014; Weietal., 2015),其对Cry1Ac的抗性水平有1 600倍(Weietal., 2016)。
1.2 总RNA的提取和cDNA合成
饲养LF敏感品系的棉铃虫,取生长状况一致的5龄棉铃虫幼虫,放入40℃培养箱,高温处理1 h和2 h后,立即放入液氮冷冻,再转到-80℃冰箱中保存备用。每种处理取样3头,设置4次生物学重复。27℃正常饲养的5龄棉铃虫作为对照。
饲养LF敏感品系的棉铃虫,取生长状况一致的5龄棉铃虫幼虫,饥饿24 h后,转到含30 μg/mL Cry1Ac全长杀虫蛋白(该浓度是敏感棉铃虫5龄幼虫7 d 30%的死亡剂量)或正常(不含Cry1Ac)的人工饲料上,饲喂1 h和2 h后,立即在冰上解剖取中肠,如上用4℃预冷的0.7% NaCl溶液洗去内含物,用滤纸吸干水分,迅速放入液氮冷冻后再转存到-80℃冰箱保存备用。各处理下取样10头为一个生物学重复,设置4次生物学重复。
分别饲养LF和LF120品系的棉铃虫,收集1龄幼虫(20头)、2龄幼虫(10头)、3龄幼虫(5头)、4龄幼虫(3头)、5龄幼虫(3头)、蛹(3头)和成虫(3头)期的棉铃虫,上述取样数量为一个生物学重复,该样品用于比较不同品系不同发育期,基因的表达模式。分别准备LF和LF120品系的棉铃虫5龄幼虫(各10头),冰上解剖棉铃虫的前肠、中肠、后肠、马氏管和表皮。前肠、中肠和后肠用4℃预冷的0.7% NaCl溶液洗去内含物,用滤纸吸干水分后迅速放入液氮冷冻,后转到-80℃冰箱保存备用,用于比较不同品系不同组织中基因的差异。各样品的准备均设置3次生物学重复。
以上各处理样品总RNA的提取按照Invitrogen的操作说明利用Trizol法提取。RACE扩增目的基因所用的cDNA模板的合成,取敏感棉铃虫5龄幼虫的中肠组织,参考SMATR-erRRACE cDNA Amplification Kit说明书操作。qRT-PCR所用cDNA模板依照SuperReal PreMix(Probe)说明书合成。
1.3 棉铃虫sHSP19.8基因全长cDNA克隆
根据棉铃虫的转录组数据(Weietal., 2018),分析得到sHSP19.8的部分序列,利用Primer 5.0分子生物学软件设计5′RACE特异性引物sHSP19.8-RACE-5′(表1),以1.2节合成的敏感棉铃虫5龄幼虫的中肠RACE cDNA为模板,扩增sHSP19.8基因的5′端序列。PCR反应体系(25 μL): cDNA 1 μL, 引物sHSP19.8-RACE-5′(10 mmol/L)0.5 μL, UPM 2.5 μL, 10×Buffer 2.5 μL, LATaq 0.25 μL,无菌水17.25 μL。PCR反应程序: 94℃预变性4 min; 94℃变性30 s, 72℃ 延伸3 min, 循环5次; 94℃变性30 s, 70℃退火30 s,72℃延伸3 min,循环5次;94℃变性30 s, 68℃退火30 s, 72℃延伸3 min,循环35次;72℃保温10 min。PCR产物通过1.2%的琼脂糖凝胶电泳(DYY-6C琼脂糖水平电泳仪,北京六一仪器厂)进行检测,确定目的条带后,送北京博迈德基因技术有限公司进行序列测定。根据测定序列与已知序列拼接,再设计特异性引物sHSP19.8-ORF-F和sHSP19.8-ORF-R(表1),以1.2节合成的敏感品系棉铃虫5龄幼虫中肠cDNA为模板,扩增其开放阅读框。PCR反应体系(25 μL): cDNA 1 μL, sHSP19.8-ORF-F/sHSP19.8-ORF-R(10 mmol/L)各0.5 μL, dNTPs 1 μL, 10×EasyTaq Buffer 2.5 μL, EasyTaq E 0.25 μL, 无菌水19.25 μL。PCR反应程序: 94℃预变性4 min; 94℃变性30 s, 58℃退火30 s, 72℃延伸1 min,循环35次;72℃保温10 min。再次电泳和测序验证。

表1 引物信息
1.4 基因序列分析和系统发育树构建
用基因探索者软件对sHSP19.8基因的可阅读框长度进行预测,并翻译成对应的氨基酸序列;利用SWISS-MODEL在线软件分析蛋白质的相对分子量、等电点和结构域;在NCBI数据库中进行BLASTp同源序列分析,选取不同昆虫的sHSP基因,利用MEGA 7(7.0.14)软件,选择Jones-Taylor-Thornton(JTT)模型,利用最大相似法(maximum likelihood method)构建系统进化树进行聚类分析。
1.5 基因表达量qRT-PCR分析
根据棉铃虫sHSP19.8的cDNA序列,由Inviotrogen公司设计合成Taqman探针sHSP19.8-RTPCR-P(5′端用FAM标记, 3′端用MGB标记)及qRT-PCR的特异性引物sHSP19.8-RTPCR-F和sHSP19.8-RTPCR-R(序列见表1)。qRT-PCR分析采用双内参法,内参基因分别为棉铃虫GAPDH(GenBank登录号: JF417983.1)和Actin(GenBank登录号: X97615.1),内参基因的引物和探针同样由Inviotrogen公司设计合成(序列见表1)。RT-PCR反应体系(20 μL): MaximaR Probe/ROX qPCR Master Mix(2×)10 μL, 正反向引物(10 μmol/L)各0.6 μL, 探针(10 μmol/L)0.4 μL, cDNA 2 μL和无菌水6.4 μL。PCR反应体系于96孔板中,采用7500 Fast实时荧光定量PCR仪(美国ABI公司)进行反应。RT-PCR反应程序: 95℃预变性10 min; 然后95℃变性3 s, 60℃退火/延伸30 s,循环40次。每个生物学处理进行3次技术重复。数据分析使用相对定量分析方法,计算公式采用2-ΔΔCt法(Livak and Schmittgen, 2001)。ΔCt=Ct目标基因-Ct内参基因, Ct内参基因=(CtActin+CtGAPDH)/2, ΔΔCt=ΔCt处理样品-ΔCt参照样品。
1.6 数据分析
采用DPS7.05软件对实验数据进行方差分析,其中同一品系不同发育阶段、不同组织、温度或药剂不同处理时间之间的方差分析采用单因素Turkey氏法进行显著性分析;LF和LF120两个品系间的各龄期和各组织间采用独立样本t检验进行差异显著性分析。
2 结果
2.1 棉铃虫sHSP19.8基因序列及系统进化位置
通过RACE和PCR技术,从棉铃虫中扩增了一条608 bp的sHSP基因序列,经基因软件分析该序列包含开放阅读框长528 bp的基因序列,该序列编码175个氨基酸,GenBank登录号为XP_021195228.1。通过SWISS-MODEL在线软件预测其蛋白分子量为19.8 kD,等电点为6.22,我们将其命名为HaHSP19.8。对HaHSP19.8基因结构域进行预测分析,结果表明HaHSP19.8具有可变的N末端区域(第1-48位氨基酸残基),小分子热激蛋白保守的α-晶状体结合域(氨基酸残基第49-160位),以及C末端区域(第161-175位氨基酸残基)(图1)。

图1 棉铃虫HaHSP19.8基因cDNA序列及推导的氨基酸序列
将HaHSP19.8的氨基酸序列与其他13种昆虫的sHSP氨基酸序列比较,发现不同物种间的差异主要在N端,这与小分子热激蛋白具有可变的N末端区域(第1-48位氨基酸残基)这一特性相吻合(图2)。同时它们具有类似的中间α-晶状体结合域和延伸的C端(图2)。通过比对分析,HaHSP19.8的氨基酸序列与黏虫Mythimnaseparata的sHSP19.7、甘蓝夜蛾Mamestrabrassicae的sHSP19.7和斜纹夜蛾Spodopteralitura的l(2)efl氨基酸序列一致性在90%以上;与其他作比较的鳞翅目夜蛾科昆虫的sHSP氨基酸序列一致性在80%以上(图2)。
为了进一步研究HaHSP19.8基因的进化关系,我们将HaHSP19.8的氨基酸序列与其他14种昆虫的sHSP蛋白进行了进化树分析(图3)。结果表明,HaHSP19.8与鳞翅目其他昆虫的sHSP聚在了同一进化支上,其中与已经鉴定的黏虫的sHSP19.7的进化关系最近,其次是与甘蓝夜蛾和斜纹夜蛾(图3),这与上述基于氨基酸序列的分析结果一致。
2.2 HaHSP19.8在Cry1Ac敏感棉铃虫中受高温和Cry1Ac诱导时的表达差异
HaHSP19.8基因是典型的热激蛋白基因,该基因的表达响应温度的调控,40℃高温处理后,棉铃虫敏感品系5龄幼虫中均表现出该基因的显著上调表达(图4: A),特别是在处理后1 h时,基因显著上调113.37倍(F=41.35,P=0.0001),2 h时该基因表达降低。该HaHSP19.8基因同样响应Cry1Ac杀虫蛋白的诱导,在棉铃虫取食含30 μg/mL Cry1Ac全长杀虫蛋白的人工饲料后1 h和2 h均表现为显著的表达上调(F=79.34,P=0.0001),分别上调20.67和30.50倍(图4: B)。
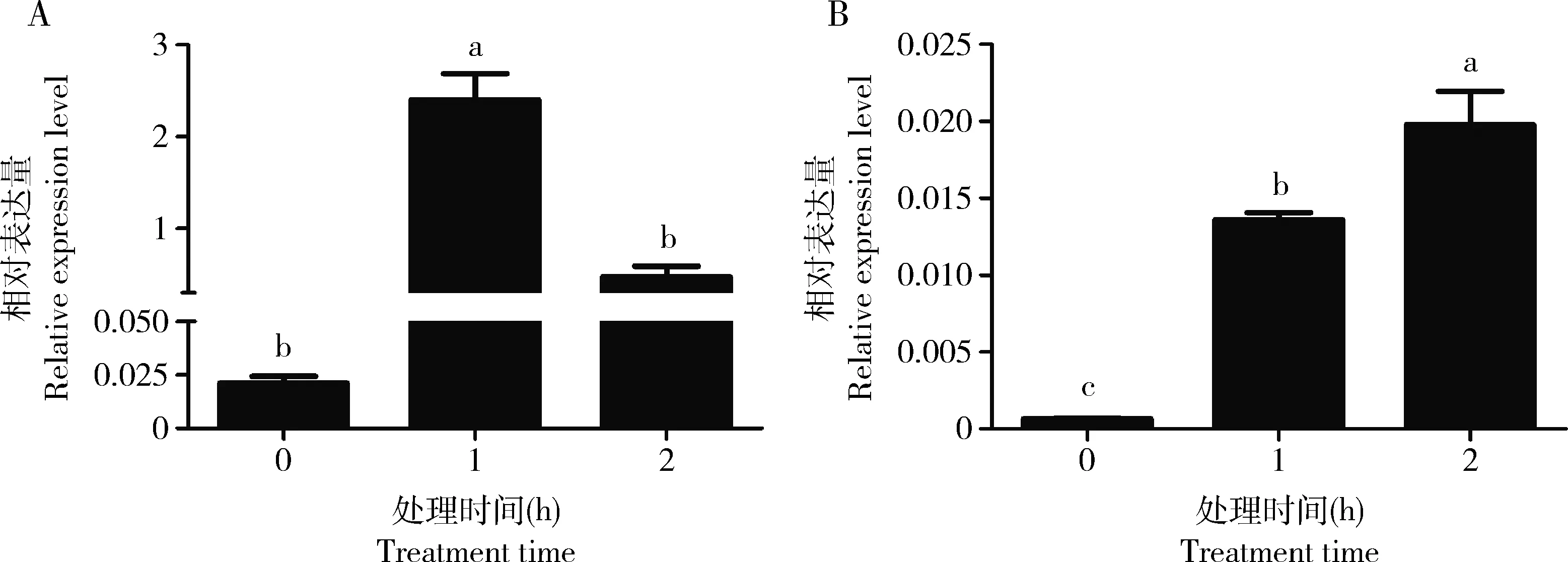
图4 40℃高温(A)和饲喂含30 μg/mL Cry1Ac的人工饲料(B)时棉铃虫Cry1Ac敏感品系5龄幼虫中HaHSP19.8基因的相对表达量
2.3 HaHSP19.8在Cry1Ac抗感棉铃虫不同发育阶段的表达差异
通过比较Cry1Ac敏感的LF和Cry1Ac抗性的LF120两种品系的HaHSP19.8基因,并没有发现碱基或者氨基酸的差异。利用qRT-PCR分析HaHSP19.8基因在不同发育阶段的表达谱,结果表明HaHSP19.8基因在Cry1Ac敏感的LF品系各个发育阶段均普遍表达,其中成虫和5龄幼虫期表达量最高,蛹期表达最低(图5)。但是在Cry1Ac抗性LF120品系中,各个发育阶段中均未检测到HaHSP19.8基因的表达。该基因在Cry1Ac敏感的LF品系各个发育阶段中的表达均显著地高于其在抗性LF120品系中的表达(P<0.05)(图5)。
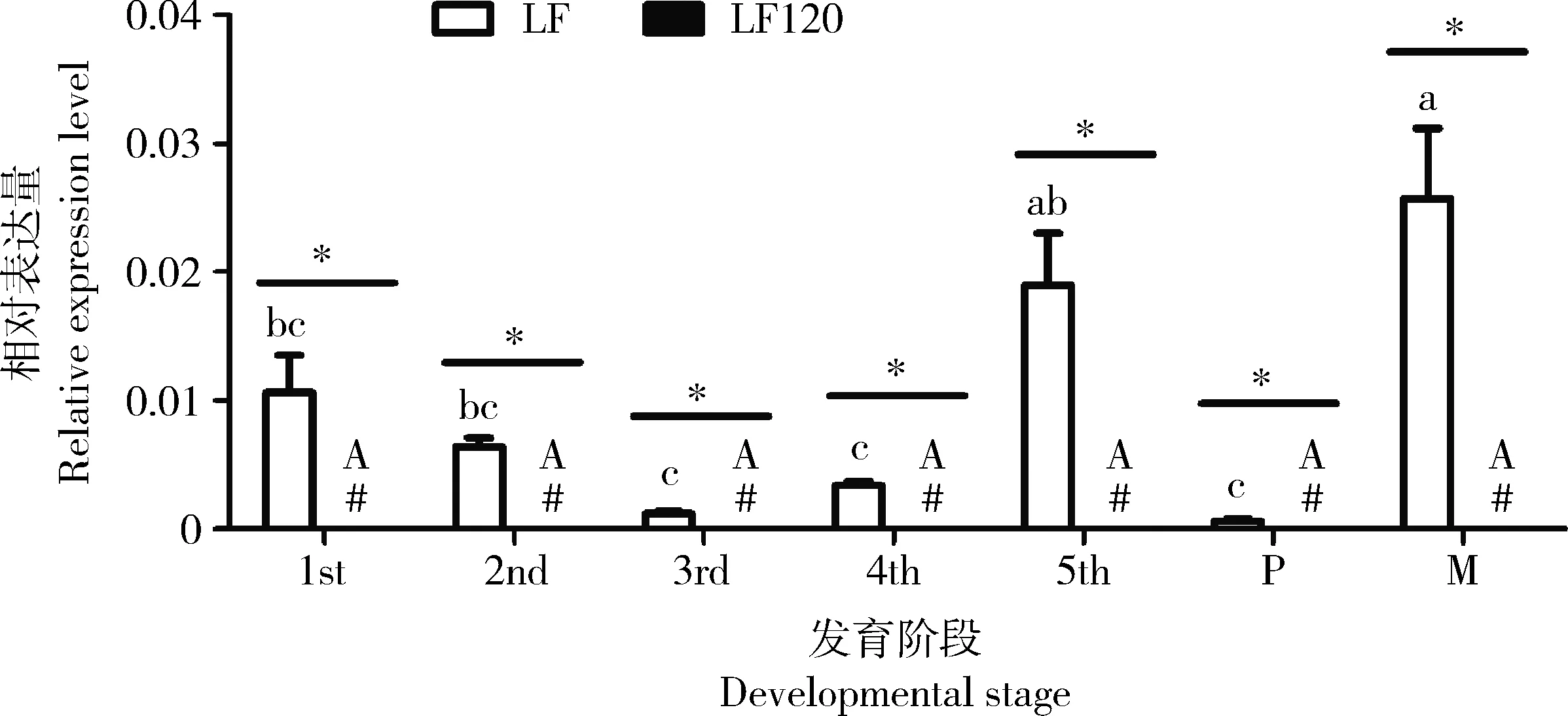
图5 HaHSP19.8基因在Cry1Ac 敏感品系LF和抗性品系LF120品系棉铃虫各发育阶段的相对表达量
2.4 HaHSP19.8在Cry1Ac抗感棉铃虫5龄幼虫不同组织中的表达差异
qRT-PCR分析HaHSP19.8基因在LF敏感棉铃虫5龄幼虫各组织中的表达,结果发现该基因在前肠、中肠、后肠、马氏管和表皮中均有表达,其中在表皮中表达量最高,其次是马氏管、中肠和后肠,前肠中表达量最少(图6)。但是HaHSP19.8基因在LF120抗性品系幼虫各组织中表现出不一样的表达模式,具体表现为马氏管中最高,其次是前肠和中肠,在后肠和表皮中未检测到该基因的表达(图6)。在Cry1Ac敏感品系幼虫的中肠、后肠和表皮中,HaHSP19.8基因的表达量均显著高于其在抗性品系LF120中的表达量(P<0.05)(图6)。
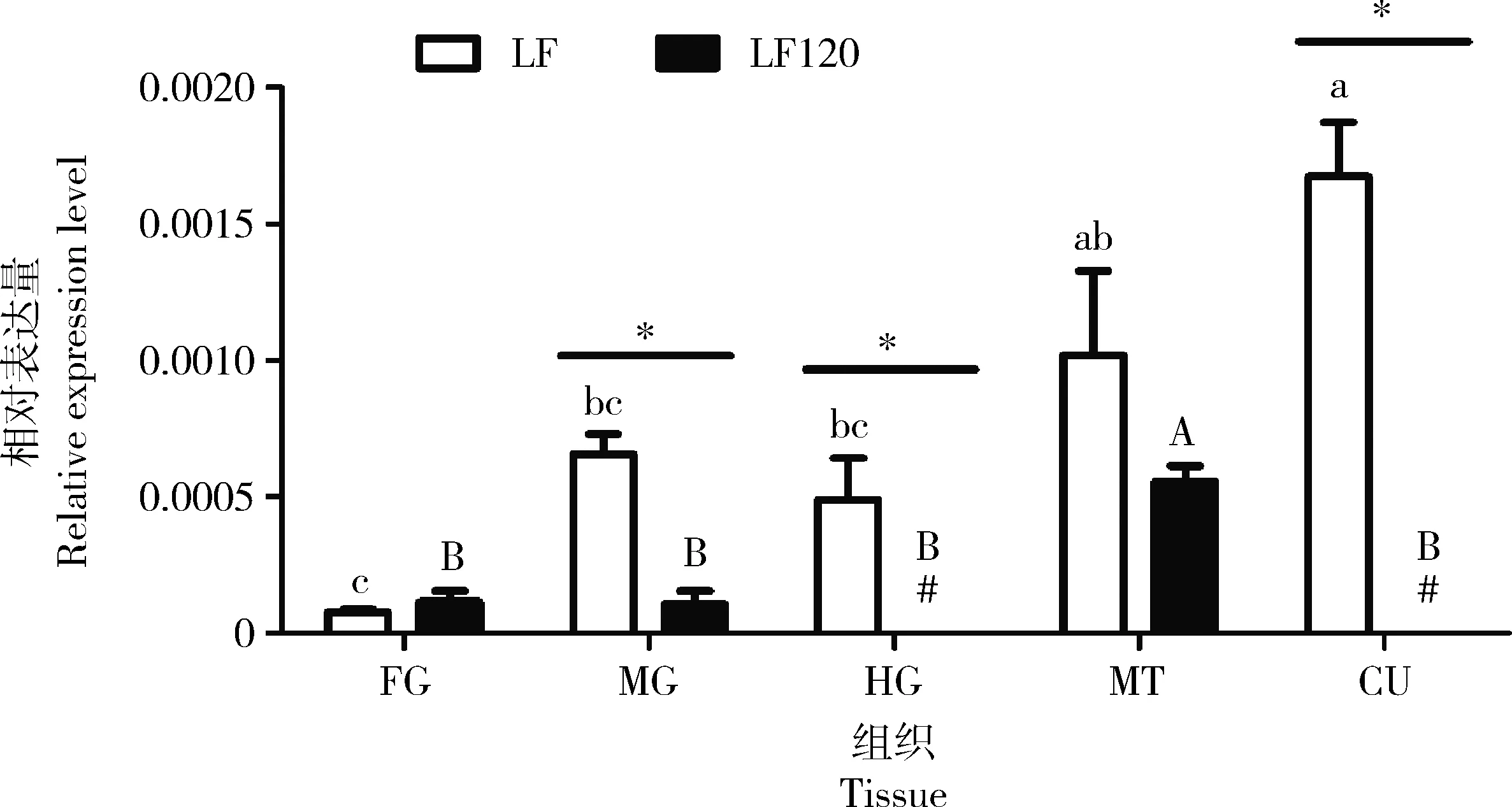
图6 HaHSP19.8基因在Cry1Ac敏感品系LF和抗性品系LF120棉铃虫5龄幼虫各组织中的相对表达量
3 讨论
经分子生物学技术和生物信息学分析,HaHSP19.8是典型的小分子热激蛋白(图1~3)。昆虫在整个生长阶段必须采取相应的对策来对抗外界压力,其中通过调节热激蛋白的表达就是一种重要的手段(Hoffmannetal., 2003; Sørensenetal., 2003)。近些年来的研究也表明,HSP的表达在昆虫抵御高温和杀虫剂胁迫中发挥着重要作用(Kriehuberetal., 2010; Bashaetal., 2013)。例如,42℃可以显著地诱导小菜蛾12种sHSP基因的表达(Chen and Zhang, 2015);斜纹夜蛾的HSP19.7和HSP20.7基因响应40℃的诱导(Shenetal., 2011);水稻二化螟幼虫体内HSP19.8和HSP21.7基因受高温(39和42℃)的诱导超表达(Luetal., 2014)。同时杀虫剂的使用,作为一种外界的非生物因子,也增加了昆虫适应外界环境的压力。在杀虫剂的影响下,褐飞虱HSP70,果蝇HSP26和HSP60基因以及云杉夜蛾HSP90的表达量显著上调(Meunieretal., 2006; Doganlar and Doganlar, 2015; Luetal., 2017)。本研究中,HaHSP19.8在40℃高温和Cry1Ac杀虫蛋白的诱导下,其表达量在棉铃虫幼虫中都显著地被诱导(图4)。这些报道和我们的研究结果一起证实:这些热激蛋白的产生和高表达可能与昆虫应对这些不利的生存环境具有重大的联系(Silbermann and Tatar, 2000)。
既然sHSP19.8在昆虫抗逆过程中过量表达,那么研究其在昆虫各发育阶段和组织的中表达模式,对揭示该基因功能具有重要意义。HaHSP19.8具有小分子热激蛋白的典型特征,同其他热激蛋白(Kriehuberetal., 2010; Bashaetal., 2012)一样,40℃诱导1~2 h后高表达(图4)。通过qRT-PCR检测,证实HaHSP19.8在敏感棉铃虫各生长发育阶段和组织中均有表达(图5和6),这表明HaHSP19.8可能像其他昆虫的小分子热激蛋白一样广泛地参与到昆虫各个发育阶段的生理生化活动中(Huangetal., 2009; Takahashietal., 2010; Shenetal., 2011; Conchaetal., 2012; Luetal., 2014)。但是不同的小分子热激蛋白在昆虫中的表达模式差异很大。与其分子量接近的其他昆虫的小分子热激蛋白的表达有些集中的幼虫期,有些集中在蛹期(Huangetal., 2009; Kokolakisetal., 2009)。HaHSP19.8在成虫中表达量最高(图5),二化螟C.suppressalisHSP19.8和斜纹夜蛾S.lituraHSP19.7与棉铃虫的同源性较高(图2),其在成虫期也表达最高(Shenetal., 2011; Luetal., 2014),这说明该小分子热激蛋白可能也参与成虫期的生命活动。小分子热激蛋白在昆虫各组织中的特异性表达往往可能与其特殊的功能有关,HaHSP19.8在敏感棉铃虫的表皮、马氏管和中肠内高表达,表明它可能与维持正常的器官功能和在外界压力下保护蛋白质的正常功能有关(Guetal., 2012)。
HaHSP19.8响应Cry1Ac杀虫蛋白的诱导,表现出过量表达,分析其在抗Cry1Ac的棉铃虫品系中的表达模式,qRT-PCR结果未检测到HaHSP19.8在抗Cry1Ac棉铃虫的各个发育阶段的表达(图5),在其5龄幼虫各组织中也表现出未表达或降低表达(图6),这可能与抗性棉龄虫表现出来一系列适合度代价有一定的联系。这些适合度代价体现在:抗性昆虫卵的孵化率降低,幼虫的存活率降低、发育历期延长、蛹重减小、繁殖能力下降、交配能力降低,以及抵御非生物学压力的能力降低等(范贤林等, 2000; Liangetal., 2007, 2008; 邹朗云等, 2012)。在抗性棉铃虫中的表达模式再次证实HaHSP19.8可能在棉铃虫的发育过程中起到很重要的作用。由于目前对小分子热激蛋白在昆虫各组织中的功能研究尚不明确,确切地了解HaHSP19.8的功能,还需开展更多的功能研究工作。
进一步的比较抗、感Cry1Ac棉铃虫中HaHSP19.8的表达,结果表明HaHSP19.8在抗性品系中表达量降低,我们推测该小分子热激蛋白可能参与到棉铃虫对Bt的抗性机理中,具体的作用方式有下列几种可能:首先,热激蛋白可能作为棉铃虫体内功能蛋白质的分子伴侣,随着功能蛋白质降低表达量参与抵抗Cry1Ac的过程而下调表达。在昆虫对Bt的抗性机制中,参与Bt的消化、降解和结合的蛋白表达量的减少,通常是其重要的作用机制之一(Weietal., 2018),热激蛋白可能作为它们的重要分子伴侣,参与到蛋白质的正常功能中,当昆虫因这些参与Bt作用过程的蛋白的表达量降低时,HaHSP19.8的表达量也显著降低。其次,如其他热激蛋白或者Bt的结合蛋白一样(Meunieretal., 2006; Xiaetal., 2016),HaHSP19.8蛋白可能与Bt结合发挥毒理,昆虫通过降低该结合蛋白的表达量来抵御Bt毒素。第三,HaHSP19.8可能如小菜蛾Hsp90一样,可以与Bt蛋白结合,保持Bt蛋白的正确折叠,以提高Bt的毒性(García-Gómezetal., 2019),而作为昆虫的抗性机制,HaHSP19.8的表达量下调来降低Bt的毒性。第四,HaHSP19.8可能仅仅作为生长发育中的重要作用因子,因昆虫对Bt的适合度代价或免疫性活动在抗性个体中降低表达。在小菜蛾Bt抗性研究中表明,表达量降低的HSP70作为上游的免疫调控因子,可能激活了JNK, ERK和p38激酶等而使小菜蛾对Bt产生抗性(Xiaetal., 2016)。本研究初步证实了HaHSP19.8在棉铃虫的生长发育中起到重要作用,该基因可能参与到棉铃虫对Cry1Ac的抗性机理中。但对于其具体的作用方式还有待下一步深入研究。
