去整合素-金属蛋白酶17在消化系统恶性肿瘤中的研究现状
2020-10-15
徐榕,康海锋,钱俊波, 南通大学第二附属医院消化内科 江苏省南通市 226000
刘宏斌, 南通大学第二附属医院病理科 江苏省南通市 226000
0 引言
恶性肿瘤是严重威胁人类健康的重要疾病之一,2018年全球十大常见恶性肿瘤有近一半来自消化系统.主要消化系统恶性肿瘤如结直肠癌(colorectal cancer,CRC)、胃癌(gastric carcinoma,GC)、肝癌和食管癌,其死亡率分别位居所有恶性肿瘤的第2、3、4和6位[1].据预测,随着我国经济科技发展,与慢性感染、不健康饮食方式等相关的消化系统恶性肿瘤也将成为我国发病率和死亡率最高的癌症之一[2].
目前,肿瘤的根治主要依靠手术,由于大部分病人被确诊时已处于疾病的中晚期,因此还需放化疗、免疫治疗等辅助方案,但肿瘤病人的整体预后仍不理想.鉴于临床上缺乏有效的抑制肿瘤生长和转移的药物治疗方案,近年来,靶向治疗上升为一个非常活跃的研究领域.探寻肿瘤发生发展的分子生物学和分子遗传学特征,发现早期敏感标记物和新型药物靶标,对有效防治恶性肿瘤及其预后评估、提高肿瘤病人的生存质量,具有重要的社会和科学意义.
去整合素-金属蛋白酶(a disintegrin and metalloproteinase,ADAM)17,又称肿瘤坏死因子α转换酶(tumor necrosis factor alpha converting enzyme,TACE)是一种具有多功能的细胞膜表面糖蛋白.ADAM17不仅可以切割多种跨膜蛋白的胞外域,使之脱落与相应配体结合从而激活信号通路,在细胞增殖、血管生成等过程中发挥作用; 还可以通过降解细胞基底膜和细胞外基质,与肿瘤的侵袭、转移能力密切相关.正因如此,ADAM17被报道在许多恶性肿瘤中表达上调,如脑胶质瘤[3]、肺癌[4]、乳腺癌[5]、肾透明细胞癌[6]、上皮性卵巢癌[7]等.本文就近年来有关ADAM17在消化系统恶性肿瘤中的表达情况及其功能进行综述.
1 ADAM17的概述
1.1 ADAM17的发现 1988年,一些研究者在研究肿瘤坏死因子(tumor necrosis factor alpha,TNF-α)时发现其是一种跨膜蛋白,需要被某种剪切酶作用后才能发挥生物活性.1994年,另一些研究者报道,TNF-α过量释放可诱发感染性休克,异羟肟酸酯作为TNF-α剪切酶的抑制剂,恰好可以阻断这一疾病的发生.由此人们猜想,TNF-α剪切酶是否可以作为疾病治疗的潜在靶点?这是一个值得深入研究的问题.1997年,有两个研究小组从小鼠和人类体内纯化出这种剪切酶(称为TACE),显示其是膜结合的整合素金属蛋白酶,是哺乳动物adamalysins(或ADAMs)家族的新成员,也就是后来的ADAM17[8].
1.2 ADAM17的结构与功能 ADAM17主要以两种形式存在:前体形式(约100 kDa)和缺乏前结构域的活化形式(约80 kDa).全长蛋白质(或前体形式)由824个氨基酸组成,其编码基因位于染色体2p25,长约50 kbp,包含19个外显子[9].该蛋白是一种含有8个结构域的Ⅰ型跨膜蛋白,从外向内依次为N端信号域、前结构域、类金属蛋白酶域、整合蛋白功能域、半胱氨酸富集域、类表皮生长因子域、跨膜域和C末端胞质尾区[10,11].
类金属蛋白酶域和整合蛋白功能域是ADAM17主要的结构域.类金属蛋白酶域具有活性位点,在该位点,HExGHxxGxxHD基序与Zn2+结合,显示出具有蛋白酶活性,这也是ADAM17最突出的功能(图1).ADAM17负责对血管内皮生长因子(vascular endothelial growth factor,VEGF)、TNF-α、白介素6 (interleukin 6,IL-6)、CX3C趋化因子配体1等膜蛋白的细胞外功能区进行水解脱落,使之形成配体,而后通过自分泌或旁分泌与相应的受体结合,从而协调EGFR-PI3K-Akt途径、Notch信号通路、NF-κB信号通路等信号转移,参与血管生成、细胞增殖、炎症反应等生物学过程.整合蛋白功能域可与整合蛋白结合并抑制其功能,由此影响细胞-细胞、细胞-基质之间的粘附,这有利于细胞的迁移浸润,因此赋予了恶性肿瘤的转移特性[10-12].
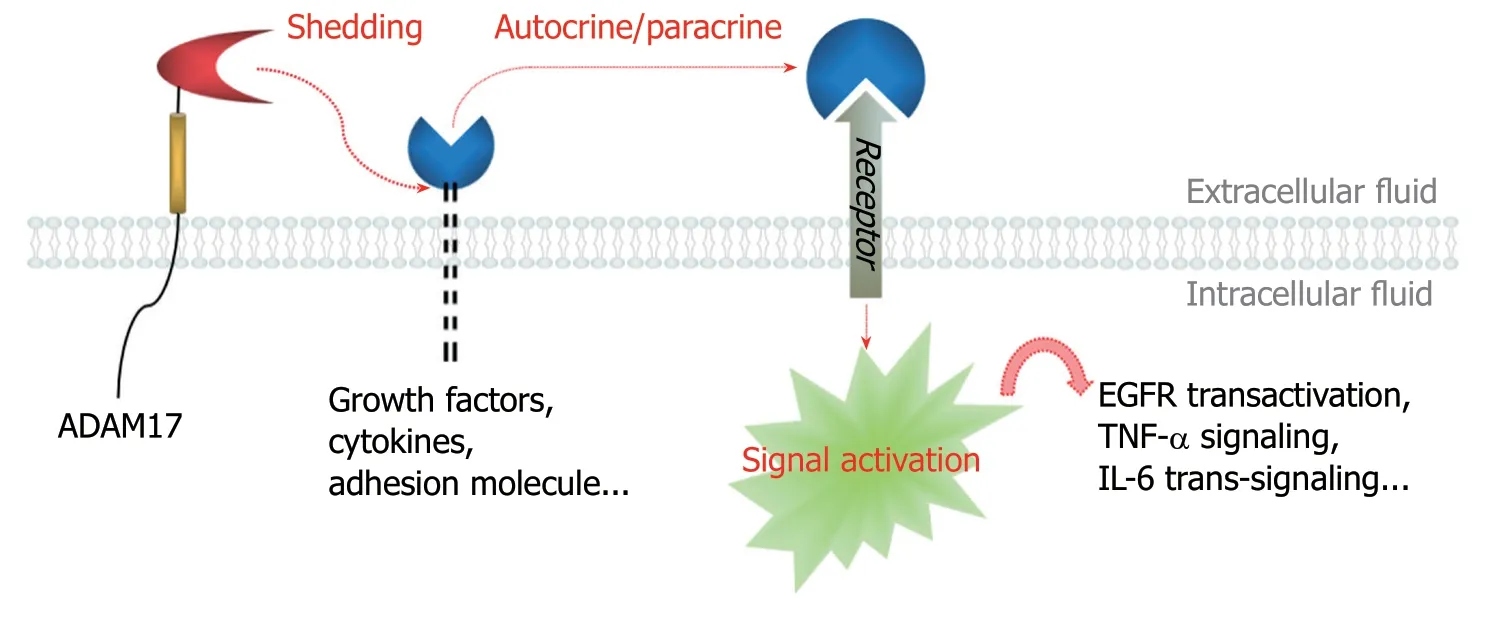
图1 去整合素-金属蛋白酶17功能示意图.
此外,N端域起分子伴侣的作用; 前结构域介导ADAM17的成熟和正确折叠; 半胱氨酸富集域和类表皮生长因子域可能与ADAM17的底物识别有关; 胞质域可能参与胞外域信号分子事件的响应,缺乏跨膜域和胞质域的ADAM17可以切割跨膜蛋白,但效率不高[8-10].
1.3 ADAM17活性的调节 由于涉及到复杂的生理、病理过程以及不同信号通路的耦合,ADAM17的活性受到多种方式严格调节,包括磷酸化、各种构象变化以及内源性抑制剂.例如C末端胞质域的Thr 735和Ser 819发生磷酸化,可增强ADAM17脱落酶活性; 近膜端域的二硫键被蛋白质二硫键异构酶异构化,导致开放构象转换为封闭构象,这限制了磷脂酰丝氨酸的可及性,磷脂酰丝氨酸可作为ADAM17的激活剂; ADAM17在稳态下以二聚体形式存在于细胞表面,组织金属蛋白酶3抑制剂优先选择与二聚体构象的ADAM17结合,从而抑制其活性.另外,非活性菱形蛋白(RHBDF1和RHBDF2)介导其从内质网向质膜转运,被认为是ADAM17成熟的限速步骤[8,10,12,13].
2 ADAM17与消化系统肿瘤的关系
2.1 食管癌 我国的食管癌病例93%以上为鳞状细胞癌(esophageal squamous cell carcinoma,ESCC).Liu等[14]通过RT-PCR检测50例癌及癌旁组织中ADAM17 mRNA的表达,表达水平分别为0.937±0.241和0.225±0.077,差异具有统计学意义(P<0.01).采用免疫组化法检测80例癌及癌旁组织中ADAM17蛋白的表达情况,阳性率分别为66.25%和6.25% (P<0.01).ADAM17 mRNA和蛋白的表达与淋巴结转移和TNM分期有关(P<0.05),而与性别、年龄或组织学分级无关(P>0.05),且与患者的总体生存率有关.结果表明,ADAM17 mRNA和蛋白在ESCC中高表达,在肿瘤的侵袭、转移以及预后中具有重要作用.
与我国不同,西方发达国家的食管癌病理类型多为腺癌(esophageal adenocarcinoma,EAC).Kauttu等[15]报道,在EAC组织和细胞系中,ADAM17 mRNA的表达水平均高于正常对照组,而ADAM17蛋白的表达则无明显差异.研究中还涉及到ADAMs家族的其他几个成员,包括ADAM9、10、12、19,结果显示这些分子表达的水平并不一致.这可能与每个分子的异质性和独特性有关.
值得一提的是,现有文献报道的ADAM17在食管癌中的研究仅限于定性研究,体外细胞学以及体内实验尚未有人报道.ADAM17促进食管癌进展的具体机制尚不明确,需要相关的实验数据来佐证.
2.2 GC Zhang等[16]用RT-PCR和免疫组化法分别对20组和220组癌及癌旁组织进行ADAM17表达检测,结果发现RT-PCR测得的阳性水平为(0.88±0.40)和(0.0±0.03),免疫组化的阳性率为82.73%和20.45%,且ADAM17的表达水平与肿瘤的分化程度、浸润深度、淋巴结转移、远处转移和TNM分期有关.此外,多因素分析表明ADAM17是GC的独立预后指标.说明ADAM17表达的增加与GC侵袭性进展和不良预后相关.
上皮-间质转化(epithelial to mesenchymal transition,EMT)被认为与癌细胞的迁移和侵袭能力有关,是癌症转移中的关键细胞过程,转化生长因子β (transforming growth factor-β,TGF-β)、Notch、Wnt等已被证明是诱导EMT发生的重要的蛋白分子[17].研究发现,ADAM17的表达与TGF-β及p-Smad呈正相关,提示ADAM17可通过TGF-β/Smad通路促进GC细胞的EMT[18].ADAM17还可通过Notch和Wnt信号通路促进GC转移和进展,其基因沉默则降低了具有高转移潜能的SGC-7901细胞的活力和迁移能力[19].除此以外,ADAM17还可通过EGFR和TNF-α/NF-κB信号通路调节GC细胞增殖[20].这些结果都提示ADAM17可作为GC治疗的靶标候选物,在临床实践中有一定的应用前景.
2.3 CRC 许多研究已证实ADAM17可促进CRC细胞的恶性生物学行为,阐明其中涉及的分子机制是CRC防治的关键.Pelullo等[21]报道,大约有50%的CRC病例存在致癌性Ras突变,在K-ras基因突变亚型细胞中,Jagged1配体被大量表达.一方面,K-ras基因突变通过MEK/Erk通路调节ADAM17的活性和生长因子的释放,参与肿瘤发生; 另一方面,Jagged1被ADAM17/PS-γ分泌酶复合物加工成Jag1-ICD,在Kras-MEK/Erk-ADAM17轴的触发下发生Jag1-ICD核蓄积,核内的Jag1-ICD通过CSL/RBP-J调节snail1和snail2启动子活性进而诱发内在的反向信号传导,维持肿瘤进展.Wang等[22]证实,NADPH氧化酶1在CRC组织中高表达,不仅在转录后调节ADAM17蛋白的表达水平,还通过破坏ADAM17与潜在E3连接酶之间的相互作用而稳定ADAM17,以激活ADAM17-EGFR-PI3K-Akt信号通路促进CRC细胞的增殖和侵袭.Park等[23]发现,在CRC细胞中脂多糖与Toll样受体4结合,通过ERK信号传导促进ADAM10、ADAM17以及EMT相关细胞因子(包括IL-8和血管内皮生长因子)表达,ADAM10、ADAM17还可调节MMP2和MMP9的激活,共同促进CRC细胞转移.
此外,ADAM17还与CRC的化疗耐药性有关.Chen等[24]选用ADAM17高表达的SW480细胞株,利用RNA干扰技术敲除ADAM17基因,结果发现siRNA-ADAM17处理后的SW480细胞的迁移能力降低,对西妥昔单抗诱导细胞凋亡的敏感性提高.由此可见,ADAM17可以作为CRC耐药的一个治疗靶点.
2.4 肝癌 Ding等[25]实验发现ADAM17 mRNA在肝细胞癌(hepatocellular carcinoma,HCC)组织中显著表达,且与肿瘤分化程度相关.使用抑制性单克隆抗体或抑制剂靶向ADAM17可削弱肝癌细胞的增殖、转移能力,提高对化疗药物如索拉非尼的敏感性[26],提示ADAM17在HCC进展中发挥了关键作用.
ADAM17可经多种途径促进HCC的发生.Li等[27]发现ADAM17裂解Notch信号通路的配体,通过Notch-1信号介导整合素β活化,激活下游的FAK/PI3K-Akt通路,有利于细胞存活及粘附转移.另外,Notch信号还可通过Notch/Snail/E-cadherin通路调节EMT过程,从而增强癌细胞的迁移和侵袭[26].Abo-El Fetoh[28]还提出Ros/ADAM17/HB-EGF/EGFR/ERK信号级联的机制.活性氧诱导ADAM17水解肝素结合表皮生长因子(heparin binding-epidermal growth factor-like growth factor,HBEGF),产生可溶性HB-EGF与EGFR结合,激活ERK通路,后者与致癌蛋白过度表达有关,导致癌症进展.以上信号通路都足以证明ADAM17在癌症治疗中可以成为新的靶点.
2.5 胰腺癌 胰腺上皮内瘤变是胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDA)重要的癌前病变.Ringel等[29]实验表明,ADAM17在胰腺高级别上皮内瘤变及PDA组织中显著表达,在PDA细胞系中也如此,敲除ADAM17基因可降低PDA细胞的侵袭能力,提示ADAM17参与PDA的发生发展.进一步研究发现,K-ras基因突变驱动了PDA癌前病变的形成[30].K-ras基因突变诱导氧化应激,激活Notch信号传导,上调EGFR及其配体与ADAM17的表达,使得腺泡细胞获得增殖与侵袭潜能.最近有学者[31]提出构建特异性抗ADAM17抗体,即A9(B8)IgG,不但可减少ADAM17底物配体脱落,抑制PanIN向PDA转化,而且能有效抑止EMT,这为ADAM17的靶向治疗提供了理论和技术支持.
2.6 胆囊癌 Wu等[32]通过ELISA和蛋白质印迹法分析表明,ADAM17表达水平的升高可发生在胆囊癌的早期临床阶段,与肿瘤的组织学等级和pT分期密切相关,可作为预测胆囊癌患者预后的独立因素.然而,ADAM17参与胆囊癌发生发展的具体机制有待进一步研究.
3 讨论
ADAM17属于锌蛋白酶中的adamalysin蛋白家族,从胚胎发育到成年,在心脑血管、肾、睾丸、胎盘、卵巢、肺、脾、骨骼肌和中枢神经系统中广泛分布.ADAM17作为关键的裂解酶,其底物覆盖了生长因子(如VEGF、EGF)、细胞因子(如TNF-α、TGF-α、IL-6)和黏附因子(如细胞间黏附分子ICAM-1、CX3CL-1)等80余种蛋白,触发至少三条主要的信号传导途径,即EGF受体、TNFα受体或IL-6受体信号传导.同时,通过比较ADAM17与锌蛋白酶超家族另一成员——基质金属蛋白酶的结构,发现两者结构基本相同,因此ADAM17还能够降解细胞基底膜和细胞外基质,以干预组织重建来促进肿瘤的局部浸润和远处转移.事实证明,ADAM17不但是器官(包括心脏瓣膜、眼睛等)正常发育所必需的,而且在肿瘤发生发展、炎症反应、动脉粥样硬化、高血压等病理过程中发挥重要作用[9,33,34].
4 结论
目前,ADAM17已被证实在多种恶性肿瘤中表达上调,与肿瘤细胞的增殖、迁移、侵袭以及患者的预后密切关联.ADAM17有望成为恶性肿瘤新兴的分子标记物和独立预后指标.ADAM17在消化系统肿瘤中的实质性作用远未阐明.进一步深入研究ADAM17在消化系统恶性肿瘤中的相关信号通路不仅有助于阐明ADAM17在肿瘤中发生发展的分子机制,还会为消化系统恶性肿瘤的靶向治疗提供新的思路.
