分类突破电解原理应用常考题型
2020-10-14◇姜俊
◇ 姜 俊
电解原理的应用是历年高考的必考点,主要围绕电解池的工作原理考查电极反应式的正误判断或书写、离子交换膜的判断及相关计算等.
1 电解原理在物质制备中的应用
例1一种利用H2S电催化制氢并最终制得硫酸的装置如图1所示.b接电源的(填“正”或“负”)极,阳极的电极反应式为

图1
a电极H2S转化为SO2,硫元素化合价升高,发生氧化反应,为阳极,所以b接电源的负极;阳极的电极反应式为

2 电解原理在工业中的应用
例2光电池在光照条件下可产生电压,如图2所示装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过.下列说法不正确的是( ).
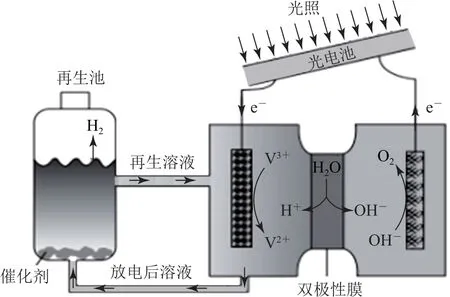
图2
A.该装置将光能转化为化学能并分解水
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.如阳极区为KOH溶液,在光照过程中阳极区溶液中的c(OH-)基本不变
D.再生池中的反应:

由图可知,该装置将光能转化为化学能并分解水,选项A说法正确;双极性膜可将水解离为H+和OH-,由图可知,H+进入阴极,OH-进入阳极,故双极性膜可控制其两侧溶液分别为酸性和碱性,选项B说法正确;光照过程中阳极区反应式为4OH--4e-=2H2O+O2↑,双极性膜可将水解离为H+和OH-,OH-进入阳极,所以溶液中的n(OH-)基本不变,但H2O增多,使c(OH-)降低,选项C说法错误;根据以上分析,再生的反应方程式为

选项D说法正确.答案为C.
3 电解原理在环境治理中的应用
例3利用反应6NO2+8NH3=7N2+12H2O设计为电池可用于消除NO2,其简易装置如图3.
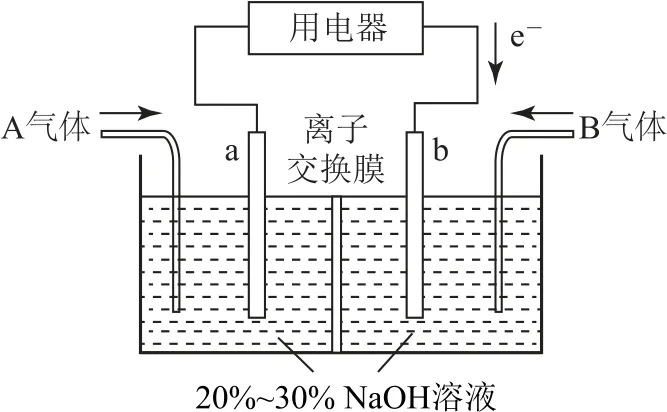
图3
(2)常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为(气体处于标准状况;假设电解过程中溶液体积不变).
(1)b极有电子流入,是正极,NO2得到电子,电极反应式为
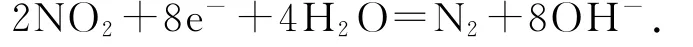
(2)生成KOH的物质的量为0.6L×0.1 mol·L-1=0.06mol,转移0.06 mol电子,a电极NH3放电,1molNH3转移3mol电子,则理论上a极上消耗A气体的物质的量是0.02 mol,标准状况下体积为448mL.
