氯气制备与性质实验一体化的创新设计
2020-10-14许美莲夏加亮
◇ 许美莲 夏加亮
1 问题提出
氯气作为卤素的代表,其制备与性质实验是高中化学中的经典实验之一.氯气的演示实验地位十分重要,但却因氯气有毒,导致师生对氯气心生畏惧.再者,根据教材的实验设计进行演示,用MnO2与浓盐酸混合加热制氯气,能源消耗大而且氯气的性质实验分多步、多装置进行[至少需要8瓶氯气(共约1200 mL)],不仅实验耗时长,操作复杂,耗氯气量大,浪费药品严重,还需要多次打开集气瓶的盖玻片,导致氯气外泄,污染大,危害师生健康.在教授这节内容时,很多教师就直接放弃实验,改为黑板实验或视频实验.
2 研究现状
2.1 实验装置方面
多数是微型实验,可见度低,有的实验需要使用的仪器多,组装烦琐又有难度,有的性质检验类实验偏少,有的没有防倒吸措施,有的反应后装置内残留氯气的处理方法未提及;有些分段实验,所用器材较多、操作频繁、耗时长,每步都要用注射器,甚至需用一支注射器向另一支注射器取氯气,有易扎伤的危险,学生在观察实验时没有安全感.
2.2 实验内容方面
排除干扰是物质检验成功的关键,如果不排除混在氯气中的氯化氢气体,这样检验氯气与水反应是否产生H+和Cl-的方法是无效的;多数实验不干燥氯气,用干、湿试纸做对比研究也无效;有的不检验Cl-;有的不检验氯气是否有漂白性;有的实验在检验氯水中的Cl-时,滴加AgNO3溶液后滴加稀硝酸,但这是不必要的,因为在上一步实验中检验了氯水呈酸性.
笔者经过研究教材和大量文献,结合自己的实验教学经验,多次实验、反复修改,用常规仪器设计出氯气制备与性质实验的一体化创新实验,能弥补以上不足,适合课堂演示.
3 实验仪器、药品及用品
3.1 仪器
250mL集气瓶(1个)、细铁丝(3根)、相应规格的胶塞(7个,根据实验装置选择大小和打孔)、具支试管(2cm×20cm1支,1.5cm×15cm2支);硬质玻璃管(1支)、一次性注射器(10mL、30mL、50mL各1支)、大功率激光笔(1支,2 W)等.
3.2 试剂及用品
KMnO4固体、浓盐酸、紫色石蕊试液、酚酞-NaOH溶 液、淀 粉-KI溶 液、NaBr溶 液、AgNO3溶液、金属钠、蒸馏水、无水CaCl2、NaOH浓溶液、红色纸条、海绵薄片、棉花、石棉绒、橡皮筋.
4 实验几点说明
1)课前准备:取3根长度分别是6cm、7cm、8cm的细铁丝,插在6号胶塞上,8cm长的铁丝插中间,上端分开形成树形,将两小片红色纸条穿插在8cm长的铁丝上端,另两根铁丝上各套上两个棉花团(见图1).
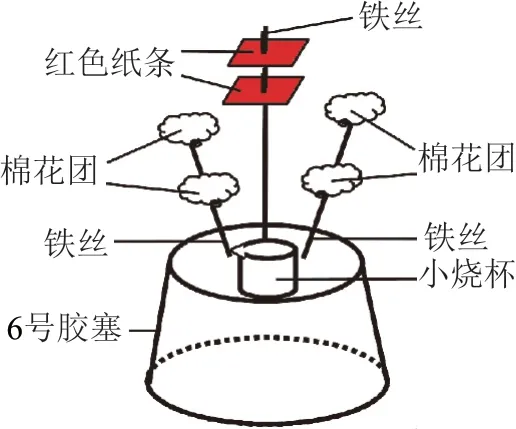
图1
2)选用固体干燥剂和硬质玻璃管作干燥装置,目的是减少使用橡皮管连接仪器,使装置更简便、稳固,以省去夹持仪器.用海绵薄片堵住硬质玻璃管两头防止无水CaCl2进入导管.
3)这里用蒸馏水替代饱和食盐水除去混在氯气中的氯化氢气体,目的不仅是除杂,还可探究氯气的水溶性和制备氯水,且这里水量少,耗氯气不多.但课堂演示时要给学生讲清楚:一般情况下是使用饱和食盐水除氯气中的氯化氢气体.
4)见图2,实验操作前先给集气瓶外的仪器填充试剂并连接好,再给“花树”滴加试剂.把“花树”放入集气瓶后迅速用大胶塞塞紧集气瓶口,立即产生氯气.需防止“花树”在集气瓶内时间太长,各试剂水分蒸发使干燥红色纸条变潮湿.
5 实验步骤及现象分析
1)检查图2装置气密性.向上拉注射器的活塞一段距离,松开,若注射器活塞又回归原位,说明装置气密性良好.
2)用注射器吸入8mL浓盐酸,左、中、右三支具支试管分别装5mL蒸馏水、1.5gKMnO4、用石棉绒垫着的绿豆大小金属钠,硬质玻璃管填满无水CaCl2,气球内注入NaOH浓溶液,组装好这部分仪器.
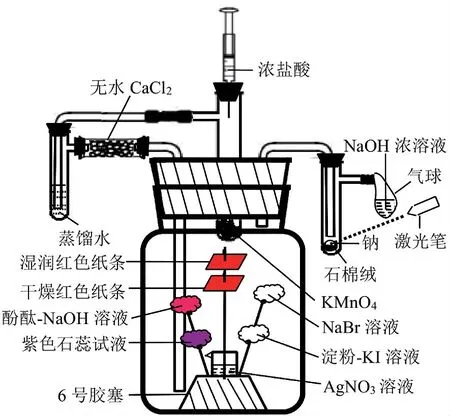
图2
3)滴加相应试剂制成“花树”,再将盛有AgNO3溶液的小烧杯放在插“花树”的6号胶塞上.
4)用镊子夹起“花树”中间这根铁丝,连同小烧杯、“花树”和6号胶塞一起放入集气瓶中.按图2所示连接好实验装置.
5)用力向下轻轻推注射器活栓,使浓盐酸慢慢滴入盛有高锰酸钾晶体的具支试管内,反应立即进行,观察到黄绿色气体产生.
6)观察左侧具支试管内的现象.蒸馏水由无色变黄绿色,推理氯气能溶于水,根据氯化氢极易溶于水的性质推断混在氯气中的氯化氢气体能被水除去,氯气经无水CaCl2干燥后进入集气瓶.
7)观察集气瓶内的现象:当黄绿色气体缓缓从集气瓶底部往上飘时,各反应现象渐渐出现,引导学生边观察边分析边推理.
a)滴有淀粉-KI溶液的棉花团变蓝色,滴有溴化钠的棉花团变橙黄色,说明氯气分别与KI、NaBr反应生成Br2和I2,且氯气的氧化性比Br2、I2强;b)干燥的红色纸条不褪色,湿润的纸条红色褪去,证实氯气没有漂白性,推理氯气与水反应生成有漂白性的次氯酸;c)紫色石蕊试液先变红后褪色,AgNO3溶液中出现白色沉淀,说明氯气与水反应生成了氢离子、次氯酸和氯离子,结合上面的氯水呈黄绿色,进行以下逻辑推理:氯气能与水反应→反应后溶液仍然显黄绿色→溶液中还存在氯气→氯气与水反应不完全→反应是可逆的→书写氯气与水反应的方程式时用可逆号;d)滴有酚酞的氢氧化钠溶液红色褪去,说明氯气能跟氢氧化钠发生反应;e)氯气从集气瓶内的长导管进、短导管出,推理氯气的密度比空气大.
8)观察右侧具支试管内的现象:当右侧具支试管内有淡淡的黄绿色氯气时,用激光笔照射金属钠,钠在氯气中立即燃烧,发出黄色火焰,生成大量白烟.说明氯气有较强的氧化性,且燃烧不一定要有氧气参加.
9)反应结束后,用注射器向集气瓶中注入30mL NaOH浓溶液,然后拔出装浓盐酸的注射器,换上装有空气的50mL注射器,将空气压入中间一支具支试管(多次压入空气),使装置内多余的氯气被集气瓶和气球内NaOH浓溶液全部吸收.
10)为了增强实验的说服力以及实验内容的全面性,探究过程中可增设3个实验.
a)红纸上滴加稀盐酸,以证实盐酸没有漂白性;b)装置中残留的氯气被全部吸收后取出集气瓶内褪色的纸条加热,颜色不复原,说明次氯酸的漂白是不可逆的;c)取少量氯水于试管中并加热,可观察到氯水颜色逐渐变淡,最后变无色,再滴加紫色石蕊试液,溶液变红后不褪色,说明次氯酸不稳定已分解.
6 创新实验的优点
6.1 实验内容丰富全面
该实验以独特的方式完成“制气体→除杂→干燥→性质及产物检验→尾气处理”全过程,实验内容丰富全面,增强了知识之间的相互联系,利于学生构建知识体系,提升“宏观辨识与微观探析”素养.
6.2 实验装置简便美观
1)主要利用注射器、具支试管、集气瓶等常规仪器,实验所需仪器种类少,体现出“一物多用,物尽其用”的理念.
2)不需要用到夹持仪器,完全靠一个集气瓶支撑整套装置,装置简便、稳固,教师可把整套装置拿在手上,在教室内走一圈,以便学生观察,加强教学互动.
3)注射器与气球的巧妙组合起到很好的平衡压强作用,确保实验的安全性,同时培养学生的“变化观念与平衡思想”素养.
4)三支长度不等的铁丝,做成有错落感的“树枝”,把实验装置做成“花树”,简单美观,一套实验装置就是一件美丽的艺术品展示在学生眼前,可以让学生感受到化学之美.
5)实验装置创新、全封闭、无污染,充分体现绿色化学理念,激发学生的创新意识,提升学生“科学探究与创新意识”“科学态度与社会责任”的学科素养.
6.3 实验药品微量节省
紫色石蕊试液、酚酞-NaOH溶液、淀粉-KI溶液、NaBr溶液都只是各用1滴,其他试剂用量也很少,一次性完成8个实验,共耗氯气不到300mL,不到教材中实验方案的氯气总量的,原料利用率高.
6.4 实验操作安全可控
通过控制浓盐酸滴下的速度来控制产生氯气的速率,便于学生观察.从气体制备到性质探究的实验同时进行,操作步骤少、简单安全,反应可控又省时间.
6.5 实验现象明显
该实验使用微型实验的药品量,达到常规实验的可见度,现象足够明显.当学生看到“花树”逐渐变色时,都被眼前的奇观震撼,惊叹不已,让学生感受到化学之妙,见图3、图4、图5.

图3

图4

图5
6.6 实验效果育人深远
本实验教学过程的特点就是引导学生边观察、边分析、边进行逻辑推理,整合完整的知识体系,自主构建知识模型(代表作见图6),让学生明白化学之理,提高“证据推理与模型认知”素养.实验设计灵活高效、节能环保,充分发挥实验的教育功能,践行“立德树人”的教育理念,对学生的成长影响是深远的.
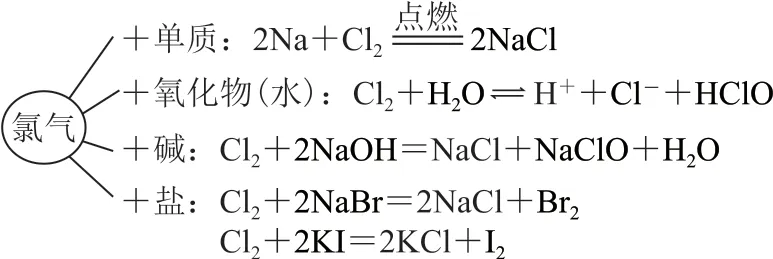
图6
7 结语
本实验以全新的思维方式设计,突出化学之美、化学之妙与化学之理.与教材的实验设计相比较,该创新实验有“四省一不一可见”的优点:省药品、省时间、省能源、省仪器、不污染、可见度高.全方位培养学生化学学科核心素养,需要教师在研究教材、文献和试验、修改实验方案中提高实验功底和专业水平.
