藏木香石油醚快速溶剂萃取物体外抑制肝癌细胞增殖活性研究
2020-10-14黄慧琪吕奕兵林亲雄杨新洲
徐 婵,黄慧琪,吕奕兵,林亲雄,宋 萍,杨新洲*
(1. 华中科技大学同济医学院附属同济医院药学部,武汉 430030;2.青海民族大学科学科技处,西宁 810007; 3.中南民族大学药学院,武汉 430074)
原发性肝癌(hepatocellular carcinoma,HCC)是世界上最常见的肿瘤之一,每年诊断出约78万新的病例,超过745 000例死亡[1],在各种致死恶性肿瘤中居第二位[2-3],且有逐年升高的趋势.男性相较于女性患病几率更高,在30~50岁之间最为常见,约占患病人口的一半.尽管在诊断和治疗技术方面取得了一定的进步,但大多数肝癌患者在确诊后12个月内将丧生.手术治疗通常被认为是治疗肝癌的有效方法,但肝癌患者适用于这种策略仍然很少.因此,大多数肝癌患者必须接受全身化学疗法.顺铂是临床上治疗多种癌症较为有效的抗肿瘤药物之一,但其毒副作用给患者带来严重的疼痛和后遗症.一些广泛应用的抗肿瘤药物都是直接或间接从天然产物中得到的,其中来自天然产物的抗癌药物如长春新碱和紫杉醇在临床上得到广泛应用,并且大量的从植物中提取的抗癌药物已经通过临床评审[4].因此,从天然产物中提取出具有毒副作用小、结构新颖、效果强等优势的抗肿瘤药物,已经成为当今社会研究的热点.
藏木香,又称总状土木香,藏文名为“玛奴”,是菊科旋覆花属植物藏木香(InularacemosaHook. f.)的干燥根[5].藏木香具有健脾和胃、调气解郁等功能,用于胃肠功能失调,岔气作痛等症[5].据文献报道,旋覆花属植物藏木香主要成分为倍半萜、二萜、三萜、甾体和黄酮[5].倍半萜类化学成分是旋覆花属植物的特征性成分,以桉叶烷型、吉马烷型和愈创木烷型为主.研究表明,旋覆花属植物在抗炎、抗肿瘤、抗菌、护肝及糖尿病治疗等方面具有良好的生物活性,其主要的药效成分为倍半萜类物质.从旋覆花属植物中提取出的倍半萜类化合物具有明显的肿瘤细胞毒性[5].例如从Inulaviscaosa叶中提取出的倍半萜内酯对SK-28等人黑素瘤细胞株有细胞毒性[6].从I.graveolens的地上部分分离出的倍半萜ivalin对肿瘤细胞P-388等有明显的细胞毒性[7].因此,从旋覆花属藏药藏木香中寻找抗肿瘤药物存在着巨大的潜能.本文采用溶剂加压提取技术制备了藏木香的石油醚、乙酸乙酯和甲醇三个部位的提取物,以供其体外抗肝癌活性筛选.研究选用HepG2和Hep3B两个肝癌细胞株,采用MTT法测试三种提取物的抗肝癌活性;选用L-02人正常肝细胞株评估藏木香对于人体正常肝细胞的毒性.结果显示了藏木香石油醚提取物具有潜在的抗肝癌活性,本研究能为从藏药中开发新抗癌药物提供想法与思路.
1材料与方法
1.1材料试剂与仪器设备
藏木香药材2015年7月采集于青海省互助县北山林场,经过青海民族大学化学与生命科学学院毛继祖教授鉴定为菊科旋覆花属植物总状土木香的根(InularacemosaHook. f.),药材标本(No. SC0184)存放于中南民族大学药学院标本馆.
细胞株:HepG2和Hep3B人肝癌细胞株及L-02人正常肝细胞株(American Type Culture Collection,Rockville,MD,USA);RPMI 1640培养基:上海拜力生物科技有限公司;小牛血清:上海拜力生物科技有限公司;双抗:上海博耀生物科技有限公司;CDDP(顺铂):Sigma公司;石油醚、乙酸乙酯和甲醇(AR):国药集团;MTT:Sigma公司.酶标仪:Spectra Max 340PC型;CO2培养箱:上海博讯实业有限公司;倒置荧光显微镜:Olympus B202型;96孔、24孔培养板:上海拜力生物科技有限公司.
1.2样品制备方法
采用BUCHI E-916型快速溶剂萃取仪对该药材进行提取[8].使用3个溶剂通道,依次为石油醚、乙酸乙酯和甲醇,待仪器启动,初始化完毕后,执行1次清洗,中途更换使用溶剂种类,各冲洗1次,每次 20 mL,最后用60 s氮气的吹扫.在40 mL的萃取池中加入少量的干净河沙覆盖底层,再将10 g药材粉末加入到萃取池中,表面用干净河沙覆盖,最后用滤纸片封盖,连接上溶剂萃取通道.选择序列模式控制运行,1个样品萃取通道,每个溶剂萃取时间10 min,设定压力为10 MPa,温度为 60 ℃,单个溶剂萃取重复3次,依次切换到另2个溶剂系统,设定参数和次数同第1 个溶剂系统,获得了该药材的3 种溶剂石油醚、乙酸乙酯和甲醇萃取液,用旋转蒸发仪挥发干有机溶剂,得到该药材干燥的石油醚部位(IR-Pe)0.25 g,乙酸乙酯部位(IR-Et)0.48 g,甲醇部位(IR-Me)0.73 g.抗肝癌活性成分筛选采用已制备的IR-Pe、IR-Et和IR-Me,临用前将提取物分别用DMSO溶解,然后用培养基分别稀释到所需浓度.
1.3细胞培养
HepG2和Hep3B人肝癌细胞株及L-02人正常肝细胞株均从美国模式培养物集存库购买(American Type Culture Collection,Rockville,MD,USA),在恒温37 ℃、含有5%CO2的培养箱内生长.细胞培养在DMEM培养基(Hyclone)中,其含有1%抗生素(包括100 U·mL-1青霉素和100 μg·mL-1链霉素)和10%胎牛血清(FBS,Hyclone,USA).
1.4抗肝癌活性筛选
取对数生长期的HepG2和Hep3B人肝癌细胞株及L-02人正常肝细胞,在恒温37 ℃、含有5%CO2的培养箱内培养,然后接种在96孔板中,接种密度为每孔5×104个.运用MTT法测试细胞活力和细胞毒性[9].藏木香提取物溶解在DMSO溶液中,配制浓度为200 μg·mL-1的母液.使用无血清的培养基将母液稀释到终浓度为10、20、30和40 μg·mL-1的待测样品(DMSO浓度低于0.1%).待细胞在96孔板长满后,吸弃培养液.每孔加入200 μL的不同浓度的藏木香提取物;本研究设不加需检测样品的实验对照组和不加需检测样品以及细胞的空白对照组,每种浓度一式5孔,分别在培养基中培养12、24、48 h后,弃去培养液,每孔加入以DMEM配制的5 mg·mL-1MTT溶液100 μL,继续孵育0.5~1 h.然后弃去上清液,加入150 μLDMSO溶解蓝紫色甲臜结晶,酶标仪于562 nm下测定每孔吸光值A.生长抑制率=[1-(实验组吸光值-空白组吸光值)/(对照组吸光值-空白组吸光值)]×100%[10].依据文献[11]说明计算半数抑制浓度(IC50).
1.5抑制HepG2和Hep3B增殖的时效及量效研究
将对数生长期的HepG2和Hep3B人肝癌细胞株以每孔5×104的密度接种在96孔板中,24 h后,每孔加入浓度分别为10、30、50、70 μg·mL-1具有最好抗癌活性的藏木香提取物,同时设不加需检测样品的实验对照组和不加需检测样品以及细胞的空白对照组,每种浓度一式5孔,继续分别培养12 h、24 h和48 h.然后弃掉培养液,每孔加入DMEM配制的5 mg·mL-1MTT溶液100 μL,孵育3~5 h,弃去上清液,加入150 μL DMSO溶解蓝紫色甲臜结晶.在562 nm波长下,运用酶标仪测定每孔OD值.生长抑制率= [1-(实验组吸光值-空白组吸光值)/(对照组吸光值-空白组吸光值)]×100%[10].
1.6倒置相差显微镜观察形态学变化
取对数生长期的HepG2和Hep3B细胞以4×105的细胞密度分别接种到6孔板中.37 ℃,5%CO2条件下孵育24 h后,每孔加入具有最好抗癌活性的藏木香提取物,浓度分别为 0、10、30、50 μg·mL-1以及浓度为25 μg·mL-1CDDP.继续培养一定时间后,使用倒置相差显微镜观察细胞形态学变化.
1.7Hoechst 33258染色实验研究[10]
Hoechst 33258能染色凋亡的细胞核,取对数生长期的HepG2和Hep3B细胞以4×105的细胞密度分别接种到6孔板中.恒温37 ℃,5% CO2条件下孵育24 h后,吸弃培养液,加入浓度为 0、10、30、50 μg·mL-1的具有最佳抗癌活性的藏木香提取物为给药组,加入25 μg·mL-1CDDP为阳性药组[12].继续培养一定时间后,弃去培养液,加入固定液(甲醇与冰醋酸比例为3∶1)1 mL.固定液固定细胞30 min后吸弃,并用PBS洗涤3次后风干,每孔加入5 μg·mL-1Hoechst 33258荧光染色液1 mL,避光染色30 min.然后用PBS洗涤两次后,加入1 mL甘油封片,在荧光显微镜下观察细胞核形态[12].
1.8Annexin V-FITC /PI双染测定细胞凋亡
取对数生长期的HepG2和Hep3B细胞以4×105的细胞密度分别接种到6孔板中.37 ℃,5%CO2条件下孵育24 h后,吸弃培养液,加入具有最佳抗癌活性的IR-Pe使其浓度为0、10、30、50 μg·mL-1,每孔2 mL[12].培养24 h后,加入不含EDTA的胰酶消化并收集细胞,预冷的PBS洗涤3次,每次1 000 r·min-1,离心5 min,取出离心管,倒掉上清,每管分别加入100 μL Binding Buffer(1×)液,并轻柔吹打混匀,重悬细胞后,每管分别避光加入Annexin V-FITC 5 μL并混匀,再避光加入PI 5 μL,吹打混匀,室温下避光孵育15 min后,每管分别加入400 μL Binding Buffer(1×),混匀,采用流式细胞仪检测.
1.9Western blot分析
将细胞用预冷的PBS洗三次后每孔加1 mL冰的PBS,并用细胞刮刀刮下置EP管中,1 500 r·min-1,离心10 min,弃上清液,加入适量体积的蛋白裂解液(加入蛋白酶抑制剂),置冰上裂解5 min后,4 ℃,10 000 r·min-1,离心10 min,上清液转入1.5 mL EP管中,存放于-20 ℃冰箱中.按照BCA蛋白质定量试剂盒方法测定蛋白含量.样品与蛋白上样缓冲液5∶1比例混合,在沸水中变性8 min.配置8%的SDS-PAGE凝胶进行电泳分离蛋白,湿转法将蛋白质转移至NC膜上,以含5%脱脂奶粉的TBST溶液室温封闭2 h,加入相应的蛋白抗体(如caspase-3抗体,按说明书比例稀释),4 ℃振荡器孵育过夜,用TBST洗膜3次后室温孵育二抗2 h,TBST洗膜三次后进行ECL显色、通过Bio-RAD凝胶成像仪成像并用Image Lab3.0.1软件进行光密度值分析.
1.10统计学分析
本研究使用Pearson相关分析法进行分析.多组比较运用单因素方差分析.数据用平均值±标准偏差(mean±SD)表示.*为p≤0.05表示有显著性差异,**为p≤ 0.01表示具有较大显著性差异,***为p≤0.001表示具有极大显著性差异.运用软件GraphPad Prism 5.0统计分析[12].
2结果
2.1藏木香提取物的抗肝癌活性
用两种肝癌细胞株HepG2和Hep3B来测试藏木香三种提取物(IR-Pe、IR-Et、IR-Me)的抗肝癌活性,选取人正常肝细胞株L-02作为对照,初步判定对人体正常细胞的毒性.运用MTT法进行检测,其抗肝癌活性结果见表1.结果表明,藏木香提取物中,藏木香的乙酸乙酯和甲醇提取物均对HepG2和Hep3B细胞未表现出抗肿瘤活性,初筛结果显示IC50大于100 μg·mL-1.藏木香的IR-Pe对HepG2和Hep3B细胞表现出抗肿瘤活性,并且给药24 h后IC50值分别为21.9 μg·mL-1和27.6 μg·mL-1,在浓度大于100 μg·mL-1时对正常肝细胞L-02没有显示出毒性.对培养的HepG2和Hep3B两种肝癌细胞株分别给予0、10、30、50 μg·mL-1的藏木香IR-Pe和25 μg·mL-1CDDP,继续培养12 h、24 h和48 h后,检测相关细胞的存活力以及细胞毒性,以百分比表示(图1).
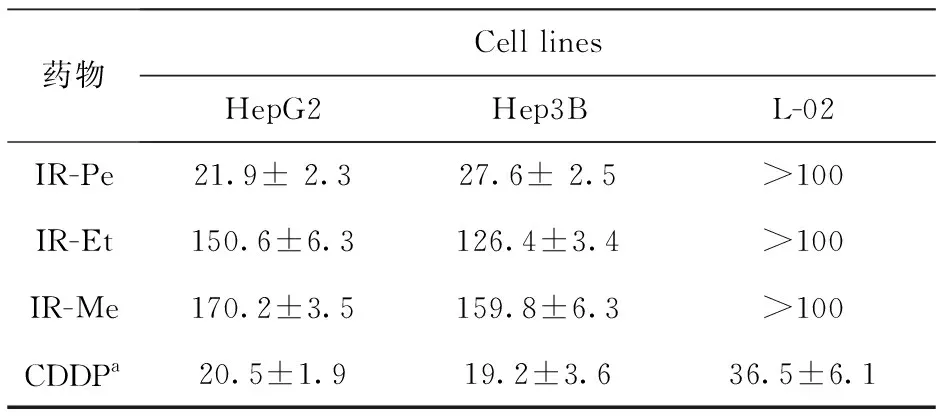
表1 藏木香三种提取部位对细胞活力的影响(IC50,mean ± SD,n=3)Tab.1 Cell viability and cytotoxicity was determinedusing MTT method /(μg·mL-1)

图1 藏木香石油醚部位抑制HepG2和Hep3B增殖的时效和量效图Fig.1 The Petroleum ether fraction of I. racemose time-dependently provoked HepG2 and Hep3B cells apoptosis in vitro
2.2运用倒置相差显微镜观察HepG2和Hep3B细胞株形态学变化
经IR-Pe给药24h后,倒置相差显微镜下观察人肝癌细胞HepG2和Hep3B,形态如下(图2):经藏木香石油醚提取物处理后,细胞皱缩变圆,贴壁性降低,有的凋亡细胞出现凋亡小体,大多数凋亡细胞悬浮于培养液中,并且随着给药浓度的增大,细胞的状态也越来越差,对肿瘤细胞抑制呈现一定的量效关系.对于未经藏木香石油醚提取物处理的HepG2和Hep3B细胞则生长状态良好,细胞圆润饱满、轮廓清晰,细胞紧密排列、贴壁性好.

图2 倒置相差显微镜观察给药后细胞形态学变化Fig.2 Morphologic changes of HepG2 and Hep3B cells were observed by a phase contrast microscope after IR-Pe treatment
2.3运用荧光显微镜观察Hoechst33258对HepG2和Hep3B细胞染色后的形态学变化
人肝癌细胞HepG2和Hep3B细胞经IR-Pe给药处理24 h后,Hoechst 33258荧光染色液染色,在荧光显微镜下观察细胞形态,如图3所示:当IR-Pe作用于HepG2和Hep3B细胞后,细胞核变形皱缩并发出明显的蓝色荧光,并且随着给药剂量的增加,出现典型凋亡细胞核变化的细胞不断增多,即细胞染色质密集皱缩,并出现高亮的凋亡小体.未经药处理的HepG2和Hep3B细胞生长状态良好,细胞核形态均一,并且整体细胞呈现较均匀的蓝色荧光,无明显凋亡细胞.

图3 Hoechst 33258染色观察细胞形态学变化Fig.3 Morphologic changes of HepG2 and Hep3B cells by Hoechst 33258 staining after IR-Pe treatment
2.4Annexin V-FITC/PI双染法检测IR-Pe诱导HepG2和Hep3B细胞凋亡的情况
采用Annexin V-FITC/PI双染法进一步对IR-Pe诱导HepG2和Hep3B 细胞的凋亡情况进行验证.在流式细胞术双染检测中,Annexin V与PI不能标记非凋亡细胞,它们出现在散点图的左下象限Q4;在凋亡细胞中,早期凋亡细胞可以被Annexin V标记,出现在右下象限Q3,晚期凋亡细胞可以被被Annexin V与PI同时标记,出现在右上象限Q2).分析结果如图4所示,给药24 h后,随着IR-Pe浓度的增加,Q2和Q3早、晚期凋亡的细胞数量不断增加.上面结果表明IR-Pe能以剂量依赖的方式诱导肝癌细胞调亡.
2.5Western blot法分析IR-Pe诱导HepG2和Hep3B细胞凋亡的情况
线粒体通路是是细胞凋亡的主要途径之一,受到Bcl-2蛋白家族的调控.抗凋亡蛋白Bcl-2和Bcl-xl可以用来抑制细胞的凋亡[13].Bax蛋白是该家族的促凋亡成员,它的表达增加与靶细胞的凋亡增加联系密切[14].caspase家族在细胞凋亡的起始和执行中起着重要作用.Bcl-2家族通过调节线粒体膜的通透性来控制细胞色素c的释放,从线粒体中被释放到细胞质里的细胞色素c激活caspase级联使下游的caspase-3发生切割并激活,并最终诱导细胞的凋亡.使用western blot法检测Bax、Bcl-2和caspase-3的表达.用不同浓度的IR-Pe处理肝癌细胞(图5)后,Bax和caspase-3的表达上调,Bcl-2的表达下调.利用western blot法分析,IR-Pe降低了Bcl-2与Bax的比例,增加了caspase-3的表达,说明IR-Pe在体外通过线粒体通路显著诱导肝癌细胞发生凋亡.

A) Control group;B) IR-Pe 10 μg·mL-1;C)IR-Pe 30 μg·mL-1;D) IR-Pe 50 μg·mL-1;E) CDDP 25 μg·mL-1图4 IR-Pe对HepG2和Hep3B细胞凋亡的影响Fig.4 Effects of IR-Pe on apoptosis of HepG2 and Hep3B cells

A) Western blot检测Bax、Bcl-2、切割后的caspase-3在HepG2肝癌细胞中的表达,β-actin为内参;B) Western blot法检测Bax、Bcl-2、切割后的caspase-3在Hep3B癌细胞中的表达,β-actin为内参A) Expression level of Bax, Bcl-2, cleaved caspase-3 in HepG2 cells by western blot with β-actin as internal reference; B) Expression level of Bax, Bcl-2, cleaved caspase-3 in Hep3B cells by western blot with β-actin as internal reference图5 IR-Pe通过线粒体凋亡通路诱导凋亡Fig.5 Effects of IR-Pe on the apoptosis regulatory proteins of liver cancer cells
3讨论
本研究中,常用藏药藏木香的三种不同溶剂的提取物(IR-Pe、IR-Et、IR-Me)由快速溶剂萃取法制备,其体外抗肝癌活性研究运用MTT法.结果显示出藏木香具有一定的抗肝癌活性,其石油醚提取物IR-Pe显示出较好的活性,其对HepG2和Hep3B细胞的IC50值分别为21.9 μg·mL-1和27.6 μg·mL-1,且对L-02细胞的毒性较小.肿瘤的发生是基因突变累积导致的生长失控,然而,许多肿瘤仍然保留了启动细胞凋亡的功能.因此,诱导肿瘤细胞凋亡是控制肿瘤的一种重要手段.进一步研究显示IR-Pe抑制肝癌细胞HepG2和Hep3B的活性过程显示出良好的时效、量效关系,倒置相差显微镜与荧光倒置显微镜可以观察出肝癌细胞HepG2和Hep3B的形态变化,如细胞皱缩、核凋亡小体等典型的凋亡特征;并通过流式细胞术双染法,确认了IR-Pe能诱导 HepG2和Hep3B细胞发生凋亡且随着给药剂量增大,凋亡率也随之增加;Western blot分析显示IR-Pe可以激活线粒体凋亡通路而诱导肝癌细胞凋亡.文献表明,从药用植物中提取出的萜类成分具有较好的抗肝癌活性[15].综上所述,藏木香石油醚部位能通过激活线粒体通途诱导细胞凋亡,从而发挥抗肿瘤的作用.但是,关于藏木香石油醚提取物的抗肝癌有效化学成分,还待进一步的研究.藏木香极具有开发为肿瘤药物的价值,继续深入研究藏木香石油醚部位是充分利用中药植物药用价值手段之一,为资源丰富的民族药的开发和利用打下一定的基础.
