酯酶响应性光活化纳米农药的制备与评价
2020-10-14杨梦丹田希铭甘梦琪张冯欣嘉殷以华
杨梦丹,习 婧,代 悦,易 英,田希铭,甘梦琪,张冯欣嘉,殷以华
(武汉理工大学化学化工与生命科学学院,武汉 430070)
传统农药的过度使用已经导致了很多负面影响,比如农药残留、环境污染等[1-4].光活化农药是近年来发展起来的一种新型绿色农药,具有高效、低毒、无污染等优点[5].光活化农药可被光激活,产生具有细胞毒性的单线态氧(1O2),从而起杀虫作用.焰红染料B(PB)是研究最早的光活化农药之一,已证明它至少可以杀死二十多种昆虫.然而,由于体外光解作用,PB的利用率很低,从而限制了它的应用[6].PB光解的主要原因可因于光照下PB被吸收的光子激活,然后将其能量转移到周围基态氧分子中生成了1O2,导致了PB结构中的不饱和部分被氧化[7].因此,提高PB光稳定性的方法是抑制三重态PB将吸收的光能转移到基态氧分子上.因此,设想如果PB与亲水性聚合物共轭形成两亲性聚合物前药,然后在水溶液中自组装形成聚合物纳米粒,疏水相互作用和π-π堆积导致的自聚集对光照下PB的激发态会产生自猝灭效应,这将导致PB吸收的光能不能转移到周围的基态氧分子上,即不能产生单线态氧[8],从而提高了PB的光稳定性.并且,PB被包裹在纳米粒子内部,与溶液中的氧气浓度相比,疏水核中氧的浓度接近于零,在一定程度上也抑制了活性氧的产生.
研究显示昆虫细胞内含有丰富的酯酶[9],而酚酯键可快速响应酯酶刺激而释放药物[10-11].因此,本文以甘氨酸作为连接臂,通过酚酯键将PB接枝到可生物降解的海藻酸钠上,形成两亲性聚合物前药(PB-GSA),然后在水溶液中自组装得到酯酶响应性纳米粒子.通过透射电镜(TEM)和动态光散射(DLS)表征了纳米粒子的形貌和尺寸.此外,还研究了纳米粒子的酯酶响应性释放行为、体外光稳定性和光活性.
1实验
1.1材料
试剂:海藻酸钠(SA,M=232000 g·mol-1,M/G=2.11);焰红染料B等其他试剂均购自国药集团.
仪器:本实验所用光源为冷白荧光灯(23 W,波长范围430 nm~720 nm)、傅里叶变换红外光谱仪(Nexus,Nicolet,USA),核磁共振波谱仪(AVANCEIII type)、透射电子显微镜(TEM: Tecnai G220,FEI,America)、动态光散射仪(DLS,Nano-ZS3600)、荧光分光光度计(F-7000).
1.2甘氨酸焰红染料B酯(PB-G)的制备
根据参考文献[12]中三氟乙酸(TFA)脱BOC保护基的方法和参考文献[13]中HCPT-g-CMCS化合物的合成方法,并加以改进.取BOC-甘氨酸(1 mmol,0.175 g)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl)(1 mmol,0.192 g)和4-(N,N-二甲氨基)吡啶(DMAP)(0.1 mmol,0.012 2 g)用10 mL无水二氯甲烷溶解,密闭搅拌2 h,然后缓慢滴入质子化PB的无水二氯甲烷溶液(0.1 mmol·mL-1,5 mL),氮气保护下室温反应24 h,使用TLC监测,反应结束后旋干溶剂,乙酸乙酯复溶并用酸性水溶液(pH 5.0)洗涤3次,饱和食盐水洗涤3次,然后过滤旋干溶剂,用无水二氯甲烷复溶,冰浴滴加3 mLTFA,30 min后升至室温,氮气下反应6 h.反应结束后除去溶剂,乙酸乙酯复溶,先后用酸性水溶液和饱和食盐水洗涤,然后过滤并旋干滤液得终产物(PB-G).整个过程避光.
1.3光活化农药聚合物前药(PB-GSA)的制备
取0.400 g海藻酸钠溶于5 mL去离子水,加入EDC·HCl(1 mmol,0.192 g)和N-羟基琥珀酰亚胺(NHS)(1 mmol,0.115 g)室温反应6 h,然后向该溶液中加入PB-G(1 mmol,0.865 g),室温反应12 h,反应完成后调节pH至7.4,用乙醇沉淀析出产物,然后抽滤,乙醇洗涤滤饼至滤液为淡红色,然后将滤饼溶于100 mL pH 7.4的磷酸盐缓冲溶液(PBS)中,在纯化水中透析至透析液在紫外540 nm处没有吸收,即为透析干净.最后真空冷冻干燥得光活化农药聚合物前药(PB-GSA).整个过程避光.
采用红外吸收光谱和核磁共振氢谱分别表征其结构,并通过核磁积分计算药物取代度(DS),即通过连接臂甘氨酸连接到SA分子链上的PB基团与糖醛酸单元的比值.DS由式(1)计算.
(1)
式中,IPB-H是PB分子结构中苯环上的氢的积分,化学位移在 7.57 ppm,ISA-H是SA分子链上的氢的积分,化学位移在3.25~3.80 ppm[14].
1.4PB-GSA NPs的制备及表征
称取10 mg PB-GSA 溶于10 mL PBS(pH 7.4),然后超声(100 W)5 min(脉冲2.0 s,间隔2.0 s).然后使用0.45 μm的微孔过滤器过滤,即得均匀分布的纳米粒子(PB-GSA NPs).所有操作均在黑暗中进行.采用动态光散射仪(DLS)检测其粒径和粒径分布,使用透射电子显微镜(TEM)表征其形态.
采用芘荧光探针法测量PB-GSA 纳米粒子的临界聚集浓度(CAC).配制浓度分别为0.5、0.25、0.1、0.075、0.05、0.025、0.01、0.007 5、0.005、0.002 5、0.001 mg·mL-1的纳米粒子溶液,然后加入等量芘,使其浓度为6×10-7mol·L-1.使用荧光分光光度计检测芘的荧光发射光谱,激发波长为336 nm,发射波长为300 nm~550 nm,扫描速度为2 400 nm·min-1,PMT 电压为500 V,将第一个峰 (373 nm) 和第三个峰 (384 nm)的荧光强度做比值(I373/I384),以浓度的对数为横坐标,I373/I384为纵坐标作图,拐点处即为CAC.
1.5PB-GSA NPs的酯酶响应性释放研究
将5 mLPB-GSA NPs(2 mg·mL-1)溶液置于透析袋中(截留相对分子质量为8 000~14 000),然后分别浸泡于40 mL的空白PBS和含10 U·mL-1酯酶的PBS(pH 7.4)中,室温下以80 r·min-1持续振荡.在预先设定的时间间隔内取3.0 mL透析液,并在释放容器中加入3.0 mL同种的新鲜释放介质(分别为空白PBS和含10 U·mL-1酯酶的PBS).用荧光分光光度计测定所取透析液的荧光强度(激发波长: 275 nm;发射波长范围: 200~700 nm;扫描速度:2 400 nm·min-1;PMT 电压:400 V),即为PB的荧光强度,通过标准曲线计算PB的释放量.每组实验重复3次,取平均结果.PB的累积释放率(CR)用式(2)计算.
(2)
式中,V为缓冲溶液的体积(mL);V1为采样体积(mL);Cn为第n次采样时PB的浓度,按照标准曲线计算得出(mg·mL-1);W0为载药量(mg);n是采样次数.
1.6PB-GSA NPs的体外光稳定性研究
以等量游离PB作为对照,将0.2 mg·mL-1的PB-GSA NPs溶液暴露在23 W的冷白色荧光灯下照射,距离约20 cm.将溶液置于四面透光的比色皿中,测其荧光发射光谱随光照时间的变化.PB的光降解率(DR)用式(3)计算.
(3)
式中,Ft表示t时刻的样品荧光发射强度;F0表示初始时样品的荧光强度;t表示采样时间.
为了验证纳米粒子中PB的自聚集是纳米粒子光稳定性的原因,将未光照和光照270 min后的纳米粒子分别在10 U·mL-1酯酶溶液中培育30 h,然后用荧光分光光度计在275 nm的激发波长下测量它们的荧光发射光谱(其检测方法和参数如1.5所述).并用同样的方法测量了未光照的游离PB溶液和PB-GSA NPs溶液.所有操作均在黑暗中进行.
1.7PB-GSA NPs的光活性研究
L-酪氨酸(L-Tyr)可被多种光敏剂产生的单线态氧氧化,导致其在305 nm处的荧光发射强度降低.故根据文献[15]中报道的方法,稍加改进,评估了酯酶诱导的光活性.
因为酶由氨基酸组成,也容易被1O2氧化,为了排除1O2对酶的氧化影响,对PB-GSA样品进行了预处理.将一定量的纳米粒子(含200 μg PB)在含酯酶(10 U·mL-1)的PBS(pH 7.4,100 mL)中培育30 h.然后在截留相对分子质量为1 000的透析袋中透析,酶的相对分子质量大于1 000则被截留在透析袋内,故收集含有PB的透析液.所有操作均在黑暗中进行.然后将等量的L-Tyr(0.002 mg·mL-1)添加到预处理过的样品中,通氧气15 min后用冷白荧光灯照射溶液.采用荧光分光光度计在275 nm的激发波长下检测L-Tyr的荧光发射光谱,激发波长为 275 nm,发射波长范围为 200~500 nm,扫描速度为2 400 nm·min-1,PMT 电压为400 V.每组实验重复3遍以获得平均结果.同时,未光照的游离PB和未经酯酶处理的PB-GSA NPs溶液采用同样的方法测定其光活性.
2结果和讨论
2.1PB-G 和 PB-GSA的合成与结构表征
PB-GSA的合成原理和纳米粒子自组装过程及其酯酶响应性释药如图1所示.首先,Boc-甘氨酸在EDC·HCl 和 DMAP催化下与PB酯化,然后TFA除去氨基保护基(Boc).最后通过酰胺化接枝到海藻酸钠上得到PB-GSA.水溶液中,疏水的PB端在疏水作用力的驱动下,趋向于相互聚集形成疏水核心,而带有大量羧基和羟基的亲水性的SA聚合物分子链相对伸展,形成包裹疏水核的亲水外壳.这种核壳结构的纳米粒子保证了聚合物前药在水溶液中的稳定性.而在一定浓度的酯酶刺激下,PB-GSA 结构中的酚酯键被水解,PB被释放出来.被释放的PB在光照下产生有细胞毒性单线态氧,从而杀死害虫.
图2显示了SA、PB、PB-G和PB-GSA的红外光谱图.PB的苯环骨架振动的4个特征峰分布在1 603 cm-1、1 556 cm-1、1 502 cm-1和1 457 cm-1,1 353 cm-1、1 241 cm-1是PB的C-O伸缩振动,969 cm-1是苯环的C-H面外弯曲振动.和原料PB相比,中间产物PB-G的红外光谱出现了双峰3 505 cm-1和3 476 cm-1(N-H伸缩振动)、1 774 cm-1(酯基的C=O伸缩振动)、1 214 cm-1和1 132 cm-1(酯基C-O反对称和对称伸缩振动),由此证明甘氨酸与PB酯化成功.SA的红外特征峰有3 397 cm-1(O-H伸缩振动)、2 958 cm-1和1 421 cm-1(C-H伸缩振动和面内弯曲振动)、1 605 cm-1(-COO-非对称伸缩振动)、1 040 cm-1(C-O、C-C伸缩振动).与SA相比,PB-GSA的红外光谱新出现了1 739 cm-1(酯基C=O伸缩振动)、1 247 cm-1和1 035 cm-1(酯基C-O反对称和对称伸缩振动)、1 631 cm-1(酰胺C=O伸缩振动)、1 404 cm-1(酰胺C-N伸缩振动),这些特征峰的出现进一步证明了PB-GSA的成功合成.
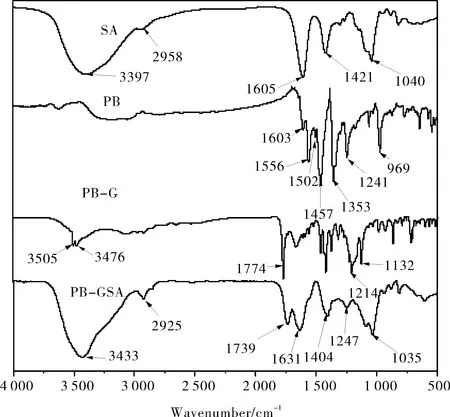
图2 SA、PB、PB-G和PB-GSA的红外光谱图Fig.2 The FTIR spectra of SA,PB,PB-G and PB-GSA
图3显示了SA、PB、PB-G和PB-GSA的1H-NMR谱图.PB的1H NMR谱有一组峰,化学位移在7.57 ppm,归因于苯环上的氢.与PB相比,中间产物PB-G的1H NMR谱不仅具有PB苯环上的质子特征峰(位于7.35 ppm),还在3.97 ppm出现新的质子峰,归属于甘氨酸-CH2-的氢,说明成功合成了中间体PB-G.PB-GSA的1H NMR谱出现了SA的质子特征峰(位于3.25 ppm~3.80 ppm)和PB苯环上的质子特征峰(位于7.49 ppm).证明成功合成PB-GSA.此外,根据核磁积分计算PB的取代度为6.53%.

图3 SA、PB、PB-G和PB-GSA的1H-NMR 谱图Fig.3 The1H-NMR spectra of SA, PB,PB-G and PB-GSA
2.2PB-GSA NPs的表征
两亲性聚合物可以在水溶液中自发地形成纳米粒子.形成纳米粒子的最低浓度称为临界聚集浓度(CAC).本文通过芘荧光探针法测定了PB-GSA NPs的CAC,约为0.042 3 mg·mL-1(图4A).低CAC表明PB-GSANPs能够抵抗自然环境液体的稀释,如雨水和露水.这对保护光活化农药不外泄、提高杀虫效率具有重要意义
图4B显示了PB-GSA NPs在PBS中的粒径分布,其平均粒径为220±5.32 nm,多分散指数(PDI)为0.110 ± 0.034.TEM(图4C)显示其平均粒径为198±3.64 nm,具有相对均匀的球形核壳结构.然而从TEM图观察到的粒径明显小于亲水动力学粒径,这是由于在制备用于透射电镜观察样品的干燥过程中,纳米粒子发生收缩,导致粒径相对偏小[16].

图4 PB-GSA NPs的临界聚集浓度(A),粒径分布图(B)及透射电镜图(C)(标尺:200 nm)Fig.4 Characterization of PB-GSA NPs including CAC (A),size and its distribution in pH 7.4 PBS (B) and TEM images(C) (scale bar: 200 nm)
2.3PB-GSA NPs的酯酶响应性释放研究
本文模拟昆虫细胞环境研究了PB的释放.结果如图5所示,在不含酯酶的空白PBS中培育70 h后PB-GSA NPs仅释放了约6.5%的PB,然而,相同时间内在10 U·mL-1酯酶的PBS中,PB的累积释放率达到33.5%.这是因为在不含酯酶的情况下,酚酯键在pH 7.4的PBS中保持稳定.一旦将酯酶添加到释放介质中,PB-GSA分子结构中的酚酯键就会发生酶催化的水解,从而释放出PB.
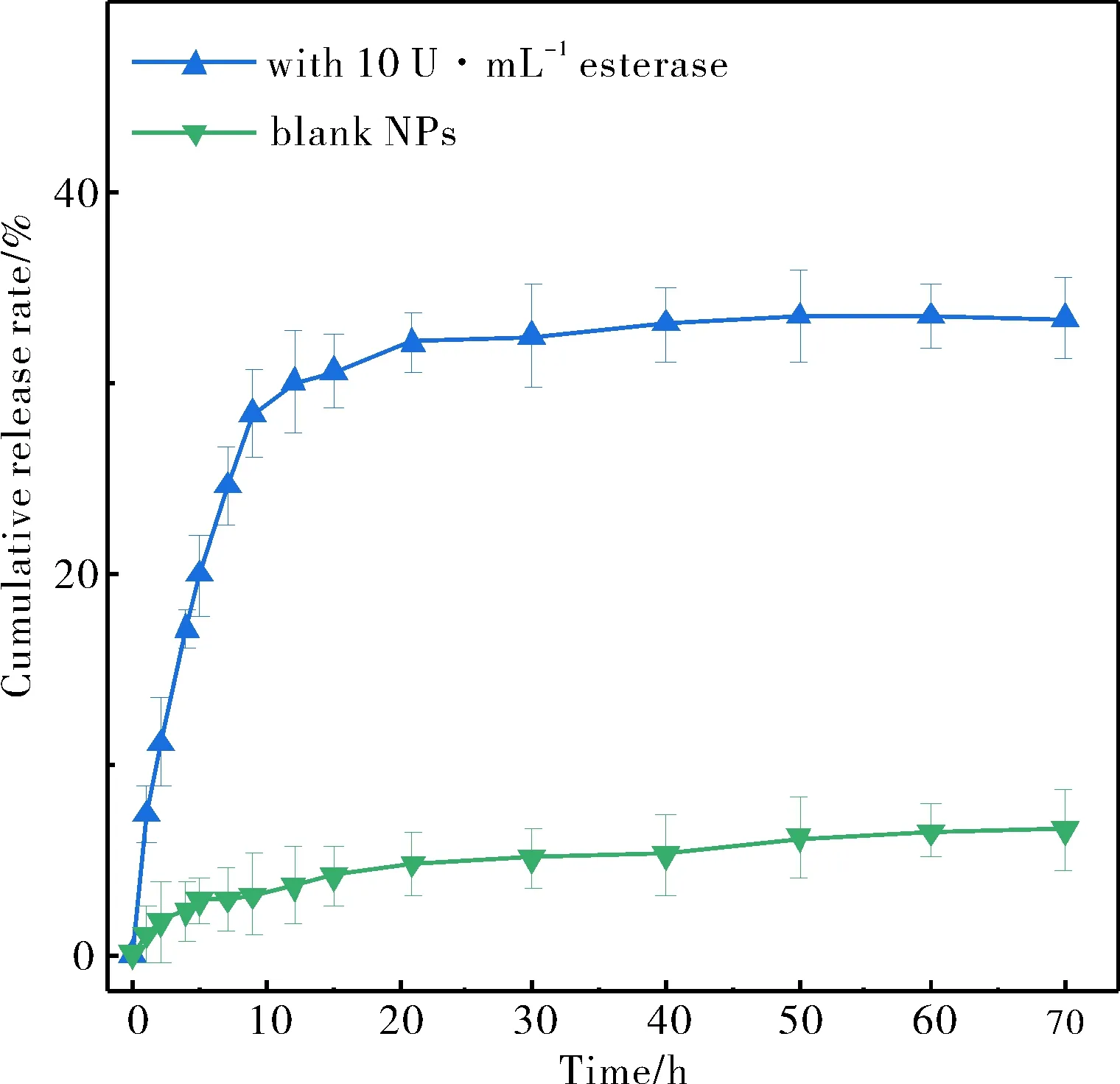
图5 PB-GSA NPs的酯酶响应性释药曲线Fig.5 Esterase-responsive drug release curves of PB-GSA NPs
2.4PB-GSA NPs的体外光稳定性研究
PB的累计氧化率如图6A所示,游离PB在光照270 min后降解率达到99%,而纳米粒子中的PB降解率不超过10%.黑暗中游离PB和纳米粒子样品的PB氧化率几乎为零.表明PB-GSA NPs有效的保护了PB免于降解,提高了其体外光稳定性.
图6B显示,光照前游离PB溶液的荧光发射强度明显高于PB浓度一致的纳米粒子溶液,这说明纳米粒子的形成引发了荧光淬灭,为了证明不是纳米粒子中PB的结构破坏引起的荧光淬灭,进一步用酯酶培育30 h后发现,纳米粒子的荧光发射强度明显得到增强,一方面表明纳米粒子中PB的结构并未被破坏,另一方面也证明纳米粒子确实引发了淬灭效应.纳米粒子的形成过程中,在疏水作用力和分子间π-π相互作用下疏水性PB倾向于聚集,聚集进而导致了激发态自淬灭效应,从而引起荧光强度的减弱.而当酯酶培育30 h后,触发了PB的释放,聚集在疏水核心的PB被释放到溶液中,由于不能完全实现百分百释放,所以纳米粒子释放后的荧光强度仍略低于游离PB溶液.同样用酯酶培育光照后的纳米粒子溶液并测其荧光发射光谱,结果显示其荧光强度与光照前的一致,这表明光照后纳米粒子中的PB结构依然完整未被降解.由于1O2可以氧化PB的不饱和部位,导致PB降解,而自猝灭效应可以阻止能量向周围基态氧分子的转移,从而抑制1O2的产生,所以自淬灭效应可以增加PB的体外光稳定性.
另外,与溶液中的氧分子浓度相比,纳米粒子疏水核中的氧分子浓度很低,这也切断了1O2的生成,从而提高纳米粒子中PB的体外光稳定性.

(A) 游离PB和纳米粒子中PB在黑暗和光照下的累计降解曲线;(B)游离PB、纳米粒子、经酯酶培育的和光照后再经酯酶培育的纳米粒子的荧光发射光谱(A) Cumulative degradation rate (%) of the PB conjugated in nanoparticles and free PB in the dark and light as function of time; (B) Fluorescence emission spectrum of free PB,NPs and NPs incubated by esterase and incubated by esterase after illumination图6 PB-GSA NPs的体外光稳定性Fig.6 In vitro photostability of PB-GSA NPs
2.5PB-GSA NPs的光活性研究
PB的体外光活性如图7所示,游离PB溶液中,光照200 min后L-Tyr的氧化率达到99%,表明游离PB产生了大量的1O2,导致溶液中的L-酪氨酸被大量氧化.而含有等量PB的PB-GSA纳米粒子中的L-Tyr氧化率非常低(小于14%),这进一步支持了纳米粒子的体外光稳定性.然而,一旦溶液在光照前用酯酶孵育30 h后,L-Tyr氧化率达到41%.如体外药物释放研究中所解释的,PB-GSA结构中的酚酯键被裂解以释放出PB.导致自猝灭效应被抑制,PB的荧光得到恢复(如图6B所示),从而显示出较高的光活性.虽然PB杀虫活性很强,但是在自然环境中,由于农药不能及时的接触昆虫,容易造成大量的降解和浪费.正如2.4节所述,PB暴露在阳光下很快被光解失去活性,而PB-GSA NPs具有良好的体外光稳定性,可以保护其在未进入昆虫体内前不被降解.一旦与昆虫细胞中富含的酯酶接触,即释放出PB,显示出光活性,起杀虫效用.此外,光活化农药的杀虫作用具有高效性,每个农药分子每分钟可以产生上千个活性氧,氧化数千个目标分子,所以纳米农药制剂不仅降低了光活化农药的降解率,还减少了农药使用剂量,延长了施用寿命.

图7 不同培育介质中L-酪氨酸的累积氧化率Fig.7 Cumulative oxidation rate of L-Tyrosine in different media
3结论
本文以生物可降解的海藻酸钠为主要原料,甘氨酸为连接臂,PB为农药模型,制备了一种基于酚酯键的酯酶响应性光活化纳米农药(PB-GSA NPs).DLS和TEM显示PB-GSA NPs为粒径在220±5.32 nm的核壳结构.由于NPs中PB激发态的自猝灭效应在光照下能够抑制PB的光降解,从而表现出较高的体外光稳定性.此外,NPs能够响应酯酶的刺激而释放农药PB,并且释放的PB具有较高的光活性.因此,酯酶响应性纳米农药有望成为提高光活化农药体外光稳定性和增强害虫防治的新策略.
