G3BP1与乳腺癌内分泌治疗耐药的相关性研究
2020-10-14李晶晶王小磊任鹏飞李烦繁
董 翔,李晶晶,高 聪,王小磊,任鹏飞,王 弦,李烦繁
2018年全球癌症统计报告(GLOBOCAN)显示, 乳腺癌是女性最为常见的恶性肿瘤,发病率(46.3%)与死亡率(13.0%)均高居首位[1]。2013年的St Gallen共识将乳腺癌分为Luminal A型、Luminal B型、HER-2扩增型和三阴型等4种分子亚型[2]。Luminal型(Luminal A型和Luminal B型)为乳腺癌最常见的分子亚型,占总发病率的60%~70%[3]。内分泌治疗是该型乳腺癌患者的重要治疗手段,药物选择包括雌激素受体调节剂他莫昔芬和芳香化酶抑制剂阿那曲唑、来曲唑等。但并不是所有的患者都能从中获益,有20%~40%的乳腺癌患者在一线治疗中即产生耐药[4]。因此克服乳腺癌内分泌治疗耐药是提高目前临床治疗效果的关键。现有研究[5]显示,多种关系到细胞生长增殖的信号通路激活与内分泌耐药有关,且与雌激素受体(estrogen receptor,ER)通路间存在串扰现象,包括表皮生长因子受体(EGFR,HER-2)、成纤维细胞生长因子受体(FGFR)、胰岛素样生长因子-1受体(IGF-IR)以及下游的MAPKs、PI3K/Akt/mTOR等。
G3BP1是首个发现的RasGAP SH3结构域特异性结合蛋白,由人类5号染色体上的g3bp1基因编码[6], 参与肿瘤细胞的生长、增殖和凋亡等多个环节,在多种肿瘤细胞中过表达[7]。近年来不断发现G3BP1与肿瘤细胞耐药的相关性,先是有文献[8]报道在乳腺癌细胞中,G3BP1高表达可引起阿霉素的化疗耐药。另有研究[9-10]表明,G3BP1在其他肿瘤细胞中涉及乳腺癌内分泌耐药通路。因此该研究通过基因数据库分析和临床病理标本检测初步探讨G3BP1在乳腺癌内分泌耐药中的作用,旨在探索与耐药相关的分子机制及标志物,为延缓甚至逆转内分泌治疗耐药提供可能的理论依据。
1 材料与方法
1.1 基因芯片数据提取高通量基因表达数据库(Gene Expression Omnibus,GEO) 隶属美国国立卫生研究院的NCBI,于2000年创建,收录了各国研究机构提交的基因表达数据,是现今最大、最全面的公共基因表达数据资源。以“G3BP1 and breast and endocrine therapy”在GEO数据库中 (https://www.ncbi.nlm.nih.gov/geoprofiles)进行检索,纳入G3BP1 mRNA在内分泌治疗药物中的表达数据。
1.2 临床资料收集2012年10月~2018年10月安徽医科大学第二附属医院肿瘤科收治的、经病理证实的Luminal型乳腺癌手术蜡块标本。根据以下要求入组:年龄>18岁;女性;原发单侧乳腺癌;病理确诊为浸润性导管癌;非IV期患者;激素受体阳性[ER和(或)PR阳性,ER和PR阳性定义为免疫组化染色阳性细胞在10%以上者];HER-2阴性[HER-2(-)或(1+)者判定为阴性,(3+)者判定为阳性,(2+)者原位荧光杂交法(FISH)再次检测];术后系统治疗后辅助内分泌治疗(他莫昔芬或芳香化酶抑制剂)。Ki-6≥14%定义为高表达,<14%定义为低表达。
1.3 分子分型根据2013年St Gallen共识,将本研究中的Luminal乳腺癌患者进一步分为3种分子亚型: Luminal A型:ER(+)和(或)PR(+),HER-2(-)且低表达Ki-67;Luminal B,HER-2阴型:ER(+)和(或)PR(+),HER-2(-)且高表达 Ki-67;Luminal B,HER-2阳型:ER(+)和(或)PR(+)且 HER-2(+)。由于既往研究证实HER-2可能与ER通路之间存在串扰机制,影响内分泌治疗耐药[6],因此在病例收集中排除Luminal B,HER-2阳性的乳腺癌患者。
1.4 治疗情况所有患者均接受规范化的局部(手术或放疗)及系统治疗(辅助化疗和辅助内分泌治疗)。手术方式为乳腺癌改良根治术;辅助放疗指征为原发肿瘤>5 cm、腋窝淋巴结阳性数>4个或腋窝淋巴结清扫数<10个,但腋窝淋巴结阳性数>20%、胸肌筋膜受侵及手术切口阳性;辅助化疗方案采用蒽环类药物为基础的化疗,或紫杉类为基础的化疗,或蒽环类联合紫杉类为基础的化疗;辅助内分泌治疗用药为他莫昔芬或芳香化酶抑制剂。
1.5 分组情况第4版晚期乳腺癌国际指南共识将内分泌治疗耐药细分为原发性耐药和继发性耐药。辅助内分泌治疗2年内或晚期一线内分泌治疗不超过半年即出现肿瘤复发进展的视为原发性耐药;辅助内分泌治疗超过2年或治疗结束后1年内出现复发转移,或者晚期一线内分泌治疗超过半年出现肿瘤进展的视为继发性耐药[11]。因此将所有患者分为原发耐药组、继发耐药组、敏感组3组。原发耐药组定义为辅助内分泌治疗时间<2年复发(局部复发或转移);继发耐药组定义为辅助内分泌治疗时间>2年,未满5年或5年疗程结束后12个月内复发(内分泌治疗标准疗程为5年);非上述情况者定义为敏感组。
1.6 随访随访时间以手术时间为起始时间,2019年4月1日为截止时间。所有患者采取住院或门诊病历随访,部分患者通过电话随访。随访内容包括服药情况、初次复发时间及复发部位。
1.7 主要试剂鼠抗人G3BP1单克隆抗体(sc-81940)购自美国Santa Cruz生物技术有限公司;两步法免疫组化检测试剂盒(PV-6000)购自北京中杉金桥生物技术有限公司。
1.8 免疫组化染色肿瘤蜡块标本均经100 ml/L中性甲醛固定,常规石蜡包埋后做4 μm切片。制备好的切片于二甲苯溶剂中脱蜡并逐级梯度乙醇水化,30 ml/L双氧水孵20 min以阻断内源性过氧化物酶,柠檬酸缓冲液中微波修复抗原,5%牛血清白蛋白封闭10 min后滴加G3BP1抗体,4 ℃过夜,二抗孵育30 min后DAB显色,苏木精复染,蓝化,梯度乙醇脱水,二甲苯2 min后中性树胶封片。
1.9 结果判断染色结果判定采用 Sinicrope 改良法[12]。在低倍镜(×100 倍)下选取染色定位准确、染色密度强的部位,在高倍镜下(×400 倍)随机选取5个视野, 每个视野数计数肿瘤细胞100个并计算染色细胞数,分5级,0分:染色细胞 <5%;1分:染色细胞5%~25%;2分:染色细胞25%~50%;3分:染色细胞50%~75%;4分:染色细胞>75%。染色强度分4级,0分:无色;1分:胞核或胞质内均匀分布浅黄色颗粒;2分:深棕黄色;3分:棕黑色,胞浆内呈粗大颗粒或块状棕褐色。将染色细胞计数分数×染色强度分数,所得分数<1分为(-),2~3分为(+),4~6分为(),≥7分为(),(-)和(+)判为低表达,()、()判为高表达。所有免疫组织化学切片由2名病理医师分别阅片,结果一致者为最后判定。
2 结果
2.1 GEO数据库提取结果GSE67916是在GEO数据库下载的经4-羟基三苯氧胺(4-hydroxytamoxifen,4-OHT)处理的乳腺癌MCF-7细胞数据集,包含10例他莫昔芬耐药细胞株和8例他莫昔芬敏感细胞株,分析平台为GPL570,G3BP1 mRNA在平台中对应的探针号为201514_s_at、244396_at和242422_at;GSE10911是经阿那曲唑处理的MCF-7细胞数据集,包含3例阿那曲唑耐药细胞株和3例阿那曲唑敏感细胞株,分析平台为GPL571,G3BP1 mRNA在平台中对应的探针号为201503_at和201514_s_at。分析结果显示:耐药细胞株中的G3BP1 mRNA表达水平高于敏感细胞株(P<0.05)。见表1。
2.2 病例收集由于内分泌治疗患者绝大多数手术时间距今较长,蜡块收集难度大,最终仅收集原发肿瘤蜡块标本41例。其中接受他莫昔芬治疗的32例(78.0%),来曲唑治疗的9例(22.0%)。17例在辅助内分泌治疗2年内出现复发转移(41.5%),提示为原发性耐药;10例在内分泌治疗2年后,未满5年出现复发转移(24.4%),提示为继发性耐药;14例在完成5年内分泌治疗后12个月内未出现复发转移(34.1%),提示为内分泌治疗敏感。所有患者的临床病理资料见表2。
表1 基于GEO数据库分析他莫昔芬耐药细胞株的G3BP1mRNA水平
2.3 G3BP1蛋白表达与内分泌治疗耐药的关系G3BP1蛋白染色主要位于癌细胞的细胞质内 (图1)。在内分泌治疗原发耐药组中G3BP1高表达率为84.26%(图1A),继发性耐药组中为30.00%(图1B),敏感组中为28.60%(图1C),3组间G3BP1蛋白的高表达率差异有统计学意义(P<0.01),见表3,原发耐药组中G3BP1蛋白的高表达率高于继发耐药组(84.62%vs30.00%,P<0.05)和敏感组(84.62%vs28.60%,P<0.05),但继发耐药组的G3BP1表达情况与敏感组差异无统计学意义(30.00%vs28.60%,P>0.05)。
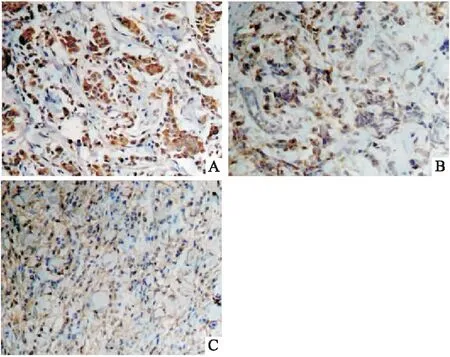
图1 G3BP1蛋白在三组中的高表达情况 IHC×200
3 讨论
内分泌治疗是Luminal型乳腺癌最有效的治疗方式,然而耐药问题无法避免。即使雌、孕激素受体均为阳性,最终也仅有70%左右的患者初始治疗有效,30%的患者存在内分泌治疗原发性耐药,初治有效的患者在药物维持一段时间后也相继出现继发性耐药。内分泌治疗耐药已成为临床上亟待解决的重要问题。
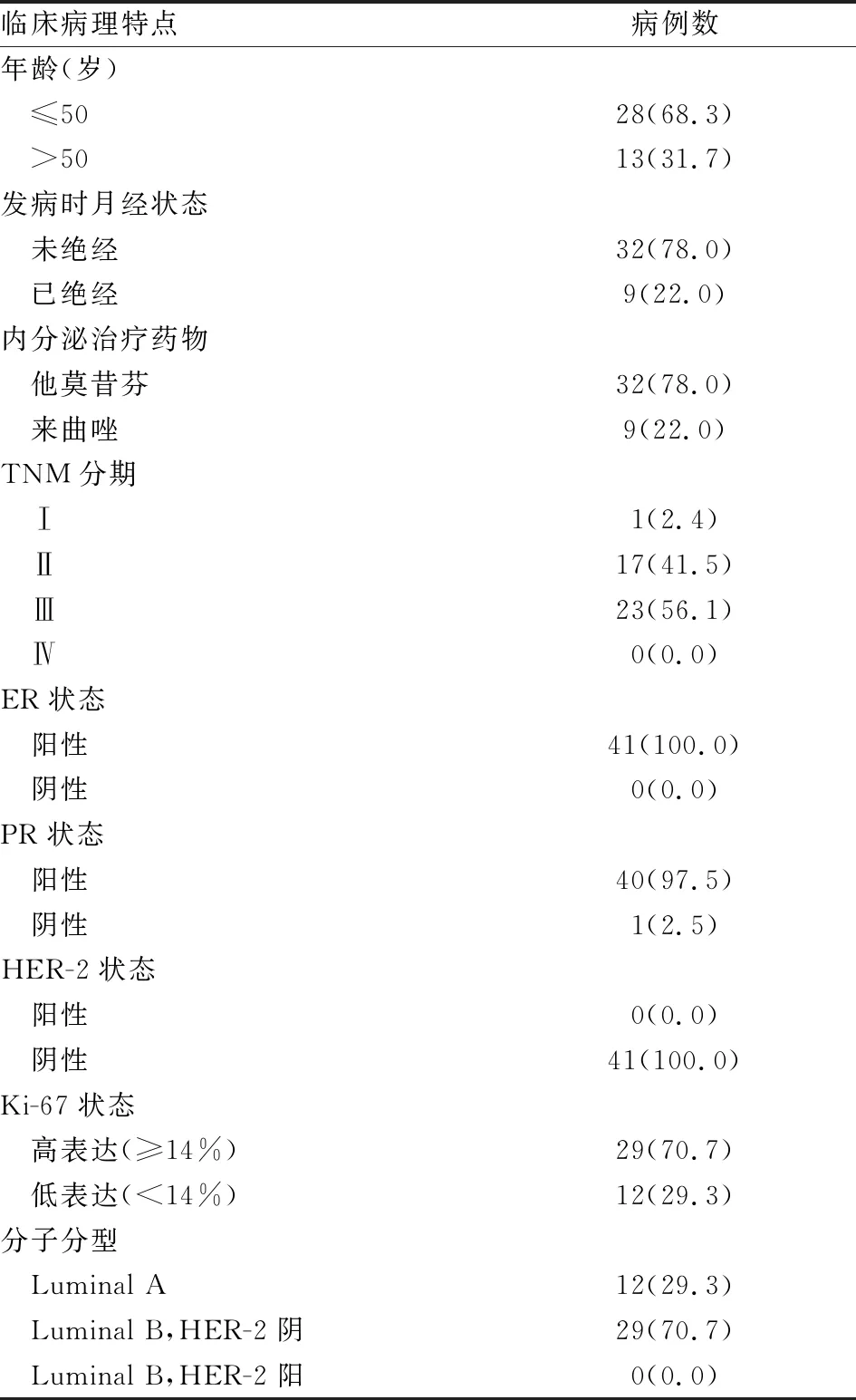
表2 乳腺癌患者的临床病理资料[n(%)]
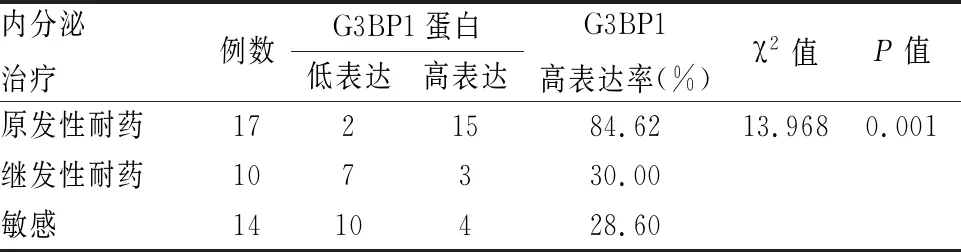
表3 乳腺癌组织中G3BP1蛋白表达与内分泌治疗耐药
本研究通过基因数据库分析得出乳腺癌内分泌治疗耐药细胞株中的G3BP1 mRNA表达水平高于敏感细胞株。PI3K/Akt/mTOR通路被证实是乳腺癌内分泌治疗耐药的重要通路[13],活化的PI3K/AKT及下游信号分子将ERα的Ser104、Ser106、Ser118和Ser167等氨基酸残基磷酸化,引起ERα非激素依赖性激活,促使肿瘤细胞失去对内分泌治疗的敏感性而产生耐药。有研究[10]显示,下调G3BP1表达水平可以降低PI3K/AKT信号通路活性从而抑制食管癌细胞增殖,因此我们猜测G3BP1是否可能通过PI3K/Akt/mTOR通路参与乳腺癌内分泌治疗耐药,这将有待于本课题组的进一步研究证实。
本研究通过免疫组化染色结果显示原发耐药组中G3BP1蛋白的高表达率明显高于继发耐药组和敏感组,提示G3BP1高表达容易引起原发内分泌耐药。目前ER表达缺失被认为是原发性耐药的主要机制,造成ER表达缺失的原因包括:Ras/Raf/MAPK通路过度活化;ER启动子CpG岛异常甲基化、组蛋白去乙酰化;缺氧等[14]。RasGAP是Ras蛋白的主要负性调节子,而G3BP1能与RasGAP SH3结构域特异性结合调节RasGAP的活性进而调控Ras信号通路[6],猜测G3BP1可能通过调控Ras信号通路活性参与乳腺癌原发耐药,这也将作为本课题组的下一步研究重点。继发耐药组与敏感组的G3BP1表达水平差异无统计学意义,可能与样本量收集较少有关,但从高表达率上仍可看出递减趋势。继发性耐药的精确生物学机制尚不清楚,考虑其基于某个特异性基因调控改变的可能性较小,而是多种机制共同作用的结果[14]。
综上所述,G3BP1与乳腺癌内分泌治疗耐药密切相关,G3BP1有可能成为预测乳腺癌内分泌耐药和治疗过程中的新靶点。本研究的不足之处在于收集的样本数较少,需进一步扩大样本量来验证假设;G3BP1与乳腺癌耐药信号通路间的具体联系尚不清楚,有待于进一步的实验与研究。
