莽草酸衍生物的合成及糖苷酶抑制活性研究
2020-10-13田会萍董亚琳
张 璐,任 乐,田会萍,董亚琳
(西安交通大学第一附属医院 药学部,陕西 西安 710061)
0 引言
糖尿病(90%以上为2型糖尿病)的主要危害是高血糖导致多系统、多脏器并发症的发生.多脏器并发症是糖尿病引起死亡及残疾的主要原因[1].波动性高血糖比持续性高血糖更能促进糖尿病慢性血管并发症的发生与发展[2].餐后血糖波动和日内最大血糖波动是造成2型糖尿病患者血管内皮损伤的重要因素,其作用独立于持续血糖水平[3].α-葡萄糖苷酶抑制剂(α-glucosidase inhibitors,AGIs)是控制餐后血糖的对症治疗药物,由于目前临床上应用的AGIs药物种类少,化学合成难度大,制备困难,成本较高,而且使用过程中有腹胀、腹痛等副作用[4].因此,研究开发新型的AGIs药物已成为抗糖尿病药物研究的热点之一.
莽草酸(Shikimic acid,SA,结构见图1所示)是从木兰科植物八角茴香(Illicium verum Hook.f.)中提取的多羟基环己烯甲酸化合物.通过大量文献研究,本文发现天然化合物SA与DNJ、伏格列波糖等α-糖苷酶抑制剂具有相似的邻三醇结构.本研究将以SA为先导结构,重点对其1-位羧基进行结构修饰,合成莽草酸1-位衍生物并对其糖苷酶抑制作用进行研究,以期得到结构新颖的糖苷酶抑制,尤其是α-糖苷酶抑制剂,为新型抗糖尿病药物研究奠定基础.
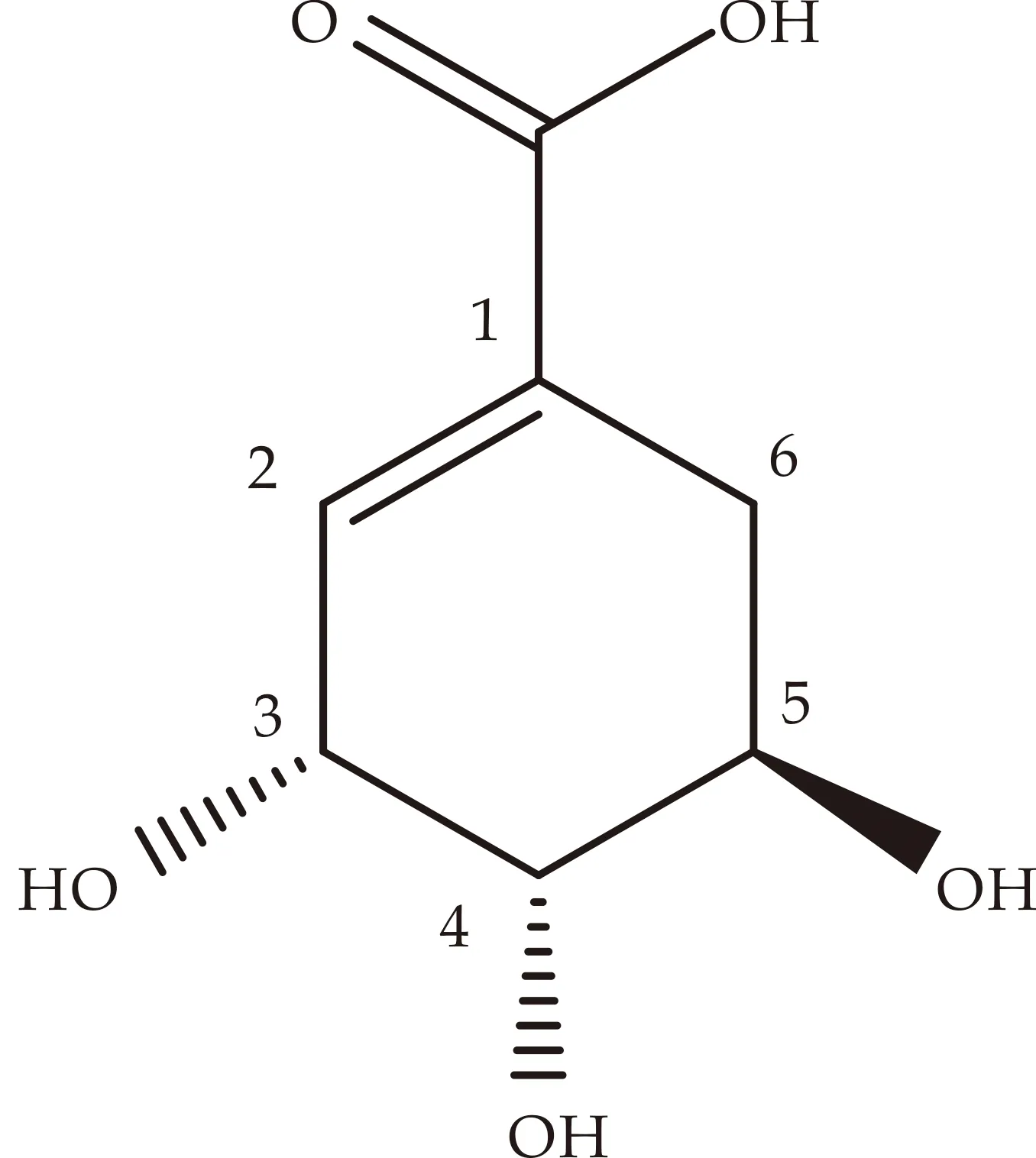
图1 SA的结构
1 材料与方法
1.1 实验材料与仪器
1.1.1 主要试剂
SA对照品(上海宝曼生物科技有限公司,批号:SH201707331,纯度:99.99%);合成用试剂O-苯并三氮唑-N,N,N′,N′-四甲基脲四氟硼酸(TBTU)、N,N-二异丙基乙胺(DIPEA)、氢化铝锂(LiAlH4)、对甲苯胺、对三氟甲基苯胺、对氟苯胺、2-氨基噻唑、2-氨基吡啶、对甲苯磺酸、苄氯、正丙胺、正丁胺、苯胺、苄胺、正丁醇等均为市售分析纯或化学纯,水为蒸馏水.α-葡萄糖苷酶(来源于酵母,Sigma公司);4-硝基苯-α-D-吡喃葡萄糖苷(α-PNPG)( Sigma公司);阿卡波糖(德国拜耳公司,批号:116082);磷酸盐缓冲溶液(pH7.2~7.6)(西安第四军医大学).
1.1.2 主要仪器
X-5型显微熔点测定仪(北京泰克仪器有限公司);AVANCE II 300型核磁共振(NMR)仪(德国Bruker公司);DF-101S集热式恒温加热磁力搅拌器(陕西太康生物科技有限公司);X-5显微mp测定仪(北京泰克仪器有限公司);101-2AB电热鼓风干燥箱(天津泰斯特仪器有限公司);SHB-Ⅲ循环水多用真空泵(陕西太康生物科技有限公司);R系列旋转蒸发仪(上海申生科技有限公司);紫外分光光度计(上海光谱仪器有限公司,型号:752).
1.2 实验方法
1.2.1 目标化合物的合成及其结构鉴定
以SA为原料,分别采用酯化、酰胺化和氢化还原等方法合成SA衍生物,并根据其理化性质和波谱(质谱、氢谱、碳谱等)对其结构进行鉴定.
(1)目标化合物T1~T3
合成方法参考已有文献[5,6]:以SA为起始原料,在对甲苯磺酸催化和加热回流条件下分别与甲醇、正丁醇进行酯化反应得目标化合物T1和T2(图2(a));以SA为起始原料,以浓硫酸为脱水剂,与过量丙酮室温下搅拌制得(3R,4S,5R)-3,4-O-异亚丙基莽草酸(中间体b);以乙腈为溶剂,在三乙胺催化下,中间体b与苄氯80 ℃下回流反应得到(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-1-环己烯-1-甲酸苄酯(中间体p);将中间体p溶于甲醇,加入10%盐酸,室温下搅拌,停止反应后用碳酸氢钠溶液将pH调至7,50 ℃下蒸干溶液得到目标化合物T3(图2(b)).

(a)目标化合物T1~T2
(2)目标化合物T4~T12
以SA为原料,与丙酮反应制得中间体b,然后以TBTU为缩合剂、二氯甲烷和N,N-二甲基甲酰胺为溶剂,分别与正丙胺、正丁胺、苯胺、苄胺、对甲苯胺、对氟苯胺、对三氟甲基苯胺及2-氨基噻唑反应后得到(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-正丙基-1-环己烯-1-甲酰胺(中间体c4)、(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-正丁基-1-环己烯-1-甲酰胺(中间体c5)、(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-苯基-1-环己烯-1-甲酰胺(中间体c6)、(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-苄基-1-环己烯-1-甲酰胺(中间体c7)、(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-对甲苯基-1-环己烯-1-甲酰胺(中间体c8)、(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-对氟苯基-1-环己烯-1-甲酰胺(中间体c9)、(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-对三氟甲基苯基-1-环己烯-1-甲酰胺(中间体c10)和(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-N-(2′-噻唑基)-1-环己烯-1-甲酰胺(中间体c11).
上述中间体与冰醋酸、水在90 ℃下加热回流反应,分别得到目标化合物化合物T4~T11(图3(a)).以SA为起始原料,与吡啶、醋酐在室温下搅拌反应得到三乙酰化莽草酸(中间体h),中间体h在冰浴冷却下滴加氯化亚砜,滴加完毕后加热回流,抽滤得到酰氯粗品;将粗品用二氯甲烷溶解,在冰浴下逐滴加入2-氨基吡啶、二氯甲烷、吡啶的混合溶液,搅拌反应,得到(3R,4S,5R)-N-(2′-吡啶基)-3,4,5-O-三乙酰基-1-环己烯-1-甲酰胺(中间体i);将中间体i溶于甲醇后,加入甲醇钠,室温下搅拌反应得到目标化合物T12(图3(b)).
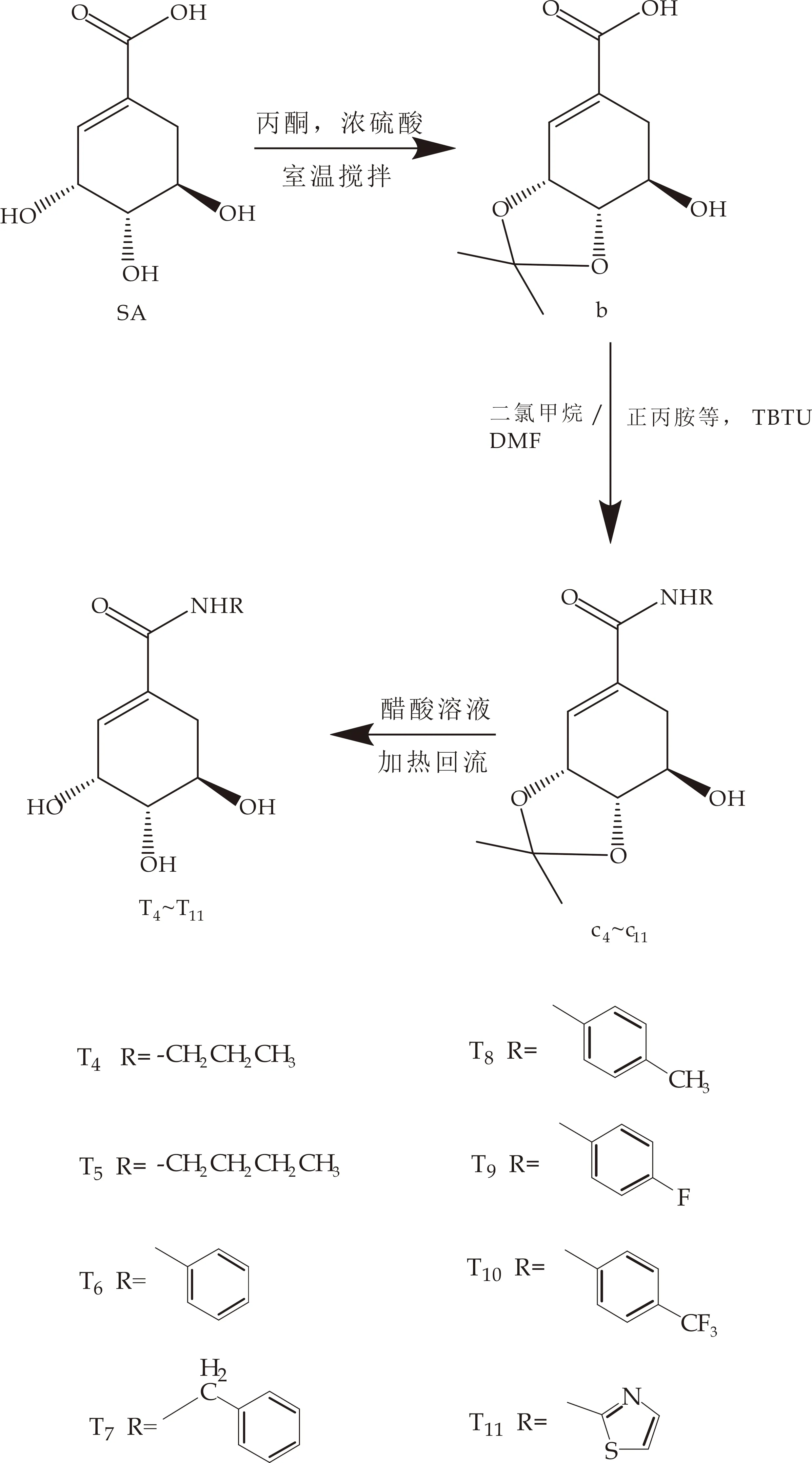
(a)目标化合物T4~T11
(3)目标化合物T13
将目标化合物T1溶于THF,冰浴冷却下缓慢加入LiAlH4,加完后缓慢升至室温,然后在氮气保护下加热回流,冷却至室温后得到目标化合物T13,见图4所示.
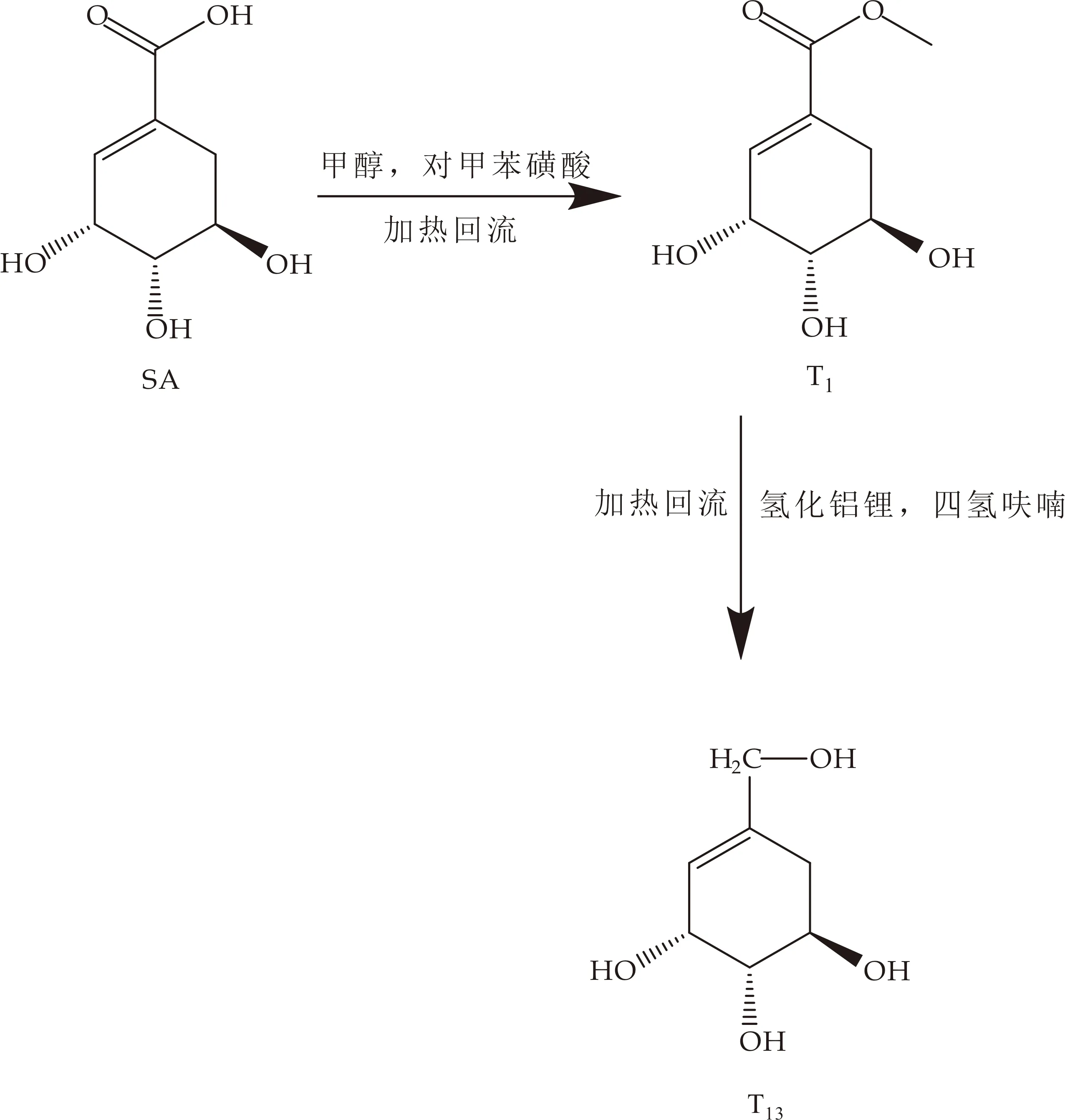
图4 目标化合物T13的合成路线
(4)目标化合物T14
将中间体b与适量二氯甲烷、N,N-二甲基甲酰胺混合后,在冰浴中慢慢加入TBTU、DIPEA,搅拌反应后加入苄胺,室温搅拌反应过夜,得到中间体c7;将中间体c7溶于THF,并且慢慢滴入到LiAlH4中,冰浴搅拌后升温至回流,反应过夜得到(3R,4S,5R)-N-(3,4-O-异亚丙基-5-羟基-1-环己烯甲基)苄胺(中间体e);将中间体e溶于醋酸溶液,加热回流降至室温,得到目标化合物T14,见图5所示.

图5 目标化合物T14的合成路线
(5)目标化合物T15
将目标化合物T1分散于丙酮后,逐滴加入浓硫酸反应过夜后,用碳酸氢钠溶液将pH调至7,得到(3R,4S,5R)-3,4-O-异亚丙基-5-羟基-1-环己烯-1-甲酸甲酯(中间体j);将中间体j将化合物与适量吡啶、醋酐混合,于室温下搅拌,用乙酸乙酯稀释,取有机层依次用10% HCl洗、水洗、无水硫酸钠干燥、得到目标化合物T15,见图6所示.
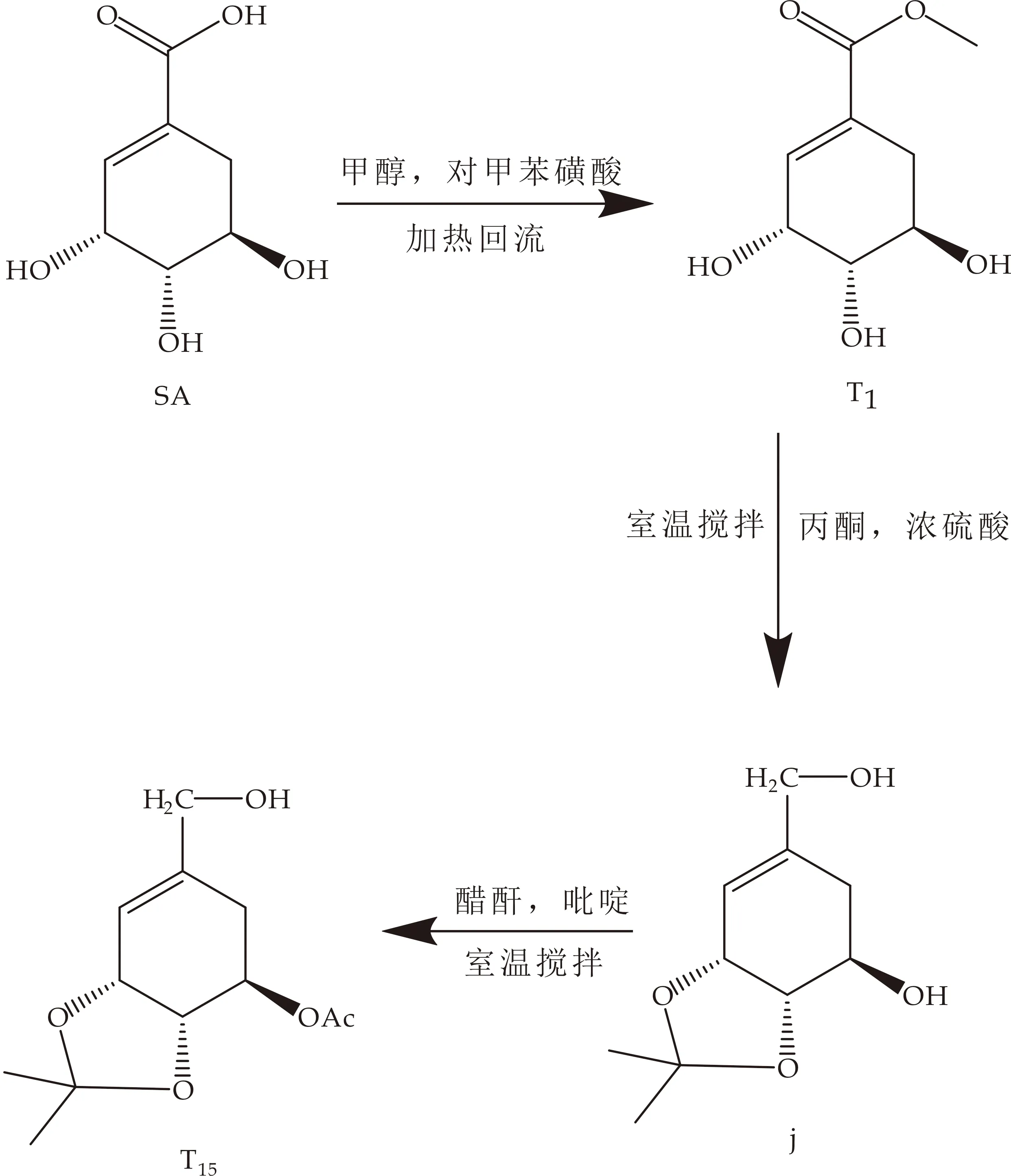
图6 目标化合物T15的合成路线
1.2.2 目标化合物对a-糖苷酶抑制活性的测定
4-硝基苯-α-D-吡喃葡萄糖苷(α-PNPG)在α-葡萄糖苷酶作用下,α-糖苷键发生水解产生对硝基苯酚,它在405 nm处吸光度最大,α-糖苷酶抑制剂通过对酶活性的抑制而对此水解反应产生影响,具体见图7所示.

图7 α-糖苷酶抑制的水解反应
反应体系为:PNPG溶液5.3 mmol/mL(20×10-3mL),α-葡萄糖苷酶溶液10 U/mL(10×10-3mL),加入不同剂量待测样品溶液(10 mg/mL)和磷酸盐缓冲液溶液,反应体系总体积为130×10-3mL.空白对照为磷酸盐缓冲液、PNPG溶液以及α-葡萄糖苷酶溶液的混合液,阳性对照为阿卡波糖.取酶液10×10-3mL加入缓冲液和不同体积待测样品溶液,混匀,37 ℃下孵化10 min,再加入α-PNPG 20×10-3mL,37 ℃保温10 min,加入终止剂Na2CO3(1 mol/L)50×10-3mL,混匀.取混合液110×10-3mL,溶于2 mL缓冲溶液,在405 nm处测定溶液吸光度,按式(1)计算百分抑制率(In%),并通过SPSS计算百分之五十抑制浓度IC50值[4,5].
百分抑制率(In%)=(A0-A1/A0)×100%
(1)
式(1)中:A0为未加酶抑制剂的吸光度;A1为加入酶抑制剂后的吸光度.
2 结果与讨论
2.1 目标化合物的合成
目标化合物T1:白色固体,熔点(mp):110 ℃~111 ℃,MS (ESI)m/z189.06 [M+H]+.1H-NMR(300 MHz,D2O)δ:2.19 (dd,1H,J=18.0,7.0 Hz,H-6ax),2.67 (dd,1H,J=18.0,6.9 Hz,H-6eq),3.68 (m,1H,H-5),3.73 (s,3H,CO2CH3),3.97 (m,1H,H-4),4.36 (m,1H,H-3),6.77 (d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,D2O)δ:31.2 (C-6),52.0 (C-2′),68.3 (C-4),68.5 (C-5),69.8 (C-3),130.1 (C-1),136.2 (C-2),167.2 (C-1′).根据上述波谱数据确定T1为(3R,4S,5R)-3,4,5-三羟基-1-环己烯-1-甲酸甲酯.
目标化合物T2:白色固体,mp:64 ℃~65 ℃,ESI-MS:m/z231.11[M+H]+.1H-NMR(300 Hz,DMSO-d6)δ:0.87~0.93 (t,3H,J=9.0 Hz,H-5′),1.31~1.40 (m,2H,H-4′),1.54~1.61 (m,2H,H-3′),2.03~2.09 (dd,1H,J=18.0,7.0 Hz,H-6ax),2.40~2.46 (dd,1H,J=18.0,7.1 Hz,H-6eq),3.56~3.58 (m,1H,H-5),3.84~3.86 (m,1H,H-4),4.06~4.10 (t,2H,J=6.4 Hz,H-2′),4.23 (m,1H,H-3),4.60~4.62(d,1H,J=7.2 Hz,5-OH),4.80~4.83 (m,2H,3-OH,4-OH),6.61(d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,CDCl3)δ:128.3 (C-1),137.7 (C-2),69.8 (C-3),68.3 (C-4),68.5 (C-5),31.2 (C-6),167.2 (C-1′),65.3 (C-2′),31.2 (C-3′),18.9 (C-4′),13.8 (C-5′).根据上述波谱数据确定T2为(3R,4S,5R)-3,4,5-三羟基-1-环己烯-1-甲酸正丁酯.
目标化合物T3:白色固体,mp:98 ℃~100 ℃,ESI-MS:m/z265.09[M+H]+.1H-NMR(300 Hz,DMSO-d6)δ:2.01~2.07 (dd,1H,J=18.0,7.1 Hz,H-6eq),2.50~2.56 (dd,1H,J=18.0,7.0 Hz,H-6eq),3.52 (m,1H,H-5),3.85 (m,1H,H-4),4.21(m,1H,H-3),4.32 (s,2H,-O-CH2-),4.52 (d,1H,J=7.3 Hz,5-OH),4.67~4.70 (d,1H,J=7.2 Hz,4-OH),4.78 (d,1H,J=7.2 Hz,3-OH),6.36 (d,1H,J=6.0 Hz,H-2),7.23~7.30 (m,5H,Ar-H);13C-NMR(100 MHz,CDCl3)δ:130.1 (C-1),136.2 (C-2),69.8 (C-3),68.3 (C-4),68.5 (C-5),31.2 (C-6),167.2 (C-1′),66.2 (C-2′),136.1 (C-3′),127.1 (C-4′,8′),128.9 (C-5′,7′),127.6 (C-6′).根据上述波谱数据确定T3为(3R,4S,5R)-3,4,5-三羟基-1-环己烯-1-甲酸苄酯.
目标化合物T4:白色固体,mp:90 ℃~92 ℃,ESI-MS:m/z216.11[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:0.80~0.84(3H,t,J=8.0 Hz,H-4′),1.39~1.45(2H,m,H-3′),1.95~2.00(1H,dd,J=16.0,7.0 Hz,H-6ax),2.46~2.50(1H,dd,J=16.0,7.0 Hz,H-6eq),3.01~3.07(2H,m,H-2′),3.48~3.50(1H,m,H-5),3.80(1H,m,H-4),4.17(1H,m,H-3),4.54~4.56(1H,d,J=7.0 Hz,5-OH),4.68~4.70(1H,d,J=7.3 Hz,4-OH),4.77~4.78(1H,d,J=7.2 Hz,3-OH),6.27(1H,d,J=6.3 Hz,H-2),7.81~7.84(1H,t,J=6.0 Hz,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9(C-1),136.5(C-2),69.4(C-3),67.9(C-4),68.1(C-5),30.0(C-6),168.2(C-1′),40.9(C-2′),23.1(C-3′),11.2(C-4′).根据上述波谱数据确定T4为(3R,4S,5R)-N-正丙基-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T5:白色固体,mp:103 ℃~104 ℃,ESI-MS:m/z230.13[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:0.84~0.89 (t,3H,J=7.5 Hz,H-5′),1.24~1.32 (m,2H,H-4′),1.35~1.43 (m,2H,H-3′),1.93~2.00 (dd,1H,J=18.0,7.0 Hz,H-6ax),2.46~2.48 (dd,1H,J=18.0,7.0 Hz,H-6eq),3.05~3.10 (t,2H,J=7.5 Hz,H-2′),3.46~3.50 (m,1H,H-5),3.79~3.82 (m,1H,H-4),4.16 (m,1H,H-3),4.64~4.69 (m,2H,4-OH,5-OH),6.26 (d,1H,J=6.0 Hz,H-2),7.76 (s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),168.2 (C-1′),40.3 (C-2′),32.2 (C-3′),19.8 (C-4′),13.8 (C-5′).根据上述波谱数据确定T5为(3R,4S,5R)-N-正丁基-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T6:白色固体,mp:136 ℃~138 ℃,ESI-MS:m/z250.10[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.06~2.13 (dd,1H,J=18.0,7.0 Hz,H-6ax),2.58~2.64 (dd,1H,J=18.0,7.2 Hz,H-6eq),3.56~3.58 (m,1H,H-5),3.87~3.80 (m,1H,H-4 ),4.27 (m,1H,H-3),4.59~4.60 (d,1H,J=7.0 Hz,5-OH),4.74~4.76 (d,1H,J=7.0 Hz,4-OH),4.81~4.83 (d,1H,J=7.0 Hz,3-OH),6.45 (d,1H,J=6.0 Hz,H-2),7.01~7.07 (d,1H,J=8.0 Hz,H-5′),7.26~7.32 (t,2H,J=8.1 Hz,H-4′,6′),7.65~7.69 (d,2H,J=8.0 Hz,H-3′,7′),9.67 (s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),163.1 (C-1′),137.6 (C-2′),121.6 (C-3′,7′),128.9 (C-4′,6′),128.0 (C-5′).根据上述波谱数据确定T6为(3R,4S,5R)-N-苯基-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T7:白色固体,mp:86 ℃~88 ℃,ESI-MS:m/z264.11[M+H]+.1H-NMR(300 Hz,DMSO-d6)δ:2.01~2.07 (dd,1H,J=18.0,7.0 Hz,H-6ax),2.50~2.56(dd,1H,J=18.0,7.0 Hz,H-6eq),3.53 (m,1H,H-5),3.84 (m,1H,H-4),4.20 (m,1H,H-3),4.31 (s,2H,2′-CH2),4.53 (d,1H,J=7.0 Hz,5-OH),4.68~4.70 (d,1H,J=7.0 Hz,4-OH),4.77 (s,1H,J=7.0 Hz,3-OH),6.37 (d,1H,J=6.0 Hz,H-2),7.23~7.30 (m,5H,Ar),8.40(s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),168.5 (C-1′),43.9 (C-2′),137.9 (C-3′),126.9 (C-4′,8′),128.5 (C-5′,7′),126.7(C-6′).根据上述波谱数据确定T7为(3R,4S,5R)-N-苄基-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T8:白色晶体,mp:179 ℃~180 ℃,ESI-MS:m/z264.11[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.05~2.10 (dd,1H,J=16.0,7.0 Hz,H-6ax),2.25 (s,3H,-CH3),2.58~2.62 (dd,1H,J=18.0,7.0 Hz,H-6eq),3.53~3.57 (m,1H,H-5),3.86~.88 (m,1H,H-4),4.26 (m,1H,H-3),4.65~4.66 (d,1H,J=7.0 Hz,5-OH),4.78~4.80 (d,1H,J=7.0 Hz,4-OH),4.85~4.86 (d,1H,J=7.0 Hz,3-OH),6.43 (d,1H,J=6.0Hz,H-2),7.08~7.10 (d,2H,J=8.0 Hz,H-3′,7′),7.54~7.56 (d,2H,J=8.0 Hz,H-4′,6′),9.63 (s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:39.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),163.1 (C-1′),134.6 (C-2′),121.5 (C-3′,7′),129.2 (C-4′,6′),136.8 (C-5′),21.3 (C-8′).根据上述波谱数据确定T8为(3R,4S,5R)-N-对甲苯基-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T9:白色固体,mp:132 ℃~133 ℃.ESI-MS:m/z268.09[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.06~2.11 (dd,1H,J=16.0,6.0 Hz,H-6ax),2.58~2.62 (dd,1H,J=16.0,6.0 Hz,H-6eq),3.56~3.59 (m,1H,H-5),3.88~3.90 (m,1H,H-4),4.27 (m,1H,H-3),4.67~4.68 (d,1H,J=7.0 Hz,5-OH),4.81~4.83 (d,1H,J=7.0 Hz,4-OH),4.87~4.88 (d,1H,J=7.0Hz,3-OH),6.45(d,1H,J=6.0 Hz,H-2),7.12~7.16 (d,2H,J=8.0 Hz,H-4′,6′),7.67~7.71 (d,2H,J=8.0 Hz,H-3′,7′),9.78 (s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),163.1 (C-1′),133.2 (C-2′),126.1 (C-3′,7′),115.7 (C-4′,6′),162.9 (C-5′).根据上述波谱数据确定T9为(3R,4S,5R)-N-对氟苯基-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T10:黄色固体,mp:68 ℃~70 ℃,ESI-MS:m/z318.09[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.09~2.13 (dd,1H,J=16.0,7.0 Hz,H-6ax),2.58~2.62 (dd,1H,J=16.0,7.0 Hz,H-6eq),3.59 (m,1H,H-5),3.89 (m,1H,H-4),4.29 (m,1H,H-3),4.70~4.72 (d,1H,J=7.0 Hz,5-OH),4.85~4.87 (d,1H,J=7.0 Hz,4-OH),4.90~4.91 (d,1H,J=7.0 Hz,3-OH),6.51(d,1H,J=6.0 Hz,H-2),7.56~7.58 (d,2H,J=8.0 Hz,H-4′,6′ ),7.91~7.93 (d,2H,J=8.0 Hz,H-3′,7′),10.1 (s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),163.1 (C-1′),140.9 (C-2′),121.9 (C-3′,7′),125.3 (C-4′,6′),132.1 (C-5′),124.1 (C-8′).根据上述波谱数据确定T10为(3R,4S,5R)-N-对三氟甲基苯基-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T11:白色固体,mp:218 ℃~220 ℃,ESI-MS:m/z257.05[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.09~2.14 (dd,1H,J=16.0,7.0Hz,H-6ax),2.60~2.64 (dd,1H,J=16.0,7.0 Hz,H-6eq),3.58~3.59 (m,1H,H-5),3.88~3.90 (m,1H,H-4),4.26 (m,1H,H-3),4.71~4.72 (d,1H,J=7.0 Hz,5-OH),4.84~4.86 (d,1H,J=7.0 Hz,4-OH),4.90~4.91 (d,1H,J=7.0 Hz,3-OH),6.70 (d,1H,J=6.0 Hz,H-2),7.21~7.22 (d,1H,J=7.5 Hz,H-4′),7.50~7.51 (d,1H,J=7.5 Hz,H-3′),12.1(s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),163.1 (C-1′),165.0 (C-2′),132.6 (C-3′),112.1 (C-4′).根据上述波谱数据确定T11为(3R,4S,5R)-N-(2′-噻唑基)-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T12:白色固体,mp:231 ℃~232 ℃,ESI-MS:m/z251.09[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.06~2.11 (dd,1H,J=16.0,7.0Hz,H-6ax),2.61~2.65(dd,1H,J=16.0,7.0 Hz,H-6eq),3.55~3.57 (m,1H,H-5),3.87~3.88 (m,1H,H-4),4.24 (m,1H,H-3),4.67(d,1H,J=7.0 Hz,5-OH),4.78(d,1H,J=7.0 Hz,4-OH),4.86 (d,1H,J=7.0 Hz,3-OH),6.56 (d,1H,J=6.0 Hz,H-2),7.10~7.13 (t,1H,J=6.0 Hz,H-6′),7.76~7.80 (dd,1H,J=8.0,5.0 Hz,H-4′),8.02~8.04 (dd,1H,J=8.0,6.0 Hz,H-5′),8.33~8.34 (d,1H,J=5.0Hz,H-3′),10.1(s,1H,1′-NH);13C-NMR(100 MHz,CDCl3)δ:139.9 (C-1),136.5 (C-2),69.4 (C-3),67.9 (C-4),68.1 (C-5),30.0 (C-6),163.1 (C-1′),149.9 (C-2′),148.1 (C-3′),117.9 (C-4′),138.3 (C-5′),114.2 (C-6′).根据上述波谱数据确定T12为(3R,4S,5R)-N-(2′-吡啶基)-3,4,5-三羟基-1-环己烯-1-甲酰胺.
目标化合物T13:白色固体,mp:32 ℃~33 ℃,ESI-MS:m/z161.07[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.04~2.08 (dd,1H,J=16.0,7.0 Hz,H-6ax),2.40~2.44(dd,1H,J=16.0,7.0 Hz,H-6eq),3.57~3.59(m,1H,H-5),3.67(s,2H,1′-CH2),3.85~3.87(m,1H,H-4),4.22(m,1H,H-3),4.67~4.69 (d,1H,J=7.0 Hz,5-OH),4.86~4.87 (d,1H,J=7.0 Hz,4-OH),4.88(d,1H,J=7.0 Hz,3-OH),6.62(d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,CDCl3)δ:137.1 (C-1),122.1 (C-2),68.0 (C-3),68.6 (C-4),67.6 (C-5),30.8 (C-6),67.3 (C-1′).根据上述波谱数据确定T13为(3R,4S,5R)-1-羟甲基-1-环己烯-3,4,5-三醇.
目标化合物T14:白色固体,mp:72 ℃~73 ℃,ESI-MS:m/z250.13[M+H]+.1H-NMR(400 Hz,DMSO-d6)δ:2.01~2.07 (dd,1H,J=18.0,7.0 Hz,H-6ax),2.35~2.37 (s,2H,1′-CH2),2.60~2.66 (dd,1H,J=18.0,7.0 Hz,H-6eq),3.67~3.69 (m,2H,H-5,4),3.74~3.76 (m,1H,H-3),4.20~4.32 (s,2H,2′-CH2),4.64~4.65 (d,1H,J=7.0 Hz,5-OH),5.42~5.46 (d,1H,J=7.0 Hz,4-OH),5.56~5.59 (d,1H,J=7.0 Hz,3-OH),6.61 (d,1H,J=6.0 Hz,H-2),7.21 (d,1H,J=7.8 Hz,H-6′),7.21~7.32 (m,4H,H-4′,5′,7′,8′);13C-NMR(100 MHz,CDCl3)δ:139.0 (C-1),121.9 (C-2),67.7 (C-3),68.6 (C-4),67.3 (C-5),32.2 (C-6),53.1 (C-1′),54.8 (C-2′),140.2 (C-3′),127.9 (C-4′,8′),128.5 (C-5′,7′),127.0 (C-6′).根据上述波谱数据确定T14为(3R,4S,5R)-N-(3,4 ,5-三羟基-1-环己烯甲基)苄胺.
目标化合物T15:白色晶体,mp:59 ℃~60 ℃,ESI-MS:m/z229.09[M+H]+.1H-NMR(300 Hz,DMSO-d6)δ:1.28~1.32 (s,6H,8-CH3,9-CH3),1.98 (s,3H,11-CH3),2.24~2.32 (dd,1H,J=18.0,7.0 Hz,H-6ax),2.59~2.66 (dd,1H,J=18.0,7.8 Hz,H-6eq),3.71 (s,3H,2-CH3),4.23~4.27 (m,1H,H-5),4.80 (m,1H,H-4),4.87~4.91 (m,1H,H-3),6.80 (d,1H,J=6.0 Hz,H-2);13C-NMR(100 MHz,CDCl3)δ:130.1 (C-1),133.8 (C-2),73.9 (C-3),76.0 (C-4),69.9 (C-5),28.3 (C-6),121.1 (C-7),26.6 (C-8,9),170.2 (C-10),21.0 (C-21),167.2 (C-1′),52.3 (C-2′).根据上述波谱数据确定T15为(3R,4S,5R)-3,4-O-异亚丙基-5-O-乙酰基-1-环己烯-1-甲酸甲酯.所得的目标化合物中,T4~T15未见文献报道,为首次通过上述合成方法获得的化合物[7].
2.2 目标化合物对α-糖苷酶抑制活性的结果分析
SA经1-位衍化后其α-糖苷酶抑制活性均较SA有所提高,所合成的莽草酸1-位衍生物对α-糖苷酶均表现出不同程度的抑制活性,但除了侧链为氨基结构的化合物T14外,其它化合物的IC50均大于阿卡波糖,化合物T14的IC50远小于阿卡波糖,具体见表1所示.
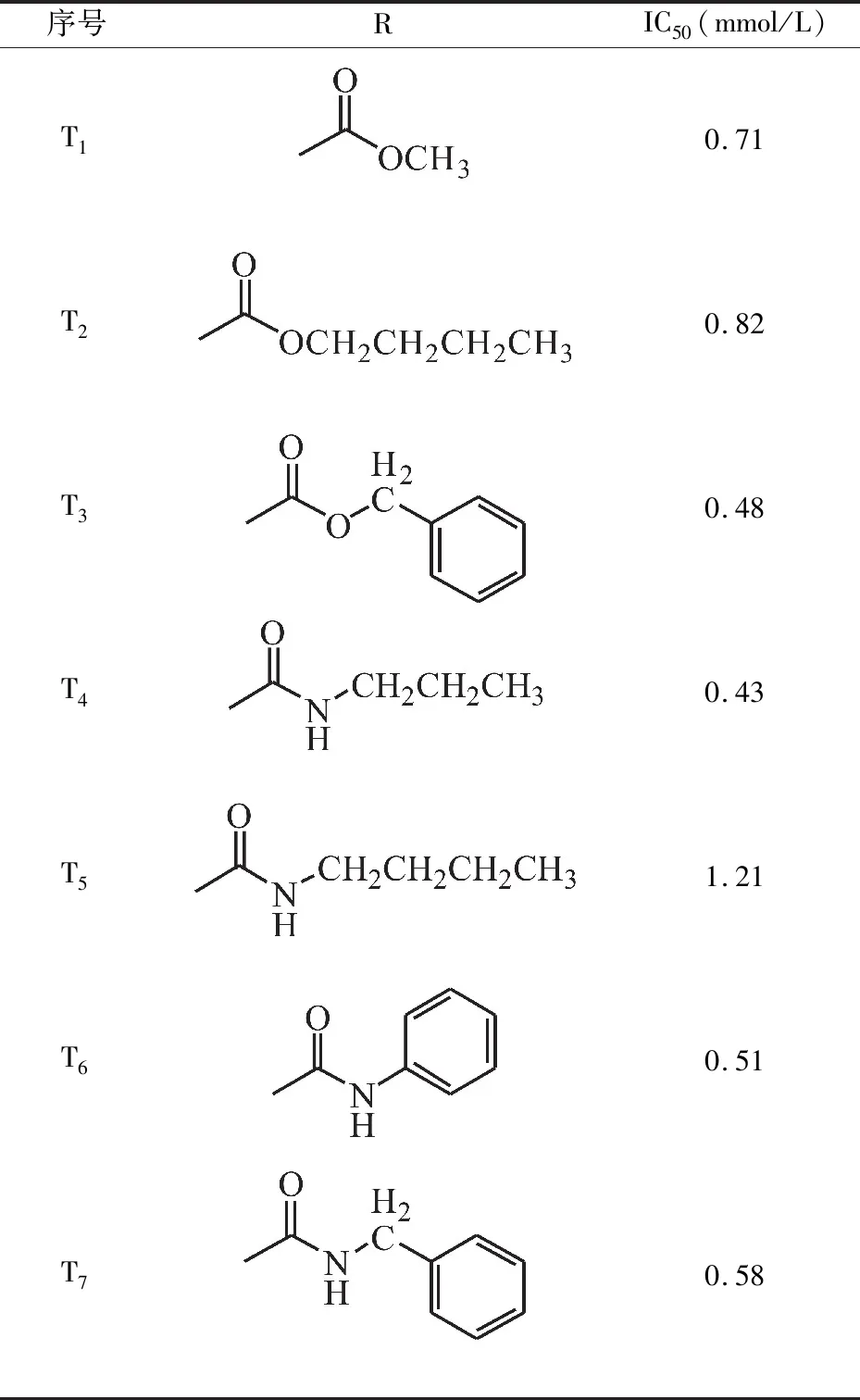
表1 莽草酸衍生物对α-糖苷酶的抑制活性

续表1
2.3 构效关系分析
2.3.1 1-位侧链的结构类型对其抑酶活性有明显影响
莽草酸1-位经不同结构修饰后,其α-糖苷酶抑制活性均有提高.如图8所示,经分析不同类型衍生物的酶抑制活性可知,具有相似取代结构的酯、酰胺以及胺(如化合物T3、T7及T14),酯和酰胺具有相近的酶抑制活性,但胺的活性则明显提高,而1-位羧基还原为醇(如化合物T13),活性略有提高,说明侧链的结构类型对其酶抑制活性有明显影响.
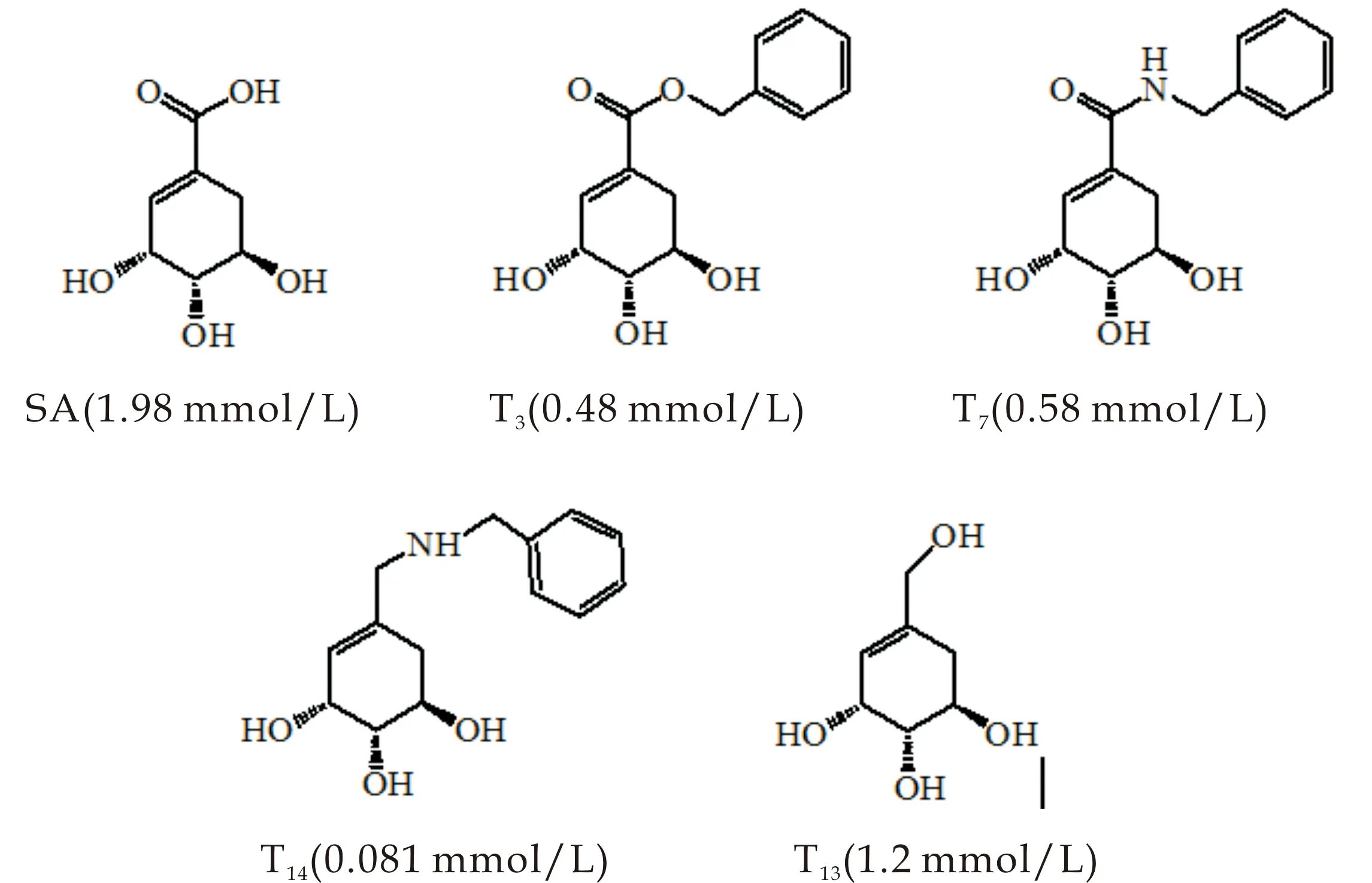
图8 代表化合物的结构及活性比较分析
2.3.2 1-位侧链引入酰胺结构有利于α-糖苷酶抑制活性
Docking分析显示,母核3位、4位上的羟基通过提供HBA和HBD与酶催化区域的Arg625和Asp627形成氢键,其结果如图9所示.当侧链为二级胺时,除了母核上多个羟基能形成多个氢键,侧链氨基提供HBD可以与Glu657(酸性氨基酸)形成氢键,而酰胺链并不能形成氢键,对抑酶活性较为利.比较化合物T13,T3,T7和T14可见,尽管酰胺链无氢键形成,但是连有取代结构时,活性较无取代的羟甲基要强,说明此区域取代结构的疏水等分子间作用对活性也有影响,侧链结构变化对活性有影响但并不明显.
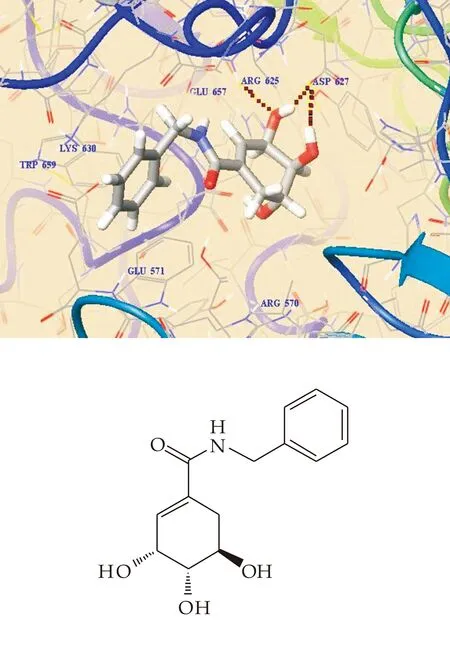
图9 T7与α-糖苷酶蛋白的分子对接图
2.3.3 1-位侧链引入二级胺结构有利于α-糖苷酶抑制活性
1-位侧链为二级胺结构时,除了有利于氢键的形成,同时碱性结构还可能通过增强分子与酶催化区域的亲和性,即分子更容易进入到酶分子的空腔中,这将有利于与酶分子间的相互作用,从而使酶抑制活性明显增强.由此可见,碱性侧链利于与酸性氨基酸残基形成氢键并提高其与酶的亲和作用,从而有利于α-糖苷酶抑制活性的产生.将SA的羧基还原成醇后(化合物T13),其结构与DNJ的结构十分相似,其α-糖苷酶抑制活性较SA略有提高,但比阿卡波糖弱,这也可能与DNJ分子中存在有利于与酶亲和作用的氨基结构有关.
3 结论
根据以上分析可见,SA及其衍生物母核上的多羟基结构是其与酶分子间形成氢键的主要结构区域.将SA母核上的羟基衍化后,如化合物T15,其α-糖苷酶抑制活性明显降低.Docking结果也显示,通过提供HBD及HBA与酶催化区域氨基酸残基形成氢键的羟基经衍化后,尽管醚键-O-只能提供HBA,与酶分子间的氢键作用明显降低,说明母核上的多羟基结垢对其α-糖苷酶抑制活性至关重要.
目前,对SA的研究只有抗炎、抗凝血作用的少量研究报道,以及作为抗流感药达菲的合成原料,未见在糖尿病方面的研究报道[8-13].本研究通过对莽草酸1-位衍生物的合成及其及α-糖苷酶抑酶活性研究,表明SA经过羧基衍化,尤其是1-位引入二级胺结构后,对α-糖苷酶具有明显的抑制作用,故通1-位引入更多的不同结构的二级胺,有可能筛选出活性更强的α-糖苷酶抑制剂,为抗糖尿病新药研究提供新型结构的候选化合物.因此,SA作为先导结构,在抗糖尿病药物及其它药物研究领域具有广阔的研究空间,值得进一步研究开发.
