产黄腐酸菌株的分离鉴定及培养基优化
2020-10-13贺小贤宋海涛雷化雨史懿乐
贺小贤,宋海涛,雷化雨,史懿乐,杨 婷,夏 飞,刘 欢
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
腐殖质是动植物残体(主要是植物残体)经过微生物的分解和转化,以及一系列地球物理和化学作用后积累起来的一种天然有机高分子聚合物,主要成分为腐植酸和不溶物胡敏素.腐植酸主要由黑腐酸、棕腐酸和黄腐酸组成.腐殖质广泛存在于自然界的土壤和水中,但低阶煤(泥炭、褐煤和风化煤)是腐植酸主要工业来源[1,2].黄腐酸(Fulvic acid,FA)是腐植酸中分子量最小(500~2 000 Da),既能溶于稀碱溶液,又能溶于酸和水的无定形混合物[3,4].黄腐酸分子中含有苯环、稠苯环及多类杂环,在环及支链中包含有酚羟基、羧基、甲氧基、酮基、磺酸基等官能团,具有较强的生理活性(阳离子交换能力、pH缓冲能力)和生物活性[5],在工业、农业、医药均有广泛的应用[6-11].
现阶段,黄腐酸的制备主要通过传统的提取法(如碱溶酸沉法、硫酸丙酮法、有机溶剂提取、强酸抽提等)和电渗析法,但大多数煤中的黄腐酸含量较低,这些方法存在黄腐酸提取效率低、反应时间长、环境污染等问题[12].腐殖酸虽然广泛存在于自然界中,但是目前我国95%以上的腐植酸资源属于黑腐酸,而棕腐酸和黄腐酸所占比例极少[13].目前,对于以黑腐酸为底物进行生物转化合成黄腐酸的研究甚少.
本文以黑腐酸为底物,黄腐酸含量为指标,筛选可利用黑腐酸生物合成黄腐酸的菌株,对黄腐酸含量最高的菌株综合采用生理生化和分子生物学手段进行鉴定,并通过单因素实验对底物浓度、培养基碳源和氮源种类及添加量进行优化,确定最佳培养基组成,为微生物转化黑腐酸制备黄腐酸提供一定的理论依据.
1 材料与方法
1.1 样品与培养基
1.1.1 样品
土壤样品采集地点为甘肃某腐殖酸生产企业褐煤堆积处(A)、陕西科技大学校园内枯叶堆积处(B)、浐灞生态湿地公园枯叶堆积处(C),采集土壤深度为3~15 cm共计9份(每处土壤取样3份)土壤样品.
1.1.2 培养基
(1)细菌分离培养基:牛肉膏3 g,蛋白胨10 g,琼脂15 g,氯化钠5 g,无菌水1 000 mL,121 ℃下,灭菌20分钟.
(2)霉菌分离培养基:硝酸钠2 g,磷酸氢二钾1 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,琼脂15 g,无菌水1 000 mL,121 ℃下,灭菌20分钟.
(3)筛选培养基:牛肉膏3 g,蛋白胨10 g,黑腐酸10 g,氯化钠5 g,无菌水1 000 mL,121 ℃下,灭菌20分钟(细菌);硝酸钠2 g,磷酸氢二钾1 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,黑腐酸10 g,无菌水1 000 mL,121 ℃下,灭菌20分钟(霉菌).
(4)基础培养基(LB培养基):蛋白胨10 g,酵母粉5 g,氯化钠5 g,无菌水1 000 mL,121 ℃下,灭菌20分钟.添加15 g琼脂制成固体平板.
1.2 主要试剂与设备
1.2.1 主要试剂
葡萄糖、蔗糖、淀粉、麦芽糖、甘露醇、酵母粉、蛋白胨、玉米粉、硝酸铵、硝酸钾、牛肉膏、尿素、氯化钠、黑腐酸、磷酸氢二钾、硫酸亚铁铵(均购自天津市天力化学试剂有限公司),浓硫酸、重铬酸钾、邻菲罗啉(购自天津市科密欧化学试剂有限公司),革兰氏染色液(购自北京奥博星生物技术有限公司),胶回收试剂盒、Taq DNA聚合酶预混液、DNA标准分子量Marker III(购自北京天根生化科技有限公司).
1.2.2 主要设备
YXQ-SG46-28A 电热压力蒸汽灭菌器(上海医疗器械公司)、LED-3 超净工作台(苏州净化设备有限公司)、SPX-150-Z 立式振荡培养箱(哈尔滨东联电子技术开发有限公司)、HW-200 电子显微镜(宁波舜宇仪器有限公司)、Pico-17 高速离心机(时代生物科技有限公司)、ZW3417032209 紫外可见光光度计(上海光谱仪器有限公司)、DK-98 数显电热恒温水浴锅(上海精密仪器有限公司)、MJ-250 生化培养箱(金坛市吉特实验仪器厂)、Phenom Pro台式扫描电镜(复纳科学(上海)仪器有限公司).
1.3 实验方法
1.3.1 菌株分离与筛选
(1)平板分离:在超净工作台内,称取20 g土壤样品加入到180 g无菌水中制备菌悬液,之后进行10倍梯度稀释,分别吸取200μL稀释至10-4、10-5和10-6的菌悬液,分别涂布于细菌固体培养基和霉菌固体培养基上,培养24~48 h后,观察菌落生长情况.
(2)摇瓶筛选:将平板分离获得的菌株接种于100 mL筛选培养基中,37 ℃,200 rpm培养48 h后,以黄腐酸含量为指标,筛选出高产黄腐酸的菌种.
1.3.2 菌株的鉴定
(1)菌落形态观察
将单菌落用LB培养基制成菌悬液后,用接种环蘸取菌悬液于LB培养基固体平板上进行划线后于37 ℃生化培养箱静置培养24 h,取出观察菌落形态.并挑取少量菌落进行革兰氏染色,于油镜下观察.
(2)菌株生理生化试验
根据《伯杰细菌鉴定手册》进行菌株生理生化鉴定[14].
(3)分子生物学鉴定
将分离纯化的单菌落接种至新鲜的LB液体培养基中过夜培养,取100μL菌液离心后收集菌体并用无菌水进行重悬,沸水浴中煮5 min,离心取上清作为模板,利用细菌16S rDNA引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)进行PCR扩增,反应体系总体积50μL:模板3μL、引物各3μL、2×Taq PCR Master Mix 25μL、ddH2O 16μL;PCR反应程序:95 ℃预变性4 min、94 ℃变性30 s、54 ℃退火45 s、72 ℃延伸 90 s,30个循环;72 ℃延伸 10 min;4 ℃ 保存.对扩增产物进行琼脂糖凝胶电泳分离,并对目的条带进行胶回收纯化,由北京擎科生物科技有限公司进行测序.利用MEGA7对测序后的16S rDNA序列进行比对分析,采用Neighbour-joining方法构建系统发育树,并进行Bootstrap分析[15].
1.3.3 扫描电镜观察
取1.5 mL培养至对数期的菌液8 000 rpm 离心3 min,弃掉上清加1 mL 戊二醛,置于4 ℃冰箱固定2~4 h.离心去上清,加磷酸缓冲液清洗,振荡10 min.离心去上清,分别用50%、70%、90%和100%(v/v)的乙醇脱水10 min,接着用乙酸异戊酯浸泡30 min或者过夜,离心去上清.使用烘箱烘干,喷金后进行扫描电镜观察.
1.3.4 生长曲线测定
将冻存于-80℃的菌株接种到5 mL LB液体培养基中复苏培养(37 ℃,200 rpm),培养12 h,用新鲜的LB液体培养基将菌悬液的浓度调整至OD600 nm=1.0.向三角瓶中加入LB培养基,接种1%(v/v)的菌悬液.将三角瓶置于37 ℃培养箱中培养,转速200 rpm,使用酶标仪每隔1 h 检测培养液在波长600 nm 处的吸光值.以培养时间(h)为横坐标,菌悬液在600 nm 处的吸光值为纵坐标,绘制生长曲线.
1.3.5 培养条件的优化
(1)黑腐酸添加量的优化
通过单次单因素实验,在基础培养基中分别添加10 g/L、15 g/L、20 g/L、25 g/L、30 g/L黑腐酸,将冻存于-80℃的菌株接种到5 mL LB液体培养基中复苏培养(37 ℃,200 rpm),培养12 h,用新鲜的LB液体培养基将菌悬液的浓度调整至OD600 nm=1.0.1%(v/v)接种量,37 ℃、转速200 rpm培养24 h,检测黄腐酸含量,确定底物最适添加量.
(2)培养基碳源的优化
通过单次单因素实验,在基础培养基中分别添加5 g/L淀粉、酵母粉、蔗糖、甘露醇、葡萄糖、麦芽糖等不同碳源取代培养基中的酵母粉,1%(v/v)接种量,37 ℃、转速200 rpm培养24 h,检测黄腐酸含量,确定最佳碳源.
(3)培养基氮源的优化
在确定最佳碳源后,分别添加10 g/L牛肉膏、玉米粉、尿素、蛋白胨、NH4NO3、KNO3等6种不同类型的氮源,1%(v/v)接种量,37 ℃、转速200 rpm培养24 h,检测黄腐酸含量,确定最佳氮源.
(4)培养基碳源和氮源最佳添加量的确定
在确定最佳碳源和氮源后,对其添加量进行优化.首先固定培养基中氮源添加量为10 g/L,碳源添加量分别设置为5 g/L、10 g/L、15 g/L、20 g/L、25 g/L,1%(v/v)接种量,37 ℃、转速200 rpm培养24 h,检测黄腐酸含量,确定碳源的最优添加量.之后在碳源最优添加量的基础上,分别添加不同浓度(1 g/L、5 g/L、10 g/L、15 g/L、20 g/L)氮源,1%(v/v)接种量,37℃、转速200 rpm培养24 h,检测黄腐酸含量,确定氮源的最优添加量.
1.3.6 黄腐酸测定方法
黄腐酸测定用重铬酸钾容量法[16].
1.3.7 数据处理
所有实验重复至少3次,每次实验设置3个平行;采用SPSS 23.0软件进行单因素方差分析(One-way ANOVA)与邓肯法(Duncan′s)差异分析,显著性水平为5%;使用GraphPad Prism 7.00软件作图.
2 结果与讨论
2.1 产黄腐酸菌株的分离与筛选
本研究通过平板分离和摇瓶筛选从三处土壤样本中分离筛选出了18株可利用黑腐酸生产黄腐酸的单一菌株,其中黄腐酸含量达到5%以上的菌株共10株,其中土壤样品A中分筛了4个菌株,土壤样品B和土壤样品C分别筛到3个菌株.最终选取黄腐酸含量最高的菌株A1进行后续鉴定,其黄腐酸含量达到了15.88%(如图1所示).

图1 不同菌株黄腐酸的产量(不同小写字母表示差异显著(p<0.05),相同小写字母表示差异不显著(p>0.05))
2.2 产黄腐酸菌株的鉴定
2.2.1 菌种A1的形态学分析
对A1菌株在LB固体平板上进行划线,置于37 ℃生化培养箱中培养24 h.A1菌株在LB固体培养基上形成圆形、乳白色菌落,表面凸起、较湿润黏稠、易挑起,如图2(a)所示.A1菌株经革兰氏染色后呈蓝紫色,即为革兰阳性细菌,如图2(b)所示(放大100倍).通过扫描电镜进行菌体形态观察,放大5 900倍时可看到菌体呈短杆状、两端钝圆,如图2(c)所示.

(a)菌落形态 (b)革兰氏染色
2.2.2 菌种A1的生理生化特征
进一步地,对菌株A1的生理生化特性进行分析,结果如表1所示.A1菌株可利用D-葡萄糖、甘露醇和蔗糖,不能利用乳糖和果糖;对淀粉、明胶和酪素均具有水解活性;生理生化检测结果与《伯杰氏细菌鉴定手册》(第八版)中的地衣芽孢杆菌(Bacilluslicheniformis)的菌落形态和生理生化特性比较接近,初步确定菌株A1为地衣芽孢杆菌.

表1 菌株A1生理生化特性分析
2.2.3 菌种A1的16S rDNA克隆及序列比对分析
以A1菌株基因组为模板,利用16S rRNA引物27F和1 492R进行PCR扩增,经琼脂糖凝胶电泳分离纯化得到大小为1 400 bp左右的DNA片段,随后进行TA克隆并对其进行测序.经测序,菌株A1的16S rDNA核苷酸序列大小为1 466 bp,结果如图3(a)所示.系统发育树结果显示菌株A1与Bacillus属中的地衣芽孢杆菌聚于一簇(如图3(b)所示),其16S rDNA核苷酸序列与BacilluslicheniformisDSM13(序列号为NR118996.1)、B.licheniformisBCRC11702 (序列号为NR 116023.1)菌株的16S rDNA序列最大相似度为99.93%、与B.subtilisDSM10(序列号为NR 027552.1)、B.nakamuraiNRRLB-41091(序列号为NR 151897.1)、B.amyloliquefaciensBCRC11601(序列号为NR 116022.1)的16S rDNA核苷酸序列相似性较高(98.10%)(如表2所示).

表2 菌株A1 16S rDNA序列比对分析

(a)菌株A1的16S rDNA片段扩增
综合A1菌株的生理生化特征、形态学特征及16S rDNA核苷酸序列同源性分析结果,将菌株A1鉴定为地衣芽孢杆菌(B.licheniformis).微生物对腐殖质的降解主要是通过酶作用来实现,研究表明木质素酶、漆酶、水解酶、纤维素酶等都具有降解腐殖质的能力[17].而地衣芽孢杆菌可合成纤维素酶、漆酶、葡聚糖酶以及多种水解酶,后续研究可进一步对分离到的A1菌株的产酶特性和腐殖酸降解机制进行深入研究[18,19].目前,文献报道的可生物转化腐殖酸制备黄腐酸的菌株还有白腐真菌、黄绿青霉和黄杆菌等[17,20,21].
2.3 地衣芽孢杆菌A1生长特性
由图4可知,菌株A1在LB培养基中的延滞期较短,培养2 h后即开始进入对数生长期,培养7 h后进入稳定期,最大菌体浓度OD600 nm值达到0.623.

图4 菌株A1生长曲线
2.4 黑腐酸添加量对黄腐酸含量的影响
首先检测了底物添加量对菌株A1黄腐酸含量的影响,结果如图5所示.可见,随着黑腐酸浓度的增加,黄腐酸含量逐渐提高;黑腐酸添加量为20 g/L时所得黄腐酸含量最高,达到16.02%.当黑腐酸添加量继续提高时,黄腐酸的含量则逐渐降低.可能因为在黑腐酸浓度较低时,底物供应量不足,导致黑腐酸的转化率较低,黄腐酸含量低下;当底物浓度过高时,一方面细菌与黑腐酸作用的有效面积减少,使降解反应受到抑制,另一方面培养基的酸度降低,抑制细菌的生长[22,23].因此选取20 g/L黑腐酸添加量进行后续的发酵条件优化.

图5 不同黑腐酸添加量对黄腐酸含量的影响(不同小写字母表示差异显著(p<0.05))
2.5 不同碳源对黄腐酸含量的影响
选取淀粉、酵母粉、蔗糖、甘露醇、麦芽糖、葡萄糖等6种不同类型的碳源等量替代基础培养基中的酵母粉,检测不同碳源对地衣芽孢杆菌A1转化黑腐酸生产黄腐酸的影响,结果如图6所示.
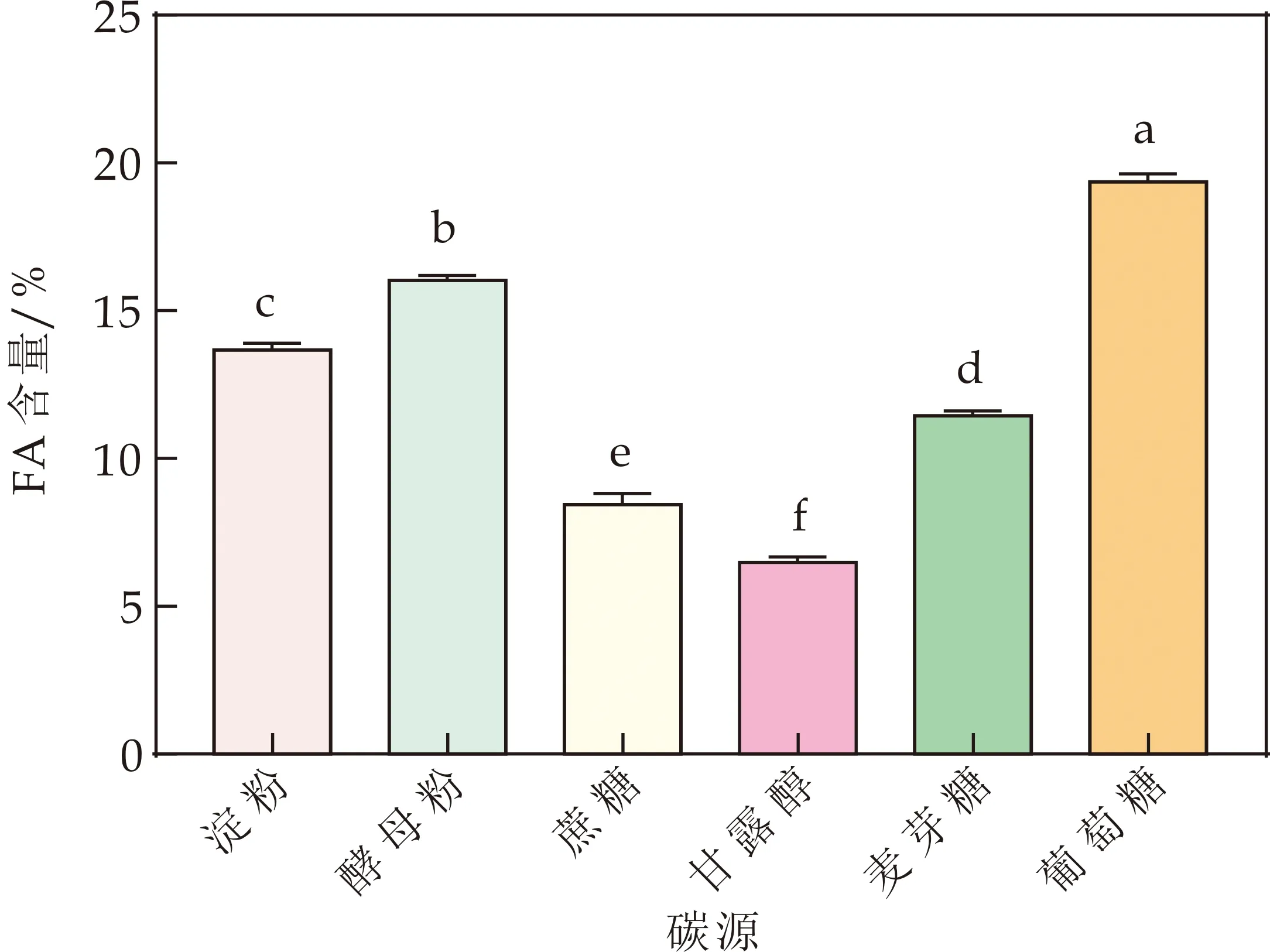
图6 不同碳源对黄腐酸含量的影响(不同小写字母表示差异显著(p<0.05))
由图6可知,地衣芽孢杆菌在以蔗糖和甘露醇为碳源时,黄腐酸含量较低,以葡萄糖为碳源时,黄腐酸含量最高,达到19.41%,其次为酵母粉、淀粉、麦芽糖.因此,选取葡萄糖糖为碳源进行后续的条件优化.葡萄糖作为一种可快速利用的单糖,相比其他碳源更易被细菌代谢利用,促进菌体的快速增殖[24,25].但是,对于不同地衣芽孢杆菌菌株或同一菌株进行不同产物合成时,碳源的种类对其产物合成的影响也是不尽相同的[26].
2.6 不同氮源对黄腐酸含量的影响
在最佳碳源的基础上,选取牛肉膏、玉米粉、尿素、蛋白胨、NH4NO3、KNO3等6种不同类型的氮源等量替代基础培养基中的氮源,检测不同氮源对地衣芽孢杆菌A1转化黑腐酸生产黄腐酸的影响,结果如图7所示.由图7可知,地衣芽孢杆菌在以蛋白胨为氮源时,黄腐酸含量最高,达到19.51%,其次为玉米粉、牛肉膏、尿素.在以硝酸铵和硝酸钾为氮源时其黄腐酸含量很低.可见,有机氮源比无机氮源更有利于地衣芽孢杆菌利用黑腐酸,可能是由于有机氮源含有丰富的氨基酸和多肽等物质,能更好的促进细菌的生长[27].因此,选取蛋白胨为最佳氮源进行后续的条件优化.

图7 不同氮源对黄腐酸含量的影响(不同小写字母表示差异显著(p<0.05))
2.7 葡萄糖和蛋白胨添加量对黄腐酸生成的影响
在确定最佳碳源和氮源的基础上,选取不同浓度的葡萄糖和蛋白胨添加至培养基中,检测葡萄糖和蛋白胨浓度对地衣芽孢杆菌A1转化黑腐酸生产黄腐酸的影响,结果如图8所示.由图8可知,在固定蛋白胨添加量时,黄腐酸含量随着葡萄糖添加量增高呈现先升高后降低的趋势,添加量为15 g/L时黄腐酸含量为21.41%,如图8(a)所示.可见,葡萄糖浓度在较低或较高时,黄腐酸含量都有所降低,可能因为在较低浓度时,葡萄糖供应不足以保障微生物的碳源和能量的需求;而在葡萄糖含量较高时,会引起培养液渗透压的增加而影响细胞的正常生长和代谢.因此,选取15 g/L作为葡萄糖的最佳添加量.
进一步地,对蛋白胨的添加量进行优化,结果如图8(b)所示.黄腐酸含量随着蛋白胨添加量增高亦呈现先升后降的趋势,在添加量为10 g/L时达到最大值23.02%.较低的氮源不能满足菌体生长和代谢的需求,影响产物的合成量;而较高的氮源供应则会导致碳氮比的降低,不利于产物的积累.因此,选择10 g/L作为蛋白胨的最佳添加量.

(a)葡萄糖添加量对黄腐酸含量的影响

(b)蛋白胨添加量对黄腐酸含量的影响图8 不同浓度葡萄糖和蛋白胨对黄腐酸含量的影响(不同小写字母表示差异显著(p<0.05))
3 结论
(1)从土壤中分离筛选出了18株可生物转化黑腐酸产黄腐酸的菌株,并对其中黄腐酸含量最高的菌株A1进行生理生化和分子生物学分析,确定A1菌株为地衣芽孢杆菌.
(2)通过单因素实验确定了黑腐酸最佳添加浓度为20 g/L.
(3)通过不同碳源和氮源对黄腐酸含量的影响,确定了地衣芽孢杆菌A1利用黑腐酸合成黄腐酸的最佳碳源为葡萄糖,最佳氮源为蛋白胨;葡萄糖和蛋白胨的添加量分别为15 g/L和10 g/L时,温度37 ℃,转速200 rpm,接种量1%时黄腐酸含量从优化前的15.88%提高到23.02%.
