硼替佐米调节NF-κB 途径对IL-1β 诱导的ATDC5细胞炎症性损伤的影响研究
2020-10-12莫湘涛张依山李勇军肖永杰
莫湘涛,张依山,李勇军,肖永杰
(1.河南省洛阳正骨医院/ 河南省骨科医院髋部损伤科, 郑州 450046;2.河南省洛阳正骨医院/河南省骨科医院风湿科, 郑州 450046;3.河南省洛阳正骨医院/ 河南省骨科医院检验科, 郑州 450046;4.中国人民解放军联勤保障部队第九八八医院骨关节科, 郑州 475300)
骨关节炎属老年人常见疾病,会出现局部滑膜炎症反应,诱发关节处疼痛,影响患者生活质量[1]。缓解关节炎、减少疼痛对于疾病意义重大。 硼替佐米(bortezomib,Bor) 在细胞增殖、凋亡,减少炎症产生等免疫调节通路中发挥重要作用[2],可调节结肠炎症反应预防小鼠硫酸葡聚糖钠引起的溃疡性结肠炎从而缓解疾病[3]。 类风湿关节炎实验中,抑制核因子κB( nuclear factor κB,NF-κB) 可减缓疼痛、炎症和骨骼损伤[4]。 Bor 可能通过抑制NF-κB 途径缓解骨关节炎从而影响疾病。 本研究通过白介素-1β(interleukin-1β,IL-1β) 诱导ATDC5 细胞造成炎症损伤,探究Bor 对ATDC5 炎症损伤的影响,并初步探讨其机制。
1 材料和方法
1.1 实验细胞
未分化的小鼠软骨细胞株ATDC5 购自美国Sigma 公司,货号:99072806。
1.2 主要试剂与仪器
Bor 购自西安杨森制药公司, 批准文号:H20170321;人重组IL-1β 购自美国PeproTech 公司,货号:AF-211-11B-2;CCK-8 试剂盒、Annexin VFITC 细胞凋亡检测试剂盒均购自碧云天生物科技有限公司,货号分别为:C0037、C1062S;IL-1β ELISA试剂盒、一抗p-NF-κB、NF-κB(兔抗鼠)、B 细胞淋巴瘤/ 白血病-2 原癌基因(B cell lymphoma / lewkmia- 2, BcL-2) ( 兔抗鼠)、 BcL-2 相关X 蛋白( BcL-2 associated X protein, BAX) ( 兔抗鼠) 均购自美国abcam 公 司, 货 号 分 别 为: ab9722、 ab16502、ab220803、ab32124、ab32503。 CO2培养箱购自山东博科科学仪器有限公司,型号:GSPX-50;酶标仪购自赛默飞世尔科技有限公司,型号:Varioskan LUX;流式细胞仪购自美国贝克曼库尔特公司, 型号:DxFLEX;蛋白凝胶成像仪购自美国BIO-RAD 公司,型号:GelDoc 2000。
1.3 实验方法
1.3.1 ATDC5 细胞的处理
ATDC5 细胞培养:实验前DMEM/ F12 培养基添加10%胎牛血清、100 万U/ mL 青链霉素混匀制成DMEM/ F12 完全培养基置于4℃冰箱中待用。ATDC5 细胞加入DMEM/ F12 完全培养基于37℃CO2培养箱中培养,待细胞密度培养至70% ~80%时进行下一步实验。 ATDC5 细胞处理:DMEM/ F12完全培养基稀释Bor 制成0.25 mmol/ L Bor 待用;DMEM/ F12 完全培养基溶解IL-1β 制成100 mg / mL IL-1β 待用。 分别用0、5、15、25、35、45、55 nmol/ L Bor 处理ATDC5 细胞48 h,筛选无细胞毒性Bor 浓度范 围, 分 别 用0、 1.0、 5.0、 12.5、 25.0 nmol/ L Bor[5]DMEM/ F12 完全培养基培养细胞1 h,添加10 μg / mL IL-1β[6]置于96 孔板和6 孔板共培养;空白细胞(即0 nmol/ L Bor)为对照组。
1.3.2 CCK-8 检测细胞增殖情况
96 孔板中细胞Bor 和IL-1β 共培养48 h,添加CCK-8 试剂,培养箱中继续培养2 h,酶标仪检测450 nm 处各孔细胞光密度(optic density,OD),设置6 个 重 复。 细 胞 存 活 率= OD450实验组/ OD450对照组×100%。
1.3.3 流式细胞术检测细胞凋亡情况
6 孔板中细胞培养48 h,每孔收集1×106个细胞,按照Annexin V-FITC 试剂盒说明书,添加195 μL Annexin V-FITC 结合液、5 μL Annexin V-FITC 后轻轻混匀,然后加入10 μL 碘化丙啶染色液轻轻混匀。 流式细胞仪1 h 内检测细胞凋亡率。
1.3.4 ELISA 检测上清液中炎症因子IL-1β 水平
6 孔板中细胞培养48 h 后收集细胞培养液,3000 r/ min 离心5 min 收集上清,分装置于4℃冰箱待用。 严格按照IL-1β ELISA 试剂盒说明书操作,检测上清液中IL-1β 水平。
1.3.5 蛋白免疫印迹检测细胞中NF-κB、 BAX、BcL-2 蛋白水平
6 孔板中细胞培养48 h 后,吸去培养液,每孔添加200 μL TRIzol,冰上裂解20 min,收集细胞混合液,13400 r/ min 离心15 min 收集上清即为细胞总蛋白,凝胶电泳分离蛋白质后转膜;5%脱脂奶粉室温封闭2 h;对应加入一抗NF-κB p65、BAX、BcL-2、GADPH,4℃孵育过夜;加入对应的二抗,室温孵育1 h;DAB 显色试剂盒避光显色;蛋白凝胶成像仪拍照和定量分析。
1.4 统计学方法
采用统计学软件SPSS 24.0 进行数据分析,计量资料以平均数±标准差()描述,多组比较用单因素方差分析,进一步两两比较采用SNK-q法。当P<0.05 时,差异有统计学意义。
2 结果
2.1 细胞毒性实验
CCK8 结果显示,0、5、15、25 Bor 组差异无统计学意义(P>0.05)。 与0 nmol/ L Bor 组相比,35、45、55 Bor 组细胞存活率降低(P<0.05)。 详见图1。
2.2 Bor 对细胞增殖的影响
与0 nmol/ L Bor 组相比,IL-1β 组细胞存活率降低(P< 0.05)。 与IL-1β 组相比, 1.0、 5.0、 12.5、25.0 nmol/ L Bor + IL-1β 组细胞存活率升高(P<0.05)。 见图2。
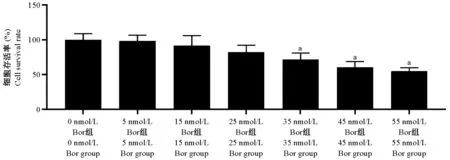
图1 各浓度Bor 处理细胞存活率情况Note.Compared with 0 nmol/ L Bor group, aP<0.05.Figure 1 Cell survival rate of Bor in different concentrations
2.3 Bor 对细胞凋亡的影响
与0 nmol/ L Bor 组相比,IL-1β 组细胞凋亡率升高(P< 0.05)。 与IL-1β 组相比, 1.0、 5.0、 12.5、25.0 nmol/ L Bor + IL-1β 组细胞凋亡率降低(P<0.05)。 见图3A、3B。
2.4 Bor 对上清液中IL-1β 的影响
与0 nmol/ L Bor 组相比,IL-1β 组上清液中IL-1β 水平升高(P< 0.05)。 与IL-1β 组相比,12.5、25.0 nmol/ L Bor+IL-1β 组上清液中IL-1β 水平降低(P<0.05)。 见图4。
2.5 Bor 对细胞中NF-κB 蛋白的影响
与0 nmol/ L Bor 组相比,IL-1β 组细胞中p-NFκB / NF-κB 水平升高(P<0.05)。 与IL-1β 组相比,1.0、5.0、12.5、25.0 nmol/ L Bor+IL-1β 组细胞中p-NF-κB / NF-κB 蛋 白 水 平 降 低(P< 0.05 )。 见 图5A、5B。
2.6 Bor 对细胞中BcL-2、BAX 蛋白的影响
与0 nmol/ L Bor 组相比,IL-1β 组细胞中BcL-2蛋白水平降低(P<0.05);BAX 蛋白水平升高(P<0.05)。 与IL-1β 组相比,12.5、25.0 nmol/ L Bor +IL-1β 组细胞中BcL-2 蛋白水平升高(P< 0.05);25.0 nmol/ L Bor+IL-1β 组细胞中BAX 蛋白水平降低(P<0.05)。 见图6A、6B。
3 讨论
骨关节炎患者会出现关节软骨进行性退变、滑膜炎症、疼痛,受多因素影响,患者软骨组织处细胞增殖、凋亡异常,影响患者健康[7]。 目前治疗骨关节炎主要以改善关节功能、减轻炎症从而缓解疼痛为主。 其中Bor 作为目前唯一应用于临床的蛋白酶体抑制剂,在多发性骨髓瘤中可影响肿瘤凋亡从而影响肿瘤生长[8];在炎症性肠病小鼠中抑制NF-κB活性、抑制炎症因子TNF-α 水平从而起到治疗肠炎性肠病目的[9]。 Bor 能够改善骨损伤从而治疗早期骨关节炎[10]。

图2 Bor 联合IL-1β 处理细胞48 h 各组细胞存活率比较(± s, n= 6)Note.Compared with 0 nmol/ L Bor group, aP< 0.05.Compared with IL-1β group, bP<0.05.Figure 2 Comparison of cell survival rate in 48 h groups treated with bor and IL-1β

图3 Bor 联合IL-1β 处理各组细胞凋亡率比较(± s, n= 6)Note.A, Flow cytogram.B, Corresponding histogram.Compared with 0 nmol/ L Bor group, aP < 0.05.Compared with IL-1β group, bP < 0.05.Figure 3 Comparison of cell apoptosis rate of Bor and IL-1β treatment groups
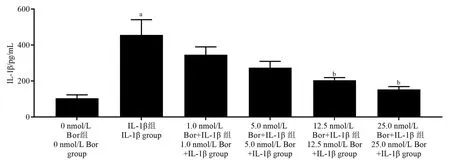
图4 Bor 联合IL-1β 处理各组细胞上清液中IL-1β 水平比较(± s, n= 6)Note.Compared with 0 nmol/ L Bor group, aP < 0.05.Compared with IL-1β group, bP < 0.05.Figure 4 Comparison of IL-1 β levels in supernatant of cells treated with Bor and IL-1β
IL-1β 属典型的致炎因子,可促进炎症反应,在炎症疾病中高表达可诱发炎症机制,可反映细胞损伤炎症程度[11]。 正常情况下关节滑液中存在微量IL-1β;骨关节炎软骨组织、滑液中能检测到较高含量IL-1β,IL-1β 参与炎症反应和免疫调节[12],另外研究发现IL-1β 可促进新生大鼠骨关节炎中软骨细胞凋亡[13]。 BcL-2 是一种参与细胞凋亡基因,细胞正常状态下可阻止线粒体中细胞色素C 释放入胞浆之中,从而阻止细胞凋亡[14];BAX 是BcL-2 家族中研究最广泛的促凋亡基因,与BcL-2 作用相反,可促进线粒体中细胞色素C 的释放从而促进凋亡,而细胞色素C 从线粒体释放到胞浆是细胞凋亡中关键一步[15]。 在骨关节炎患者中BcL-2 水平降低、BAX 水平升高从而促进细胞凋亡[16]。 本研究发现,IL-1β 诱导ATDC5 细胞后,与0 nmol/ L Bor 组相比,IL-1β 组细胞存活率、细胞中BcL-2 蛋白水平降低,凋亡率、细胞中BAX 蛋白水平升高。 提示IL-1β可抑制ATDC5 细胞存活、促进其凋亡,诱导细胞炎症损伤,造成关节炎。 与IL-1β 组相比,(1.0、5.0、12.5、25.0)nmol/ L Bor+IL-1β 组细胞存活率、细胞中BcL-2 蛋白水平升高,凋亡率、细胞中BcL-2 蛋白水平降低。 提示Bor 可抑制ATDC5 细胞凋亡,促进BcL-2 蛋白水平表达、抑制BAX 蛋白水平表达,增加细胞存活率,且随着剂量增加,该作用逐渐增强,可能Bor 在细胞炎症中发挥抗凋亡作用从而缓解疾病。
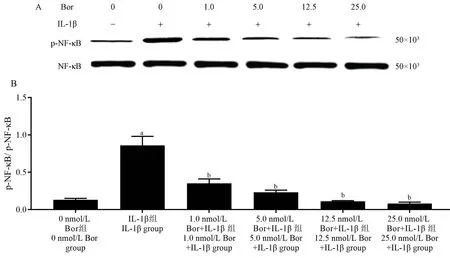
图5 Bor 联合IL-1β 处理各组细胞中NF-κB 蛋白水平比较(± s, n= 6)Note.A, Protein band diagram.B, Corresponding histogram.Compared with 0 nmol/ L Bor group, aP < 0.05.Compared with IL-1β group, bP < 0.05.Figure 5 Comparison of NF-κB protein levels in cells treated with Bor and IL-1β
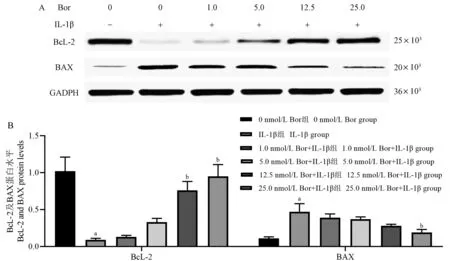
图6 Bor 联合IL-1β 处理各组细胞中BcL-2、BAX 蛋白水平比较(± s, n = 6 )Note.A, Protein band diagram.B, Corresponding histogram.Compared with 0 nmol/ L Bor group, aP < 0.05.Compared with IL-1β group, bP < 0.05.Figure 6 Comparison of BcL-2 and Bax protein levels in cells treated with Bor and IL-1β
NF-κB 分子是广泛表达的转录因子家族,参与应激反应、免疫、细胞增殖、炎性疾病和细胞凋亡等过程,是炎症细胞因子诱导的软骨细胞中分解代谢作用的中枢调节剂[17]。 当细胞受炎症因子刺激时可诱导IL-6、IL-8、环氧化酶2 等表达,从而促进细胞损伤、促进炎症反应[18]。 IL-1β 激活表面的细胞因子受体导致NF-κB 从细胞质转移向细胞核,从而促进炎症介质表达,可通过抑制NF-κB 水平从而缓解IL-1β 引起的软骨细胞炎症反应[19]。 而细胞凋亡与NF-κB 从细胞质向细胞核的转运密切相关[20]。 本研究发现,与0 nmol/ L Bor 组相比,IL-1β组细胞中NF-κB 蛋白水平升高,提示IL-1β 可促进NF-κB 水平表达,可能是IL-1β 促进NF-κB 从细胞质转移向细胞核转移诱导炎症介质表达促发炎症反应。 与IL-1β 组 相 比, ( 1.0、 5.0、 12.5、 25.0)nmol/ L Bor+IL-1β 组细胞中NF-κB 蛋白水平降低,且随着Bor 剂量升高,细胞中NF-κB 水平逐渐降低,提示Bor 可直接作用缓解IL-1β 导致的NF-κB 水平升高现象,且随着剂量升高,该作用效果明显,从而降低炎症因子水平表达,抑制细胞凋亡,实现对IL-1β 诱导的细胞炎症损伤的保护作用。
综上所述,Bor 对IL-1β 诱导的ATDC5 细胞可抑制细胞凋亡及炎症因子表达,实现对ATDC5 细胞的保护,可能是通过抑制NF-κB 途径实现的。
